双侧海马解剖、常见病变及发病机制研究进展
2023-05-22赵瑞清康国伟王倩冯波
赵瑞清 康国伟 王倩 冯波
滨州医学院附属医院神经内科,滨州 256600
海马是一种易感的可塑性大脑结构,在学习、记忆的处理中起关键作用,并与情绪、恐惧、焦虑和压力的调节密切相关[1]。人类海马结构高度复杂,可能受到多种神经系统疾病急性或慢性病理过程的影响,导致单侧或双侧海马病变。研究表明,双侧海马病变可能导致严重持续性、顺行性遗忘[2]。本文综述海马的解剖和双侧海马病变相关神经系统疾病,对临床相关神经系统疾病的预防、诊断和治疗具有十分重要的意义。
海马的发现
1587年,Arantius在《De humano foetu Liber》中描述了海马,观察到大脑脑室内结构呈卷曲状态后,使用术语“海马体”。此后,其他作者如Winslow强调了海马与公羊角的相似之处。Garengeot以古埃及神的名字命名海马为安蒙角。Glogi引入了银浸渍法以更好地研究海马细胞结构。1998年,联邦解剖学命名委员会(FCAT)将其命名为“海马本体”(hippocampus proper)和/或“Ammon’s角”(CA)[3]。在本文中,术语“海马”即海马本体。
海马的解剖、功能和血供
海马是位于颞叶内侧深处的细长凸起结构,大脑两侧各一个,沿着侧脑室下角底部呈弓状隆起[2]。成年人海马长4~5 cm,宽约1 cm,在冠状面上呈C形,与齿状回(DG)构成S形,纵轴上由头、体、尾部3部分组成,脑室部分位于侧脑室的颞角,室外部分位于海马旁回和钩上的颞叶内侧表面[4]。
在组织学上,根据细胞形状及大小,海马被分为CA1~4四个亚区。CA1区是其中最大区域,此区域90%神经元为锥体细胞,其余10%为中间神经元,其外侧以前下托为界,内侧以CA2区为界,是海马信息处理的最后输出地,对时间和空间记忆信息进行最终整合。CA2区为CA1区与CA3区之间的区域,朝向DG,具有相对致密狭窄的锥体细胞;人类海马的常规制备中,CA2区的边界很难确定,在社会认知记忆加工中起着重要作用。CA3区指向DG门部,内侧受限于CA2区,含有海马区最大的锥体细胞,在情景记忆与联想记忆中有快速编码的能力。CA4区是CA3区的直接延续,位于DG的凹陷中,目前对CA4区研究较少,功能尚不明确[5-8]。冠状切面海马亚区与齿状回见图1。
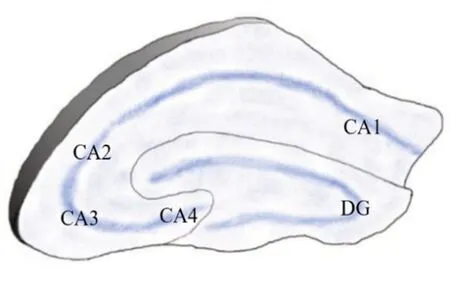
图1 冠状切面海马亚区与齿状回示意图
通常海马血液供给来自大脑后动脉和脉络丛前动脉,关于海马动脉起源及以上两种动脉对海马血供的贡献,尚未形成一致意见。据报道,海马血供主要来自大脑后动脉时,脉络丛前动脉的贡献因人而异。根据海马动脉的分布区域命名,主要的供血动脉有3条,其中海马前动脉供应海马头部,海马中、后动脉分别供应海马体、尾部。供应海马的动脉位于脑室腔外,在海马旁回背侧的下丘脑区,海马动脉与海马平行产生支动脉进入海马[9-10]。海马及其血液供应见图2。
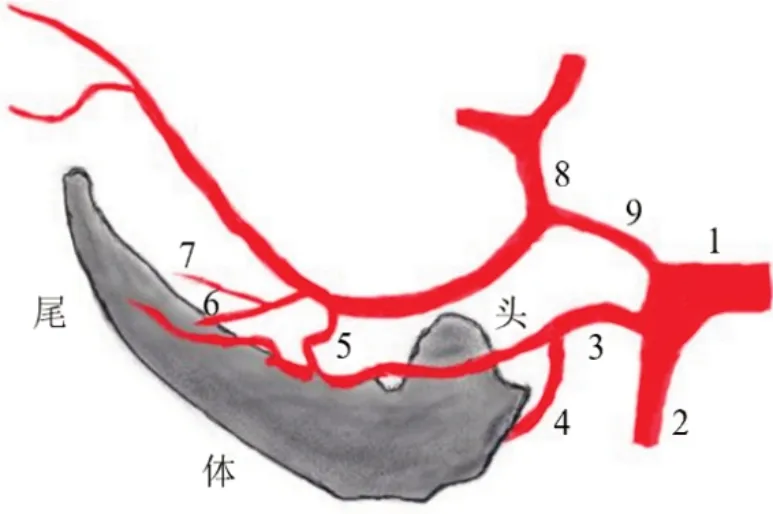
图2 海马及其血液供应示意图
双侧海马病变与神经系统疾病
1.衰老
衰老是一个不可逆的生物学过程,通常影响整个生物体,尤其大脑的衰老被广泛研究。海马随着年龄的增长而减少,海马萎缩逐渐导致的认知能力下降会对日常生活产生负面影响[11]。其机制尚不完全清楚,可能与神经元大小、复杂性和连接性减少、神经炎症激活、神经营养因子及神经发生减少等相互关联的机制有关[11-13]。胶质细胞和神经免疫途径(包括与补体级联、抗原呈递及巨噬细胞和小胶质细胞激活相关的信号)在衰老机制中发挥着重要作用[14]。在衰老大脑中,观察到巨噬细胞浸润、小胶质细胞激活以及未能恢复内稳态[11,13],星形胶质细胞失去执行其正常功能的能力,释放有毒因子,促进神经元和少突胶质细胞凋亡[15]。虽然免疫反应早期阶段可能具有神经保护作用,但慢性激活可能有害,被认为会引起持续的神经炎症,导致大脑中易感区域特别是海马的结构性衰退[11,16]。神经元死亡可通过神经再生得到部分补偿,然而随着年龄增长,海马神经受损[17]。神经营养因子和生长因子(如脑源性神经营养因子、成纤维细胞生长因子、胰岛素样生长因子-1、血管内皮生长因子)是神经发生的细胞外在调节因素,由于衰老的星形胶质细胞的局部产生相关因子减少和整体系统水平降低,这些因子及受体水平在衰老过程早期开始下降。此外,年龄引起的小胶质细胞激活和促炎因子对神经发生有负面影响。海马也是糖皮质激素(GC)的主要靶点,人类海马神经元和胶质细胞中均存在高水平的糖皮质激素受体蛋白α(GRα),分布于DG和CA亚区。海马神经元GRα随着衰老减少,而血液GC水平往往增加,产生低代谢、兴奋性毒性等作用,可引起神经发生减少,加速海马老化,并可在压力、应激等条件下进一步加重海马萎缩[18]。
2.缺血性脑卒中(CIS)
CIS是指脑部供血中断并侧支循环不足,引起脑组织缺血、缺氧,从而导致神经系统症状的临床综合征[19]。其主要原因有脑血栓形成、脑栓塞和血流动力学等机制[20]。虽然CIS是最常见的神经系统疾病之一,但海马CIS很少见,尤其是双侧孤立性海马梗死[21]。目前,孤立性海马梗死的发病机制尚不清楚。Kumral等[22]曾报道,双侧孤立性海马区梗死可能与心源性栓塞相关。Cole等[23]报道,基底动脉闭塞后双侧海马灌注量低,尽管早期取栓,双侧海马仍会发生梗死,分析原因为海马对缺血性损伤具有选择易感性。此外,脑缺血后神经病理现象持续时间远远超过最初的缺血损伤的急性期;在脑缺血后存活1年的动物中,严重的海马萎缩表现为一种活跃的、缓慢进展的神经病理过程,最终导致认知障碍[24]。研究还发现,脑缺血后在海马观察到的神经病理图像与阿尔茨海默病(AD)的神经退行性病变具有相同特征[25-26]。海马缺血后神经病理过程缓慢进展,即从最初的缺血性变化和锥体神经元死亡,到β-淀粉样蛋白(Aβ)和tau蛋白的产生和外渗,从系统循环中穿过缺血后的血脑屏障进入大脑,这些过程与海马不敏感区域的慢性神经元凋亡有关,最终形成淀粉样斑块和神经纤维缠结,最后表现出类似于AD的特征[24,27-28]。
3.边缘叶脑炎(LE)
LE是累及边缘系统的炎症性脑病,临床特征包括急性或亚急性起病的认知障碍,其他症状包括精神症状、行为改变、癫痫发作及睡眠障碍等[29]。根据病因不同,可分为感染性LE、自身抗体介导性LE(ALE)和伴有自身免疫性疾病性LE[30]。感染性LE常见于病毒感染,以单纯疱疹病毒1型(HSV-1)多见[31]。HSV-1可能通过以下3条途径进入脑内:三叉神经或嗅神经介导的直接浸润、中枢神经内潜伏感染再活化、中枢神经外再感染波及。3条途径病变进展中都累及颞叶、海马等大脑边缘系统。HSV-1感染引发先天性免疫系统强烈反应,炎症级联招募先天免疫细胞并引发适应性免疫,进而导致受感染细胞坏死和凋亡[32]。ALE按其免疫病理学相关联的抗体分类又可分为抗细胞表面或细胞外抗原的抗体相关LE和抗细胞内抗原的抗体相关LE。细胞表面或细胞外抗原包括N-甲基-D-天冬氨酸受体(NMDAR)、γ-氨基丁酸B受体(GABABR)、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPAR)等受体及电压门控钾通道(VGKC)、水通道蛋白4(aquaporin 4,AQP4)等通道,其共同特征为可直接被机体免疫系统成分所接触,进而产生相应抗体而致病。细胞内抗原,如Hu、Ri、Yo、GAD、Ma2、CV2等,被认为相应抗体无法接触细胞内表位,神经症状可能由CD8+T细胞介导[31]。LE免疫机制包括抗体、补体或T细胞介导的免疫反应,根据自身抗体的不同而有不同程度变化。但也有学者发现,在符合ALE的临床和副临床标准患者血清中未检测到抗体,然而其脑组织标本显示出密集淋巴细胞浸润物,提示自身免疫性脑炎[33]。在一项对ALE患者进行的一系列MRI研究中,最初观察到内侧颞叶(包括海马)的肿胀,继而为进行性萎缩,大多数患者持续存在高信号,这种炎症后海马萎缩会导致患者在疾病发展过程中出现持续性记忆障碍和神经功能障碍[34]。伴有自身免疫性疾病性LE包括系红斑狼疮性脑病、桥本脑病等,也可通过免疫机制导致边缘系统的损害。
4.AD
AD是一种中枢神经系统退行性疾病,起病隐匿,引起认知功能和行为进行性损害[35]。AD头颅MRI表现为内侧颞叶萎缩,尤其在海马[36]。在AD病程中,海马萎缩与衰老、Aβ沉积、过度磷酸化tau蛋白、载脂蛋白E(APOE)4等密切相关。衰老是散发性AD发生的主要危险因素,尽管在大脑正常老化过程中海马显示出与年龄相关的体积减小,但AD患者海马萎缩始终比其他区域明显且易损伤。因此,海马萎缩可作为AD病程中最具预测性和敏感性的生物学标志物之一[37]。AD的重要神经病理学特征是Aβ形成的神经炎性斑(NP)在细胞外沉积和过度磷酸化的tau蛋白形成的神经纤维缠结在神经元内逐渐沉积。研究表明,这些病理学改变与海马萎缩密切相关,可引发氧化应激、微血管功能障碍和血脑屏障破坏,并且诱导大脑内炎性反应激活,最终导致突触可塑性受损和神经细胞死亡[38]。此外,APOE的ε4等位基因是散发型AD的主要遗传危险因素[39],APOEε4影响海马萎缩的潜在机制不完全清楚。一项研究发现,年老的APOEε4小鼠中,可溶性和不可溶性Aβ均增加,该现象与海马萎缩呈负相关,进而证明APOEε4可通过调节Aβ的产生和沉积在海马萎缩中发挥重要作用[40]。另一项研究表明,APOE也可直接影响tau蛋白的发病机制、神经炎症和其介导的神经变性,而不依赖于Aβ的病理[41]。
5.海马硬化(HS)
HS是耐药性颞叶癫痫(TLE)最常见的组织病理性改变,它与癫痫反复发作互为因果[42]。多项回顾性研究显示,儿童早期脑损伤(热性癫痫、创伤、缺氧和感染等)可能是初始诱发性损伤[43],也可能与遗传易患性或LE相关[9]。部分患者还存在海马或颞叶外的第2种病变,即“双重病理”病变,包括皮质畸形、血管畸形和低级别神经胶质细胞肿瘤等。海马区外病变产生癫痫发作或亚临床发作活动,导致海马神经元丢失[42]。HS患者经常有双侧(10%)海马损伤:一侧表现出明显的HS特征,另一侧具有不同程度的损害。双侧HS(BHS)与单侧HS相比,表现出明显的差异,如智力低下、癫痫持续状态和精神错乱的发生率增加[44]。HS宏观上表现为海马组织逐渐收缩和硬化,微观上为星形胶质细胞增多和累及CA1、CA3及CA4亚区的神经元丢失,CA2亚区通常被保留下来,反映了常见的细胞保护机制[45]。HS其他改变包括DG颗粒细胞层的弥散(此现象似乎是癫痫患者特有)及DG分子层内苔藓纤维(颗粒细胞轴突)的萌发。对癫痫持续发作后海马损害的机制的认识主要来自癫痫持续状态的动物模型。这些研究表明,其中一些海马神经元损害是癫痫持续状态期间发生的生理损害的继发性损害,如缺氧、低血糖和低血压,但大部分损害与这些因素无关,而是由于兴奋性毒性,其中癫痫活动的存在通过激活谷氨酸受体介导神经元死亡,钙过度内流主要通过NMDA受体,也可通过特定的AMPA受体亚型以及通过代谢性谷氨酸受体的激活,引起一系列级联反应导致细胞死亡[46]。
6.放射性脑损伤(RBI)
RBI是头颈部肿瘤患者放疗后产生的中枢神经系统损害性疾病[47]。其中放射后颞叶坏死(TLN)是鼻咽癌放疗后的后期并发症之一[48],病变主要位于颞叶底部,向周围延伸至侧脑室旁,累及海马等[9]。海马易受辐射影响,早期即表现为辐射引起的损伤[49],晚期症状往往表现为记忆下降、认知障碍[50]。RBI主要病理表现为不同程度凝固性坏死、脱髓鞘改变及胶质增生[9,49]。RBI发病机制尚不清楚,可能涉及多种机制[49-52],具体如下。⑴血管内皮损伤:放疗导致血管内皮细胞损伤、凋亡,导致血脑屏障破坏和血栓形成;此外,内皮细胞损伤释放大量氧自由基,诱导低氧诱导因子1α和血管内皮生长因子上调,引起血管通透性增加,加剧血脑屏障破坏、血管性水肿、血小板和纤维蛋白血栓形成、血管闭塞和缺血性改变。⑵胶质细胞损伤:放疗可直接损伤胶质细胞及其祖细胞,引起相应分子和细胞功能变化,导致血脑屏障破坏,脑水肿、缺氧加重,星形胶质增生和脱髓鞘改变。⑶神经元损伤:放疗直接对细胞DNA和RNA造成损害,并通过诱导钙内流,导致染色体疏松及细胞水肿,刺激神经元凋亡。⑷氧化应激、炎性反应诱发损伤:中枢神经系统内部和外部产生的氧化应激非常敏感,放疗中电离辐射产生大量氧自由基导致组织细胞损伤。同时,放疗可通过激活小胶质细胞和内皮细胞释炎症因子,形成炎性反应浸润,导致脑内微环境改变。中枢神经系统各成分之间构成严密。放疗通过以上多种机制直接杀伤海马神经元和间接影响海马微环境改变介导损伤。
综上所述,双侧海马病变与衰老、AD、CIS、LE、HS、RBI等多种神经系统疾病密切相关,多种机制可直接或间接导致双侧海马病变。现已有多种抗炎药物、营养神经药物及免疫抑制剂等药物应用于临床,进一步探究导致双侧海马病变的病因及潜在机制,为开发可行新治疗靶点提供基础。目前,对双侧海马病变发生及发展的分子机制研究有限,众多学者正进行大量持续性研究,期待相关研究成果能够改善疾病预后。
作者贡献声明赵瑞清:研究实施,论文撰写,数据采集,统计学分析;康国伟、王倩:数据采集,统计学分析;冯波:研究指导,论文修改,经费支持
