基于生物信息学分析BIRC5基因在胃癌中的表达及临床价值
2023-05-13林怡彤宋高臣
林怡彤,宋高臣
(牡丹江医学院,黑龙江 牡丹江 157011)
全球癌症统计数据(Global Cancer Statistics,GLOBOCAN)2020年数据显示,胃癌占所有新发癌症病例的5.6%,占全球所有癌症死亡病例的7.7%[1]。近几十年来,随着胃癌的检测以及化疗和靶向治疗方面取得的成就,死亡率有所下降,但胃癌的总体生存率仍然很低,据报道,所有阶段的5年生存率加起来为32%,而转移性疾病的5年生存率仅为6%[2]。因此,目前胃癌研究的主要目标之一是在早期发现胃癌。而生物标志物的发现至关重要。BIRC5又称Survivin,是一种免疫相关基因,属于细胞凋亡蛋白家族。BIRC5可能通过在肿瘤中过表达来抑制凋亡检查点,且有利于转化细胞异常的有丝分裂。近年来,已有多项研究报道了BIRC5在癌症中的作用[3-4],但是,对于BIRC5是否与胃癌患者的预后有关、BIRC5胃癌中的表达水平以及与免疫细胞和免疫细胞浸润的关系尚研究较少。
为了挖掘BIRC5基因在胃癌患者中的表达水平,分析其在胃癌组织中免疫细胞浸润中的作用以及对胃癌患者预后的影响,本研究收集了多个公共数据库数据,为评估胃癌患者预后提供了一定的生物信息学证据。
1 材料与方法
1.1 生物信息学分析资料通过BioGPS数据库(http://biogps.org)分析BIRC5基因在正常人体不同组织中的分布。使用TIMER数据库分析BIRC5mRNA在不同恶性肿瘤中的表达水平。基于GEPIA数据库(http://gepia.cancer-pku.org)分析BIRC5基因在正常胃组织和胃癌组织中的表达。基于Kaplan-Meier Plotter数据库(http://kmplot.com),分析BIRC5基因表达与患者OS、PPS的关系。利用Coexpedia数据库(https://www.coexpedia.org)对BIRC5进行在胃癌中的分子调控网络分析。利用String数据库(http://string-db.org)对BIRC5和相关基因进行分析,如基因本体论(GO)功能注释,京都基因与基因组百科全书(KEGG)富集分析,构建蛋白质-蛋白质互作网络。借用肿瘤免疫评估数据库(TIMER,https://cistrome.shinyapps.io/timer),分析BIRC5在B细胞等6种免疫细胞中的表达和对胃癌患者生存预后的影响。
1.2 BioGPS数据库检索方法设定检索为Gene:BIRC5,点击Search,选择Human物种。
1.3 GEPIA数据库检索方法设定检索标准为:Gene:BIRC5,Log2FC≥1,P<0.05,Cancer Type:Gastric cancer。
1.4 Kaplan-Meier Plotter数据库分析设定检索标准如下:(1)Cancer:Gastric cancer;(2)“Gene:BIRC5”;(3)“Survial:OS,PPS”。
1.5 Coexpedia 数据库检索方法设定检索标准为:(1)Submit:Human BIRC5;(2)MeSH incl.Neoplasms:Stomach Neoplasms。利用score筛选关键基因进行研究。
1.6 String数据库检索方法设定检索标准为:(1)Protein Name:“BIRC5”;(2)Organism:“Human”;(3)Pathway:“KEGG”。
1.7 TIMER数据库检索方法设定条件:(1)“Diff Exp:BIRC5”;(2)“Gene Symbol:BIRC5”;(3)“Cancer Types:Stomach Adenocarcinoma”;(4)“Cancer:Stomach Adenocarcinoma”;(5)“Gene:BIRC5”;(6)Survival Time Between:0-12/36/60Months;(7)Correlation。
1.8 统计学方法采用数据库默认的统计学方法。用Pearson相关分析BIRC5与相关基因表达的关系;采用Kaplan-Meier计算患者生存率,并用log-rank检验方法分析BIRC5的表达与患者生存预后的关系。P<0.05为差异有统计学意义。
2 结果
2.1 BIRC5mRNA在正常胃组织中的表达BioGPS数据库分析表明,BIRC5在人体正常胃组织中表达不高,而在身体其它多种组织中也低表达(图1)。

图1 BIRC5在正常人体组织中的表达图
2.2 BIRC5在胃癌组织表达情况GEPIA数据库在线分析结果表明,BIRC5在胃癌组织中的表达量明显比癌旁组织高(P<0.05,见图2)。

图2 BIRC5胃癌组织中表达升高
2.3 BIRC5mRNA在不同肿瘤类型中的表达情况TIMER数据库中的BIRC5mRNA在包括胃癌在内的多种癌症中呈现高表达趋势,如乳腺浸润癌(BRCA)、胆管癌(CHOL)、结肠癌(COAD)、膀胱尿路上皮癌(BLCA)、食管癌(ESCA)、头颈鳞状细胞癌(HNSC)、肝细胞癌(LIHC)、肾嫌色细胞癌(KICH)、肾乳头状细胞癌(KIRP)、肾透明细胞癌(KIRC)、直肠腺癌(READ)、肺鳞癌(LUSC)、肺腺癌(LUAD)、前列腺癌(PRAD)、胃癌(STAD)、子宫内膜癌(UCEC)、甲状腺癌(THCA)。

图3 TIMER数据库中BIRC5的mRNA在多数肿瘤中呈现高表达
2.4 BIRC5与胃癌患者预后的关系利用Kaplan-Meier Plotter数据库在线分析BIRC5mRNA的表达水平与胃癌患者预后的关系。结果表明,高表达BIRC在胃癌中预示更差的总生存期(P=0.004 5)和进展后生存期(P=0.027,见图4)。
2.5 BIRC5在胃癌中的分子调控网络在本研究中,通过Coexpedia数据库选择出BIRC5在胃癌中的共表达基因共有50个,见图5。其中score>2的共表达基因有18个:UBE2C、TPX2、BUB1B、PRC1、CCNB2、KIF2C、SPAG5、CKS1B、CCNB1、CDK1、CENPA、NUSAP1、ANLN、NEK2、PARP1、MAD2L1、CDC20和TCP1。按score高低排序,筛选出排名前4的关键基因进一步分析,关键基因分别为UBE2C、TPX2、BUB1B、PRC1。

图5 BIIRC5在胃癌中的共表达分子网络
2.6 String数据库分析BIRC5共表达的基因网络及相关通路在Coexpedia数据库中筛选与BIRC5相关的主要蛋白,使用String数据库绘制与BIRC5相关的蛋白之间的潜在交互作用网络图(图6),并进行功能注释和KEGG通路富集分析。KEGG结果表明,BIRC5可能参与卵母细胞成熟信号通路、卵母细胞减数分裂信号通路、细胞周期信号通路和P53相关信号通路等。BIRC5主要存在于纺锤体、浓缩染色体着丝粒、微管细胞骨和染色体区域等中;分子功能主要包括与蛋白质结合、酶和微管的结合、细胞周期蛋白依赖性蛋白丝氨酸/苏氨酸激酶调节活性等;生物学过程包括细胞分裂、有丝分裂细胞周期过程、有丝分裂核分裂、核分裂、染色体分离等(表1、2)。
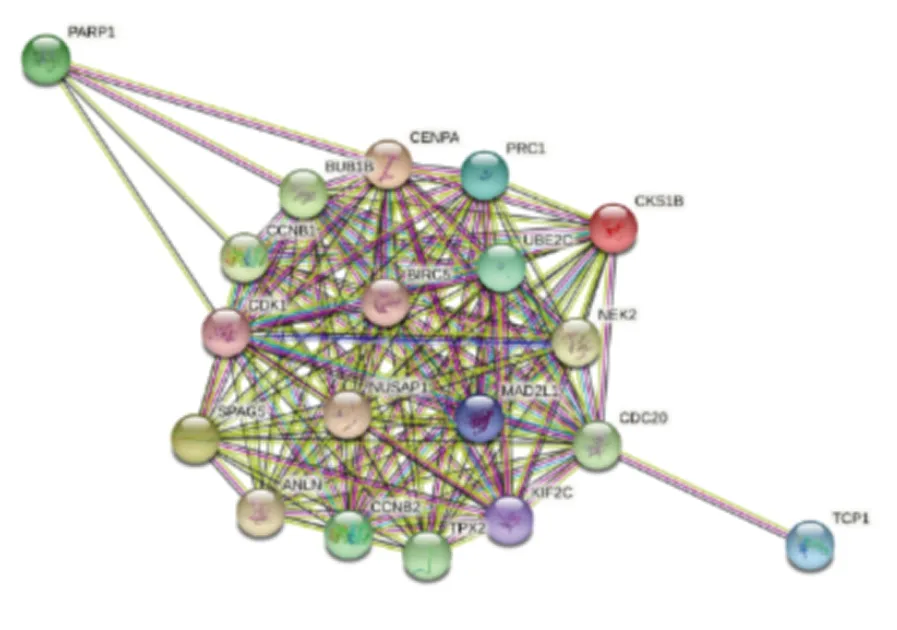
图6 BICR5相互关联蛋白网络图

表1 BIRC5共表达基因的GO功能分析结果(按P值排序的前5位)

表2 BIRC5共表达基因的KEGG通路富集分析结果
2.7 BIRC5mRNA在胃癌组织中与多种免疫细胞的关系利用TIMER数据库研究发现,在胃癌免疫微环境中,BIRC5mRNA的表达水平与肿瘤纯度呈正相关[偏相关系数(Partial cor)=0.16];另一方面,BIRC5在胃癌免疫微环境中与B细胞、CD4+T细胞、巨噬细胞和树突状细胞呈负相关(偏相关系数均为负值),而与CD8+T细胞、中性粒细胞的表达无确切关系(P>0.05,图7)。在巨噬细胞和树突状细胞中,低BIRC5mRNA表达组胃癌患者的预后生存率优于BIRC5mRNA高表达组(P<0.05,图8);而在CD4+T细胞、CD8+T细胞、中性粒细胞和B细胞中,BIRC5mRNA的低表达对胃癌患者的生存没有显著差异(P>0.05)。

图7 BIRC5与肿瘤免疫细胞间的相关性

图8 低表达BIRC5的巨噬细胞和树突状细胞对胃癌患者5年生存率的影响
3 讨论
胃癌是隐匿率和复发率较高的恶性肿瘤,全世界每年约有99万人被诊断为胃癌,大多数患者在确诊时已经处于局部进展阶段,导致高死亡率[5]。传统的化疗、放疗、手术等治疗方法对于大多数晚期胃癌患者来说很难完全切除肿瘤,而采用传统方法治疗的晚期胃癌患者的5年生存率很低[6-7],所以寻找新的治疗方法势在必行。BIRC5是含凋亡重复序列的杆状病毒抑制因子5,又称为Survivin,是细胞凋亡抑制因子家族的成员之一[8],在细胞周期调节、免疫系统活动和信号转导中发挥重要作用[9]。BIRC5的生物学作用是通过抑制caspase3和caspase7的启动和效应活性以及与有丝分裂纺锤体的微管结合来对抗细胞凋亡,破坏与生存相关的通路会导致细胞凋亡增加,并减缓肿瘤生长[10]。Cao等[11]报道OCT4通过提高BIRC5的启动子活性来使促进肝细胞癌的进展。因此,BIRC5可能是一个潜在的治疗靶点,也是癌症治疗的预测因素。Dai等[12]研究表明,BIRC5在乳腺癌中高度表达,其表达与无复发生存期和总生存期相关,可作为潜在的治疗靶点和预测标志物。此外,最近的一项研究表明,microRNA-203通过抑制BIRC5的表达来抑制三阴性乳腺癌细胞的增殖和转移[13]。多项研究发现, BIRC基因在包括细胞周期调节、细胞生长、免疫反应和癌症进展等多种生理过程中起着关键作用[14]。上述研究表明,BIRC5基因在多种肿瘤中可能发挥着不同的作用。
迄今为止,BIRC5基因在胃癌中表达的特定机制尚有争议,BIRC5基因与胃癌免疫细胞浸润的关系尚不清楚。基于目前研究背景,通过BioGPS、GEPIA和Kaplan-Meier Plotter数据库深入评估BIRC5基因数据的表达,探寻BIRC5基因在胃癌组织和正常组织中的差异表达与患者预后的关系。本研究结果发现,BIRC5在大多数肿瘤,特别是胃癌组织中高度表达。基于Kaplan-Meier Plotter数据库分析,发现BIRC5基因的表达水平对胃癌患者的总生存期(OS)及进展后生存期(PPS)有显著影响,BIRC5mRNA低表达组胃癌患者的OS和PPS均显著延长,说明BIRC5基因低表达的胃癌患者预后可能会更好。接着通过Coexpedia数据库挖掘BIRC5相关蛋白质,对这一系列蛋白进行了KEGG通路富集分析和功能注释,主要涉及的KEGG信号通路有P53相关信号通路、细胞周期信号通路、卵母细胞成熟信号通路以及卵母细胞减数分裂信号通路等;功能注释主要包括细胞分裂等。肿瘤微环境可能影响肿瘤的进展和复发。研究表明,肿瘤微环境中的免疫细胞具有促进肿瘤或抑制肿瘤的活性,被认为是临床结果和免疫治疗反应的重要决定因素,肿瘤内免疫浸润细胞亚群和/或数量的变化可能对疾病的预后以及免疫疗法的诊断和有效性产生积极或消极的影响[15]。本研究表明,BIRC5的表达可能与4种免疫细胞类型的浸润显著相关,提示BIRC5除了反映疾病的预后外,还可能反映免疫状态。BIRC5在免疫浸润细胞中检出,可影响免疫细胞与恶性肿瘤细胞的关系,从而调节胃癌的进展。TIMER数据库显示,BIRC5mRNA水平较低的巨噬细胞和树突状细胞的胃癌患者生存较好,这表明BIRC5水平较低的肿瘤浸润巨噬细胞和树突状细胞可能抑制肿瘤细胞的增殖。虽然生物信息学研究表明,BIRC5对胃癌的进展有影响,但影响胃癌的方法还需要进一步的实验性研究和分析以及对临床数据的讨论。
综上所述, 本研究系统分析了BIRC5基因在胃癌中的差异表达和预后价值。胃癌组织中BIRC5的表达水平显著升高,BIRC5基因的低表达与胃癌患者的OS和PPS有关。这些结果表明,BIRC5可能是预测胃癌患者生存的潜在预后生物标志物。此外,在胃癌中,BIRC5的表达与多种免疫细胞的浸润密切相关,包括巨噬细胞、B细胞、CD4+T细胞和树突状细胞。因此BIRC5有望成为胃癌的诊断及预后生物标志物以及免疫相关疗法的靶点。
