CDK7抑制剂THZ1对人结直肠癌SW480细胞增殖、迁移及凋亡的影响
2023-05-13王建哲于伟光贾信奇赵岩松李敏捷
王建哲,赵 奇,于伟光,贾信奇,赵岩松,李敏捷,范 东,姜 浩
(1.牡丹江医学院;2.牡丹江医学院附属红旗医院普外一科,黑龙江 牡丹江 157011)
结直肠癌是世界三大常见的恶性肿瘤之一,主要为早期发病隐匿,缺乏临床特异性,且患死率较高等特点,目前依然采取以手术切除为主,放疗及化疗为辅等临床治疗理念[1]。虽然外科手术及辅助治疗已经发展迅速,但在延长患者生存期及抑制肿瘤复发方面的效果仍需提高[2],CDK7具有调节生物过程的能力,包括细胞周期和基因转录,CDK7活性异常在各种肿瘤中被观察到,是肿瘤发生的驱动力,因此,CDK7可能是癌症治疗的一个有吸引力的靶点[3-4]。THZ1是新型的CDK7抑制剂,该抑制剂在体内外具有较高的靶向选择性,在对不同类型癌症的抗肿瘤治疗中具有巨大的潜力[5]。本研究探讨CDK7抑制剂THZ1对结直肠癌细胞的增殖、迁移及凋亡的影响,为临床有效治疗结直肠癌提供参考。
1 实验资料与方法
1.1 材料细胞:人结直肠癌细胞系SW480细胞,购自赛百慷(上海)生物技术有限公司。药品与试剂:THZ1,购自TagerMol中国公司。L15培养基培养基,购自赛百慷(上海)生物技术股份有限公司;优质胎牛血清,购自上海美伦生物科技有限公司;Cell Counting Kit-8(CCK8)试剂盒,购自赛文创新(北京)生物科技有限公司;鼠抗人GAPDH抗体、Bcl-2抗体、Bax抗体、Mcl-1抗体、Parp抗体,购自艾比玛特医药科技(上海)公司;CDK7抗体,购自美国Affinity公司;HRP标记山羊抗兔二抗,购自美国ImmunoWay公司;TUNEL试剂盒购自伊莱瑞特(武汉)生物技术股份有限公司。仪器:酶标仪 SMP500-18335-ELRO 美国 MolecularDevices,凝胶成像系统 Amersham Imager600 美国 GE,激光共聚焦显微镜 FV1000(TY1318) 日本 OLYMPUS,电泳仪 DYY-7C 中国 北京六一,超灵敏多功能成像系统 Universial HoodⅡ 英国 Syngene。
1.2 实验方法
1.2.1 细胞培养 复苏SW480细胞培养于含优质胎牛血清10%;双抗1%的L15培养基中,放入37 ℃、100%空气培养箱,每1~2 d更换1次培养液,当细胞处于对数生长期(细胞铺满培养皿底部80%左右)时进行传代培养,收集对数期细胞进行后续实验。
1.2.2 CCK8法检测细胞增殖活性 取处于对数生长期SW480细胞,消化后离心,在离心管内将细胞悬液充分打匀后计数,每孔5×103个细胞加入96孔培养板,每组设置3个复孔,在37 ℃、100%空气培养箱的条件下培养24 h,设置空白组、对照组、实验组,空白组加入等体积的培养液,对照组加入相应体积的二甲基亚砜(Dimethyl Sulfoxide,DMSO)培养液,实验组THZ1药物浓度分别为20、40、80、160、320、640 nmol/L,放入培养箱中培养48 h后取出96孔板,每孔加入10 μL CCK8试剂,避光孵育4 h后使用酶标仪在450 nm波长下测定各孔的吸光度值(Optical Density,OD),根据如下公式计算细胞生长的存活率:Activity%=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%,实验重复三次。使用Graphpad Prism 8软件计算药物的半数抑制浓度,即IC50值。依据IC50选取低、中、高浓度组,其中THZ1药物浓度分别为20、80、160 nmol/L用于后续实验。
1.2.3 平板克隆实验检测细胞克隆能力 取处于对数生长期的SW480细胞,消化后离心、重悬并计数,每孔1×103个细胞数加入6孔板中,设置对照组、低浓度组、中浓度组、高浓度组,每孔细胞悬液体积为2 mL,均匀慢速晃动6孔板使细胞均匀分布在6孔板内,后将6孔板放于37 ℃、100%空气培养箱中培养14 d,每4 d更换1次培养基,当细胞克隆数大于50个时停止培养,吸掉培养液,用PBS缓慢冲洗三次,加入甲醛固定20 min,晾干后用结晶紫染色30 min,冲洗后拍照,Image J软件分析大于50个细胞菌落计为有效菌落,并计算克隆形成率。实验重复3次。
1.2.4 平板划痕试验 取处于对数生长期的SW480细胞,细胞密度为每孔5×105,放入37 ℃、100%空气培养箱中培养,待细胞生长密度为90%后,用200 μL枪头划出无细胞区,PBS缓慢冲洗,设置对照组、低浓度组、中浓度组、高浓度组,用倒置显微镜观察细胞并记录,记为0 h,放入37 ℃、100%空气培养箱内继续培养,48 h后拍照并记录,实验重复三次,用软件Image J处理图片,统计数据,再用GraphPadPrism 8软件绘制柱状图,并分析数据。划痕愈合率(%)=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×100%。
1.2.5 TUNEL法检测细胞凋亡 取无菌盖玻片放于6孔板中,设置对照组、低浓度组、中浓度组、高浓度组,放入37 ℃、100%空气培养箱中培养2 d。按照TUNEL细胞凋亡检测试剂盒说明书步骤操作,室温避光下加入DAPI染色液,染色5 min,样本用PBS洗4遍,每遍5 min;滴加抗荧光淬灭剂封片,在激光共聚焦显微镜下观察细胞并记录图像,实验重复三次。
1.2.6 蛋白质印迹法检测蛋白表达水平 细胞培养,设置对照组、低浓度组、中浓度组、高浓度组,在37 ℃、100%空气培养箱中培养48 h后,PBS冲洗3遍,于冰上裂解后离心取上层清液,进行蛋白定量检测,配置12%SDS-PAGE凝胶,电泳电压为70 V,待标记物分层均匀后将电压调到110 V继续电泳,当标记物即将到达分离胶底部时停止电泳,300 mA转膜2 h,5%脱脂奶粉封闭2 h,TBST洗膜3次,加入稀释的一抗CDK7(1∶3 000)、p-CDK7(1∶2 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、Mcl-1(1∶1 000)、Parp(1∶1 000)、内参Gapdh(1∶1 000),在4 ℃冰箱内摇床过夜,次日将一抗回收,TBST洗膜3次,加入稀释的二抗(1∶20 000)于室温下孵育1h,进行洗膜、显影,分析计算每个蛋白相对表达水平,实验重复三次。
1.3 统计学分析采用Graph Pad Prism 8和SPSS 22.0统计软件进行数据分析,计量资料用数据“均数±标准差”表示;两组间比较采用t检验,多组比较采用单因素方差分析;计数资料用率表示,以P<0.05为差异有统计学意义。
2 结果
2.1 THZ1抑制SW480细胞增殖实验结果表明,当THZ1药物浓度大于80 nmol/L与对照组相比抑制SW480细胞增殖,差异有统计学意义(P<0.05),THZ1对SW480细胞的IC50为102.3 nmol/L,见图1。

图1 CCK8法检测THZ1对SW480细胞增殖能力的影响
2.2 THZ1抑制SW480细胞克隆形成比较对照组和低、中、高浓度组的SW480细胞克隆形成率。低、中、高浓度组SW480细胞克隆能力低于对照组,差异有统计学意义(P<0.05),证明THZ1能够抑制SW480细胞的增殖能力。见图2。

图2 平板克隆实验检测THZ1对SW480细胞克隆形成能力的影响(结晶紫染色,×40)
2.3 THZ1抑制SW480细胞迁移比较对照组和低、中、高浓度组的划痕愈合率,低浓度组的划痕愈合率低于对照组,中浓度组的划痕愈合率低于对照组,高浓度组的划痕愈合率低于对照组,差异有统计学意义(P<0.05),见图3。

图3 划痕实验检测THZ1对SW480细胞迁移能力的影响
2.4 THZ1促进SW480凋亡比较对照组和低、中、高浓度组的凋亡率,其中低、中、高浓度组的凋亡率高于对照组的凋亡率,差异有统计学意义(均P<0.05),证明THZ1促进SW480细胞凋亡,见图4。


图4 TUNEL实验检测THZ1对SW480细胞凋亡情况的影响(×20)
2.5 THZ1影响SW480细胞关键分子及凋亡蛋白的表达高浓度组CDK7、p-CDK7、Bcl-2、Mcl-1蛋白表达水平低于对照组,高浓度组Bax、Parp蛋白表达水平高于对照组,差异均有统计学意义(均P<0.05),说明THZ1可促进SW480细胞凋亡,抑制其增殖,见图5。

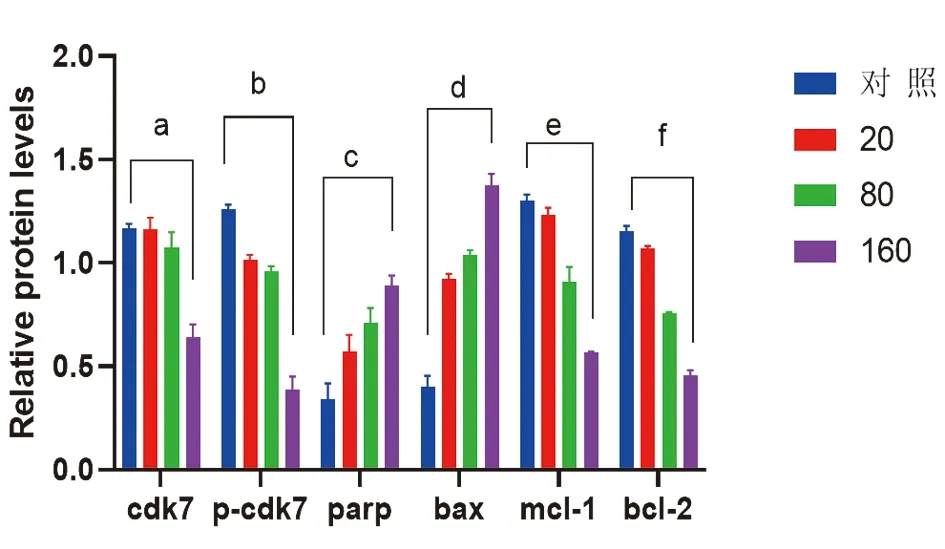
图5 THZ1对SW480细胞中CDK-7、p-CDK7、Bcl-2、Mcl-1、Bax、Parp的影响
3 讨论
结直肠癌是世界上最常见的恶性肿瘤之一,随着早期筛查推广,年轻人结直肠癌发病率也在逐渐增加[6],危害人类的健康。目前结直肠癌的治疗方法主要有手术,化疗,放疗及免疫等综合治疗,虽然随着医学的不断发展,医疗技术水平也在逐渐提高,但是治疗后的效果仍然不理想[7]。每种治疗方法都存在各自的弊处,如转移、复发、药物耐药等[8]。因此迫切需要新的有效药物进行治疗。
细胞周期蛋白依赖性激酶(Cyclin-Dependent Kinases,CDKs)是丝氨酸/苏氨酸激酶家族,在细胞周期中起到主要调控作用[9]。癌症的特征是细胞周期中的分裂和转录不受控制[10],CDKs过度活化是其产生的原因之一。选择性地抑制CDKs成为肿瘤治疗的研究热点。
CDK7作为CDKs家族的重要成员,不同于其他CDKs,CDK7拥有双重功能,可同时调控细胞周期和转录[11]。一方面,CDK7是异源三聚体产物CDK激活激酶(CDK Activating Kinase,CAK)的重要组成部分,这个三聚体可以磷酸化CDKs的T环结构从而调控细胞周期的多种 CDK(1、2、4、6)激酶,主导着细胞周期的启动、进行和结束[12-13]。另一方面CDK7与细胞周期蛋白H和MAT1,共同形成转录因子IIH(Transcription FactorIIH,TFIIH)的核心部分TFIIH相关激酶活性的第一个靶点是RNA 聚合酶 II 大亚基的羧基末端结构域(Carboxyl-Terminal Domain,CTD),在CTD序列中,Cdk7优先磷酸化Ser5和Ser7位置,推动转录的起始[14]。
近年来,CDK7在肿瘤进展中的关键作用和分子机制逐渐被揭示,这激发了人们对CDK7治疗癌症的兴趣。现如今,CDK7抑制剂已被开发为潜在的癌症治疗方法,并已在多种肿瘤中进行了实验[15]。目前研究发现许多CDK7抑制剂,其中最突出的是THZ1。THZ1是苯基氨基嘧啶衍生物,是第一个被研究出来的共价小分子抑制剂,THZ1能够与 CDK7 选择性结合抑制其活性[16]。THZ1对胶质瘤、乳腺癌、卵巢癌、B细胞急性淋巴细胞白血病、骨髓瘤、肺癌等都有明显的抑制作用[17-21],但是其在结直肠癌中的作用尚未有明确报道,有学者报道CDK7在结直肠癌组织中高表达,在癌旁组织中低表达[22],故本研究应用THZ1作用于结直肠癌SW480细胞观察其作用效果。
本研究通过CCK8检测发现在48h的SW480细胞增殖活性检测中,发现THZ1浓度为0~40 nmol/L时,细胞存活率下降趋势较为平缓;药物浓度处于40~160 nmol/L时,细胞存活率下降较陡直,推测SW480细胞在THZ1浓度小于40 nmol/L时具有耐受性。平板克隆实验表明THZ1可明显降低结直肠癌SW480细胞克隆形成率即抑制其增殖。划痕实验及TUNEL法说明随着THZ1浓度增大有效抑制结直肠癌SW480细胞的迁移能力,其细胞的凋亡率也在逐渐增高。通过蛋白质印迹法检测证明THZ1可抑制CDK-7及pCDK-7的表达;Bcl-2和Mcl-1细胞是抗凋亡基因[23-24],在THZ1处理后Bcl-2和Mcl-1蛋白表达明显下调,从而促使肿瘤细胞发生凋亡;Bax、Parp蛋白表达水平则在THZ1处理后升高,研究发现当Bax表达较高时,与线粒体膜上的蛋白相互作用,最终导致底物Parp被切割,促进细胞凋亡[25]。
综上所述,CDK7抑制剂THZ1可以抑制人结直肠癌SW480细胞增殖和迁移并诱导细胞凋亡,有希望成为未来治疗结直肠癌的靶向药物。但THZ1是否会成为结直肠癌治疗的靶向药物,还需进行体内实验加以验证。THZ1有抑制细胞增殖的作用,是否会对正常细胞存在毒性也需要进一步研究。
