基于网络药理学探讨槲皮素联合山柰酚治疗DPN的作用机制
2023-05-13卯明艳杨时骐王高强余炫颉余开湖
卯明艳,杨时骐,王高强,余炫颉,余开湖
(1.六盘水职业技术学院,贵州 六盘水 553000;2.咸宁市中心医院介入科;3.湖北科技学院医学部药学院;4.湖北科技学院医学部生物医学工程与医学影像学院,湖北 咸宁 437100)
糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)是糖尿病微血管并发症之一,也是导致糖尿病溃疡和截肢的重要原因,成为全世界最常见的神经病变形式[1-2]。目前认为氧化应激、AGE积累、血流紊乱和生长因子表达改变等因素与DPN发展有关[3]。DPN对于患者的身心健康来说可能是毁灭性的,包括跌倒、生活质量下降、活动受限和抑郁症状等[4]。但治疗选择有限,除了有效控制血糖、生活方式干预和止痛外,并没有获得许可的特殊性治疗,预防仍然是关键目标[1]。
槲皮素(Quercetin,Que)和山柰酚(Kaempferol,Kae)均是黄酮家族的重要成员,广泛存在于水果、蔬菜和红酒等饮食中,作为膳食补充剂,在增强免疫系统和促进健康生活中发挥重要作用[5]。Que的抗氧化、抗炎和免疫调节等生物功能使其成为病理机制涉及氧化应激、炎症和免疫的不健康状况的潜在候选者[6]。山奈酚的抗氧化功效也得到证实,可以通过调节氧化和亚硝化应激以及抑制脂质过氧化,减少糖尿病大鼠的 AGEs 形成,减轻患者疼痛症状[7]。鉴于Que和Kae来源的普遍性,众多中草药的共同成分,药理作用的广泛性,防治DPN有较多相同作用靶点,对DPN的防治具有较大潜力。因此研究Que和Kae对DPN的协同作用的分子机制是有意义的。
网络药理学随着系统生物学和计算机生物学的快速进步应运而生,并且对研究天然产物的作用机制具有重大的贡献,它将疾病与药物的对抗性发生了转换,开拓药物研究思路[8]。因此,本研究基于网络药理学的方法阐明Que联合Kae对防治DPN协同作用机制,明确两个单体组合的实用价值,为进一步研究和运用提供依据。
1 材料与方法
1.1 数据收集
1.1.1 获取Que和Kae的靶点 在TCMSP(https://old.tcmsp-e.com/)数据库中收集Que和Kae的作用靶点,筛选条件[9]设置为口服生物利用度(OB)≥30%和类药性(DL)≥0.18,汇总靶点蛋白。在Uniprot(https://www.uniprot.org/)数据库下载智人的基因序列,并对收集的作用靶点蛋白进行基因批量标准化注释,汇总后去重。
1.1.2 获取DPN的关联靶点 DPN的关联靶点以GeneCards(https://www.genecards.org/)数据库为主,靶点得分越高,越有望成为治疗该疾病的关键靶点[10],将均数作为靶点筛选的条件,以DisGeNET(https://www.disgenet.org/),OMIM(https://omim.org/)、PharmGKB(https://www.pharmgkb.org/)和Drugbank(https://go.drugbank.com/)数据库为补充,汇总所有靶点,去除重复项。运用“Venny” 在线作图软件(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图,得到Que联合Kae防治DPN的潜在靶点。
1.2 网络构建
1.2.1 建立成分-靶点-疾病网络图 运用Cytoscape 3.8.0软件绘制多层次网络图,揭示Que和Kae对防治DPN的共同靶点。
1.2.2 构建交汇靶点蛋白互作网络图 交汇基因被导入String(https://string-db.org/)数据库后获得PPI图,置信度得分大于0.7和去除断开节点是创建PPI的条件。并运用Cytoscape 3.8.0软件的Analyze Network工具进行拓扑分析,确定关键靶点,确定标准与Qu等人相似[11]。
1.3 关键靶点富集分析关键靶点在ClusterProfiler R包中做GO和KEGG功能富集及其可视化。pvalue、p.adjust和qvalue值小于0.05为筛选条件。获取GO条目下的生物过程(BP)、分子功能(MF)和细胞成分(CC)三类,以p.adjust和qvalue值升序排序,选取前10个条目做富集分析图。KEGG通路富集分析中,以数目降序或qvalue值升序排序,选取前30个通路做柱状图和气泡图。
2 结果
2.1 数据收集结果
2.1.1 Que和Kae靶点获取结果 严格按照靶点筛选条件,提取Que和Kae的作用靶点。Que有150个靶点,Kae有63个靶点。去除重复项和不能进行基因标准化注释的靶点蛋白,共获得157个作用靶点。
2.1.2 DPN关联靶点获取结果 GeneCards数据库有4 839个DPN的关联基因,选取关联分值大于平均分(8.1)的1 501个基因,在DisGeNET,OMIM、PharmGKB和Drugbank数据库中分别获得129、481、225和159个。汇总5个数据库的基因,去重后得到2 084个DPN关联基因。借助 “Venny” 在线作图软件的帮助,创建了韦恩图,确定交汇基因94个,如图1所示。

图1 韦恩图
2.2 网络构建结果
2.2.1 成分-靶点-疾病网络图结果 将2个活性成分和94个交汇基因导入Cytoscape 3.8.0软件中建立网络图,如图2所示。该网络图包括97个节点,219条边,证实Que和Kae防治DPN有较多的共同靶点(图中第2圈)。

图2 药—靶点—疾病网络图
2.2.2 交汇靶点蛋白质互作网络图结果 将94个交汇基因导入String数据库创建PPI图,如图3所示。图中包括94 节点,661 边,平均节点度值是14.1。
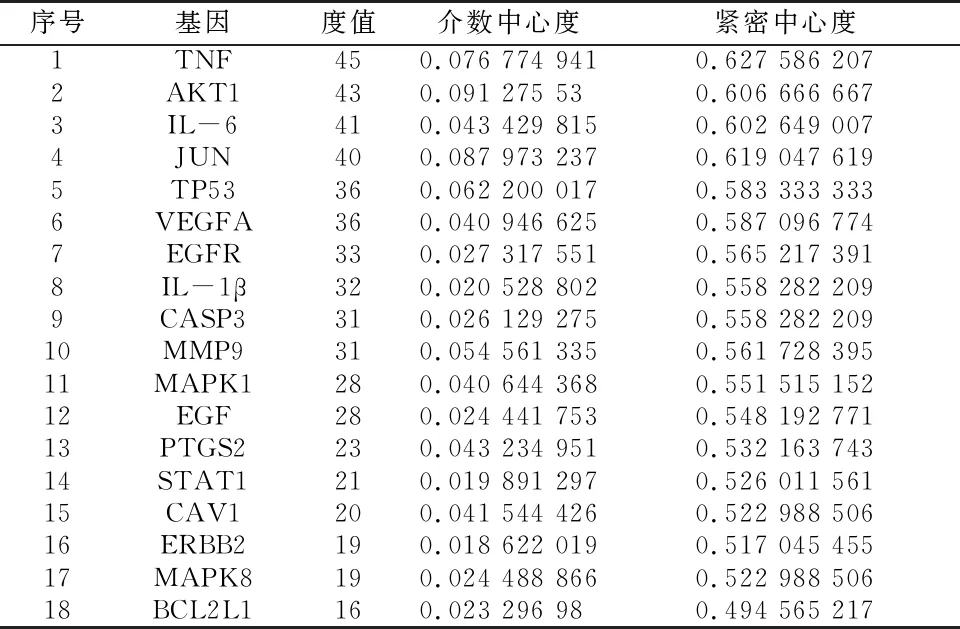
表1 关键靶点信息表

图3 交集基因PPI图

图4 关键基因PPI图和网络图
2.3 关键靶点富集分析结果GO和KEGG富集分析时,同时满足pvalue、p.adjust和qvalue的设置条件。得到1 619条BP,与细胞应激反应、抗氧化反应和上皮细胞增殖等过程有关。CC共计27个,主要是膜筏、膜微结构域和质膜筏等结构。MF共计46条,涉及到磷酸酶结合,细胞因子受体结合,以及生长因子受体结合等功能。KEGG富集到147条通路,关键靶点主要集中在胰腺癌相关机制,AGE-RAGE、TNF和MAPK 信号通路,以及脂质与动脉粥样硬过程。按照P值和q值由小到大排序,选择前10个做GO基因富集分析图,如图5所示。按照数目或q值取前30个通路制作气泡图和柱状图,如图6所示。其中胰腺癌相关机制、AGE-RAGE和TNF信号通路如图7所示。

图5 GO富集分析

图6 KEGG富集分析

图7 信号通路图
3 讨论
研究结果表明,Que联合Kae对DPN的防治作用有18个关键靶点,其中TNF、IL-1β、IL-6、BCL2L1 、VEGFA和 CAV1为促炎细胞因子,参与炎症反应;AKT1、TP53、JUN、PTGS2、STAT1、ERBB2、CASP3、MAPK8 、EGFR、EGF、MMP9与细胞增殖、分化、凋亡有关;MAPK1和MAPK8 与 MAPK 活性相关。主要是通过应激、细胞增殖、凋亡和影响ROS水平发挥防治作用。胰腺癌病理过程,AGE-RAGE、TNF和MAPK等信号通路均是关键靶点发挥防治作用的路径。充分说明Que和Kae防治DPN是通过多靶点、多途径实现的。
交汇靶点PPI网络图和拓扑分析结果表明,前10个核心靶点中的IL-6、TNF、IL-1β作为炎症标志物,在炎症反应中起关键作用。郑等学者的前瞻性队列研究中,充分说明DPN的发生与全身炎症反应息息相关,其中TNF-α、IL-6和ICAM-1水平直接影响个体DPN的发生率,IL-6在监测治疗效果中具有不可忽略的价值,尤其是下肢截肢的预测价值,所以积极控制炎症因子的水平对预防DPN有积极作用[12]。AKT1是 AKT 激酶的成员之一,作为PI3K的主要下游效应体,被AKT ser 473和Thr 308位点的磷酸化激活,参与PI3K/AKT通路,在细胞凋亡中起重要的调节作用[13]。JUN是JNK 信号通路的主要参与者,抑制JNK信号通路时,能促进胰岛素的敏感性和增强胰腺β细胞功能[14]。TP53是肿瘤抑制因子,控制无数信号通路,当它被代谢压力激活时可加速T2DM细胞衰老或引起胰岛素抵抗[15]。VEGFA是参与内皮细胞增殖、迁移、凋亡等生理过程的活性生长因子,有两个同工型家族,即 VEGF-A165 a和 VEGF-A 165 b,其中VEGF-A 165 a同种型在海马、背根神经节和视网膜神经元中具有神经保护作用[16]。EGFR是表皮生长因子受体家族成员之一。在高糖环境下,EGF可通过减少病原体识别受体和激活TLR 信号通路,调节初级免疫反应,降低炎症细胞因子(TNF、IL-6 和 IL-1β)水平[17]。CASP3编码半胱氨酸-天冬氨酸蛋白酶,在细胞凋亡的执行阶段起着关键作用。研究表明,抑制CASP3激活和降低 Bax:Bcl-2比值,可以抵抗糖尿病大鼠痛觉过敏和起到保护神经的作用,作用机制可能与抑制神经元凋亡有关[18]。MMP9属于基质金属蛋白酶(MMP)家族成员之一,MMP9可作为胰腺癌的预后标志物,可能是糖尿病、DPN和胰腺癌的治疗靶点[19]。由此可见,18个关键靶点的关系密切,对DPN的防治具有不可忽视的潜在作用。
关键基因的GO和KEGG富集分析表明,18个关键基因被分配到不同的BP、CC、MF和通路中,充分证实了Que联合Kae防治DPN的多靶点、多途径特点。细胞应激反应是主要的病理过程,与细胞内ROS的积累密切相关,进而诱发氧化系统与抗氧化系统失衡现象,导致多种大分子生物(DNA、蛋白质、脂质等)发生氧化损伤[20]。所以,有效控制细胞应激反应能延缓DPN的进程。膜筏是细胞膜上的一个微结构,在本研究中富集到的关键靶点数目最多,驻留在该结构中CaV直接影响β细胞功能,与T2DM发展较为密切[21]。主要的作用机制涉及到胰腺癌相关机制、AGE-RAGE和TNF信号通路,详见图7。
由图7(A)可知,胰腺癌的相关机制PI3K-Akt、ErbB和MAPK信号通路可能也是组合药防治DPN的作用机制。研究表明激活PI3K/Akt/mTOR信号通路,上调神经组织或DRG 神经元中 PI3K、Akt 和 mTOR 的磷酸化水平,有助于改善糖尿病大鼠坐骨神经轴突损伤,延缓DPN进展[22]。ErbB/HER蛋白酪氨酸激酶作为细胞信号家族之一,在生物学中研究最多的,而且ErbB信号传导与神经发育有关,包括电路生成、轴突鞘、神经传递和突触可塑性[23]。MAPK通路是参与炎症反应、细胞增殖和凋亡的重要信号通路,高糖诱导氧化应激的直接作用是导致神经元凋亡、神经元再生受损和神经病变[24]。由图7(B)可知,AGE/RAGE 信号通路激活涉及 NADPH 氧化酶、蛋白激酶 C (PKC)和MAPKs的多种细胞内信号通路。研究表明[25]当代谢变化,首先蛋白激酶C-β在神经血管中被激活,导致炎症性损伤,影响内皮的通透性和加速细胞死亡;C-α蛋白激酶在神经元轴突中失活,也导致不良后果;其次细胞外基质成分糖化会导致神经再生失败,加重神经病变;最后背根神经元 RAGE 增加,NF-κB 反应也增加,此反应持续存在将对不再生和累积损伤的神经元继续造成损害。由图7(C)呈现的TNF信号通路可知,细胞外的死亡信号可通过相应的受体传入胞内。TNFR1是死亡受体之一,属于跨膜蛋白,TNF与TNFR1结合,受体首先发生三聚体化,招募一个衔接蛋白TRADD,然后再招募其他的三个衔接分子(FADD、TRAF-2和RIP),最后上调凋亡执行者CASP3的活性,导致细胞凋亡的发生[26]。因此,糖尿病并发症中的AGE-RAGE 信号通路和TNF信号通路是Que联合Kae防治DPN最可能的作用机制,通过调节细胞凋亡、增殖、介导炎症反应、氧化应激发挥防治作用,值得进一步的关注。
综上所述,本研究通过网络药理学,分析了Que联合Kae防治DPN的潜在分子生物学机制。作用通路可能与胰腺癌、AGE-RAGE和TNF等信号通路有关,揭示了药物联合时多靶点、多通路的生物学特性。网络药理学是一种作用机制的合理推测,为体内外实验提供参考。我们将在此基础上开展进一步的体外实验验证,明确药物联合应用的价值。
