女性卵巢组织体外激活机制与临床应用研究进展
2023-03-18吴帮勇易红艳马燕琳黄元华
吴帮勇,易红艳,马燕琳,黄元华
(海南省人类生殖与遗传重点实验室,海南医学院第一附属医院生殖医学科,海南省地方病(地中海贫血)临床医学研究中心,海南医学院热带转化医学教育部重点实验室,海南 海口 571199)
1 前言
在女性体内,卵泡以始基卵泡的形式储存于卵巢的皮质部分,始基卵泡在多因素调控下处于休眠状态。通常1 个月经周期内有数百个始基卵泡被募集激活,激活后始基卵泡才具备继续发育为窦前卵泡、窦卵泡、排卵前卵泡和排卵的潜能,但1 个月经周期内一般只有1 个优势卵泡发育成熟[1]。由于遗传、免疫、医源性或其他原因,早发性卵巢功能不全(premature ovarian insufficiency, POI)患者在40 岁以前卵巢功能衰竭、出现闭经,流行病学调查显示POI 发病率约1%~2%,且有逐年增高的趋势[2]。尽管这类患者不排卵,但卵巢中仍含有残余的始基卵泡[3],只是自身无法激活卵泡继续发育[4]。既往POI 引起不孕的患者无法获得自身卵母细胞行体外受精(in vitrofertilization, IVF),通常只能采取卵母细胞捐赠的治疗方案[3]。
近年来,治疗这类患者使其可以利用自身卵母细胞受孕一直备受关注。随着不孕症治疗技术的发展,体外激活(in vitroactivation, IVA)技术的兴起为这个难题提供了解决方案[4],给POI 患者的辅助生殖治疗开辟了新途径。该技术主要是通过物理、化学等手段在体外刺激卵巢组织中处于休眠状态的始基卵泡[4],使其具备继续发育至成熟卵泡的潜力。当前,IVA 技术已成为解决那些无法通过自体激活始基卵泡的患者获得自身成熟卵母细胞的重要途径。基于临床的需求和对IVA 作用机制研究的不断深入,该技术已成为生殖医学领域研究的一大焦点,正逐步向临床应用推进。
2 女性始基卵泡体外激活的机制研究
在女性体内,休眠的始基卵泡由单层梭形原始卵泡颗粒细胞(primordial follicle granulosa cells, pf-GCs)包裹着初级卵母细胞组成,休眠状态受到叉头框转录因子O3a(forkhead box O3a, Foxo3a)、第10号染色体同源丢失性磷酸酶-张力蛋白基因(phosphatase and tensin homolog deleted from chromosome 10, PTEN)、结节性硬化症基因1(tuberous sclerosis complex gene 1, Tsc1)、结节性硬化症基因2(tuberous sclerosis complex gene 2, Tsc2)、叉头框L2 基 因(forkhead box L2, Foxl2)、p27KIP1 基 因(p27KIP1 gene, p27)、核 糖 体 蛋 白S6(ribosomal protein S6, rpS6)、3-磷酸肌醇依赖性蛋白激酶1(3-phospholipid-dependent kinase-1, PDK1)和 抗 苗 勒氏管激素(anti-müllerian hormone, AMH)等因子的共同调控,当某些因子的调控改变,始基卵泡的休眠状态被打破从而激活继续发育,或者发生退化、闭锁[5]。始基卵泡的激活过程涉及pfGCs 的增殖分化和初级卵母细胞的生长发育等方面[6]。有研究称,哺乳动物中pfGCs 在始基卵泡激活或休眠的调控中起主导作用[7]。始基卵泡中的pfGCs 可控制休眠初级卵母细胞的激活[7],同时激活的初级卵母细胞能够分泌刺激因子促进pfGCs 的增殖发育[8],两者相互促进,共同调控始基卵泡的激活发育。始基卵泡激活后,pfGCs 由初始的扁平状变为立方形,体积增大;初级卵母细胞体积增大开始向下一阶段发育,并分泌具有促进颗粒细胞发育作用的特异性生长分化因子9(growth differentiation factor-9,GDF9)和骨形态发生蛋白15(bone morphogenetic protein-15, BMP15)[8]。在女性体内,当激活的pf-GCs 数量增加到15 个时,初级卵母细胞开始快速生长[9]。
由于临床的需求,近年来IVA 技术作为一项解决女性生育问题的新技术逐渐体现出临床价值。目的是让始基卵泡摆脱休眠的束缚从而具备继续向下一阶段卵泡发育的能力。研究发现,在实施IVA 技术时,磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases, PI3K)/PTEN/蛋 白 激 酶B(protein kinase B, Akt)、雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、Hippo 等信号通路在始基卵泡的激活中起关键作用[10],见图1。
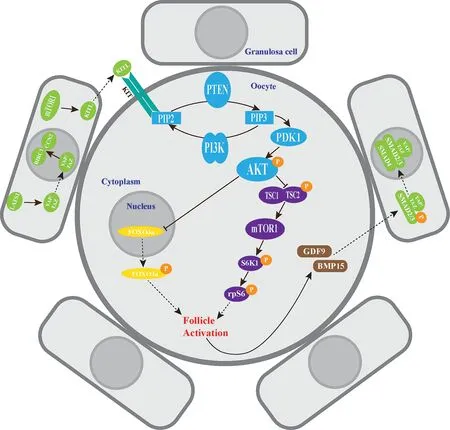
图1 始基卵泡激活信号通路示意图Fig 1 Schematic diagram of primordial follicle activation signal pathway
2.1 PI3K/PTEN/Akt 信号通路
PI3K 信号通路介导细胞的增殖、凋亡、存活、生长、迁移和代谢活性等过程,不仅与糖尿病、癌症等人类疾病密切相关[11],在卵泡激活中也起重要作用[12]。当前,PI3K/PTEN/Akt 信号通路是始基卵泡激活中研究最成熟的一条信号通路,也是启动始基卵泡激活最关键的信号通路之一[13]。PI3K 由一个调节亚基(p85)和一个催化亚基(p110)组成,是初级卵母细胞膜上接收颗粒细胞信号转导的关键因子[14]。在始基卵泡的激活过程中,初级卵母细胞PI3K 信号转导是激活休眠始基卵泡的必要条件[12]。PI3K 介导的信号转导在PDK1 上聚合[15],当初级卵母细胞膜上的PI3K 受到上游受体络氨酸激酶刺激将磷脂酰肌醇4,5 二磷酸(phosphatidylinositol (4,5)-bisphosphate, PIP2)磷酸化为3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol (3,4,5)-trisphosphate,PIP3),PDK1 将信号转导至Akt,胞内游离的Akt 受到刺激后磷酸化,将信号从细胞膜传送至细胞核内。核内的卵泡休眠因子Foxo3a 收到Akt 的信号后被抑制,移出细胞核[14]。脱离Foxo3a 的休眠抑制,初级卵母细胞被激活并继续发育,从而诱发始基卵泡的激活发育。其中,PTEN 在该条信号通路中起到负调控作用,通过将PIP3 去磷酸化为PIP2而参与始基卵泡的激活和休眠调控[14]。2013 年,日本科学家Kazuhiro Kawamura 首次报道通过体外添加PI3K 激活剂740Y-P 和PTEN 抑制剂bpV(HOpic)作用于女性卵巢组织,成功激活POI 患者的卵泡最终获得活产[4],开启了IVA 治疗不孕症的新模式。
2.2 mTOR 信号通路
在人体内,mTOR 通过整合细胞内和细胞外信号,不仅参与细胞的生长、增殖等机制调控,还参与调控人肿瘤的发生发展,分为mTOR 复合物1(mTOR complex 1, mTORC1)和mTOR 复合物2(mTOR complex 2, mTORC2)两种催化亚基[16]。在pfGCs 中,mTORC1 是接收卵泡激活信号的关键因 子[7]。pfGCs 通 过mTORC1-KIT 配 体(KIT ligand, KITL)信号通路将信号传导至休眠的初级卵母细胞,诱发初级卵母细胞激活发育[17]。当pfGCs受到营养、氧浓度和生长因子等因素改变的影响时,pfGCs 上的mTORC1 活性增强并进一步刺激KITL,使KITL 分泌上调。初级卵母细胞上的KIT受体与分泌的KITL 结合,继续刺激初级卵母细胞内 的PI3K[17],从 而 激 活PI3K/PTEN/Akt 信 号通路。
在初级卵母细胞中,mTORC1 也是休眠与激活的调控因子,处于PI3K/PTEN/ Akt 信号通路的下游,受到两个肿瘤抑制因子Tsc1 和Tsc2 组成的异二聚体复合物的负调控[5]。当Akt 抑制Tsc1/2 复合物继而抑制下游的mTORC1 表达,导致mTORC1活性减弱,被抑制的mTORC1 促进下游核糖体蛋白S6 激酶1(S6 Kinase 1, S6K1)磷酸化,S6K1 继续刺激下游的rpS6,继而促进初级卵母细胞蛋白质翻译和核糖体发生[18],启动初级卵母细胞的发育。另外,有研究称mTORC2 参与调控Akt 从而介导下游激活机制的发生[19]。
2.3 Hippo 信号通路
研究表明,Hippo 信号通路在控制组织器官大小、组织内稳态和再生中起重要作用,是组织过度生长的主要抑制通路[20]。在体外培养的条件下,通过切割卵巢组织可以激活Hippo 信号通路从而诱导卵泡的激活和早期发育。2018 年, Grosbois 的研究结果证实了在切碎培养的卵巢组织中,组织边缘部位被激活的卵泡数量较组织中间部位多,其激活机制是由Hippo 信号通路受到破坏干扰而诱发的[8]。破坏干扰Hippo 信号通路介导卵泡激活的优势在于只采用物理切割方法,而不需要添加其他化学制剂即可实现休眠始基卵泡的体外激活,有效缩短卵巢组织的体外培养时间并提高了IVA 技术的安全性。通常,在通过PI3K/PTEN/Akt 信号通路实施IVA技术时,都会伴随着Hippo 信号通路的激活,从而协同促进IVA 的作用效果[4,8]。
在休眠的始基卵泡中,Hippo 信号通路介导的激活机制主要在pfGCs 中进行。当卵巢组织破碎后,组织边缘pfGCs 之间的接触抑制解除,Hippo 信号通路中的大肿瘤抑制基因1(large tumor suppressor 1, LATS1)表达增加,高表达的LATS1 抑制pf-GCs 特异性表达的磷酸化YES 相关蛋白(yes-associated protein, YAP)/ PDZ 结合域转录共激活因子(transcriptional co-activator with PDZ-binding motif, TAZ),使其转移至细胞核内。细胞核中累积的YAP/TAZ 可提高结缔组织生长因子(connective tissue growth factor, CTGF/CCN2)和含杆状病毒重复序列1 蛋白(baculoviral IAP repeat containing 1, BIRC1)的转录,二者具有促进pfGCs 发育的作用[10,20]。发育的pfGCs 再通过mTORC1-KITL 信号通路将信号转导至初级卵母细胞并诱导激活,激活后的初级卵母细胞分泌的GDF9、BMP15 可与pf-GCs 中YAP 协同促进受体调节型SMAD2/3 蛋白的磷酸化,并与共调节型的SMAD4 蛋白结合,形成YAP-SMAD2/3/4 复合物进入细胞核,又可增进pf-GCs 的发育[8]。总之,Hippo 信号通路可协同PI3K/PTEN/Akt 信号通路共同促进休眠始基卵泡的激活发育[8]。
3 IVA 技术的临床应用研究
进行卵巢组织体外培养的第一步就是将处于休眠状态的始基卵泡激活,使卵泡具有在体外继续发育的潜力。来源可为手术新鲜取出的卵巢组织[4],也可为冷冻后解冻复苏的卵巢组织[21],最终使休眠的始基卵泡继续发育,获得成熟的卵母细胞用于受精。起初,IVA 技术在临床上应用的普遍做法是将离体卵巢组织髓质部分去掉,留下的皮质部分通过物理切碎破坏Hippo 信号通路,解除始基卵泡之间的休眠抑制。然后在体外培养时,添加PI3K/PTEN 信号通路的刺激因子,进一步激活卵巢中处于休眠状态的始基卵泡,从而实现激活效果[4]。而近来有研究发现,单纯通过物理切割破坏Hippo 信号通路同样可以实现始基卵泡的激活,这种无药物添加的激活方式有效提高了IVA 技术的安全性[22]。近年来,IVA 技术逐渐突显出优势,不仅可作为一种辅助受孕手段[4],也是一种潜在的女性生育力保存策略[21],因为IVA 技术不需要行激素刺激,既适用于育龄女性也适用于青春期前女孩[23]。
3.1 IVA 技术与自体移植
卵巢组织内的始基卵泡通过IVA 后重新获得继续发育的能力。但由于卵巢组织体内生长环境的复杂性,现今体外培养技术模拟体内卵泡发育的全过程仍处研究阶段。所以,为了使卵泡获得最优的发育环境,卵巢组织激活后的最佳选择是自体移植。2013 年,Kazuhiro Kawamura 团队利用手术新鲜取出的POI 患者卵巢组织进行IVA,自体移植回患者体内后监测到有卵泡继续生长发育,并回收到成熟卵母细胞,随后通过体外受精、胚胎移植获得1名健康出生的婴儿[4]。2015 年,该团队继续采用相同方法对冷冻的卵巢组织进行IVA,自体移植后也获得1 例活产儿[21],有效的将卵巢组织冷冻技术和IVA 技术相结合。2016 年,我国孙莹璞教授团队在国内首次利用该方法激活新鲜卵巢组织也获得1 例活产儿[24],进一步验证了IVA 的有效性。
当前,IVA 技术已逐渐成为治疗女性不孕的一种新途径,现今已有超过10 例IVA 治疗POI 患者的活产儿出生[25]。在有生育力需求的卵巢病变患者中,这种体外激活—卵巢碎裂的方法不仅对治疗POI 患者的不孕有成效,也对卵巢早衰患者、中年不孕妇女、接受绝育治疗的癌症患者以及其他卵巢储备减少、卵泡休眠和发育的调控失衡的患者有潜在价值[4,26]。另外也有研究称,对于含有次级卵泡的卵巢储备减少患者、早期POI 患者和多囊卵巢综合征患者,可直接通过无药物刺激Hippo 信号通路后,将卵巢组织碎片自体移植来获得妊娠[22,27]。现今IVA 治疗不孕患者累计妊娠已达26 例,活产18 例,另外还有不孕患者在持续妊娠中[28]。
3.2 IVA 技术与体外培养
卵巢组织体外培养是一个多步骤的培养过程,一般需要经过始基卵泡的激活、卵泡分离、卵泡3D培养、未成熟卵母细胞体外成熟(in vitromaturation, IVM)、IVF 等阶段[15,23,29],其主要优点是从始基卵泡的激活开始直到获得成熟的卵母细胞实施IVF 的全过程都可以在体外进行,无需将有病变的卵巢组织再移植回患者体内,有效降低疾病复发的风险。然而,当前通过该技术的完全开展实施,只在动物中获得分娩[30]。近年来随着3D 培养体系的建立和多步培养系统的完善[15],利用卵巢早衰患者卵巢组织,人类休眠卵泡在体外培养获得的卵母细胞可以达到MII 阶段[31]。但该技术还存在体外培养周期长,获得卵母细胞的效率和发育能力低下等缺点,至今还没有利用卵巢组织体外培养获得的卵母细胞受精产生囊胚的报道[10]。
尽管目前还没有对女性卵巢组织实施IVA 技术后继续体外培养获得妊娠的报告,但该技术在今后临床应用研究中仍然具有巨大的发展潜力。由于女性癌症发病率的升高,更多患者在进行癌症的化疗、放疗时,需提前采取卵巢组织冷冻的生育力保存措施,然而治愈后身体无法达到自体移植和激活卵巢组织的条件;另外有的患者卵巢组织发生病变,采取卵巢组织生育力保存后,如果再将发病的卵巢组织移植回体内,将会大大增加患者再患病的风险。倘若对这类患者实施IVA 技术后体外培养,不仅是保障患者安全、降低发病风险的有效方案,也是实现这类不孕母亲获得具备自身遗传物质孩子愿望的唯一途径[23]。
4 不足与展望
尽管IVA 技术具有创新性,但通过IVA 技术开展IVF 的妊娠率仅为9%[25]。近来也有报道对IVA技术的有效性提出了质疑[32]。有研究认为,通过IVA 技术获得的卵母细胞DNA 损伤增加、DNA 修复能力受损[33]。另外,由于国内外IVA 技术尚处研究阶段,无法证实IVA 药物不存在致癌或其他有害作用的可能性[25]。所以,IVA 技术要在临床上推广还有很大的探索空间。
一些有生育力需求的患者不能通过自体激活始基卵泡来获取成熟卵母细胞受孕,想利用自己的卵母细胞来获得妊娠成为她们的诉求,IVA 技术则是一个有效的解决途径。IVA 技术可利用卵巢组织中残余卵泡进行激活发育[4,21],使卵巢中的残余卵泡得到充分利用。就当前IVA 技术的发展现状而言,想要将其推向临床还需解决更多问题。比如,通过IVA 技术获得的卵泡、卵母细胞的发育质量还有待验证和提高;IVA 技术的体外培养体系也需要进一步完善;同时也还需要更规范的临床方案和伦理制度来保障安全实施。卵巢组织的体外培养与激活是一个复杂的、多阶段的过程,随着研究的不断深入,相信IVA 技术越来越成熟,将会继续拓宽生殖医学的发展领域,造福于更多不孕患者。
所有作者声明不存在利益冲突关系。
