子痫前期蜕膜巨噬细胞源性外泌体来源miR-146a-5p 通过靶向HIF1α 抑制滋养细胞的活力和侵袭能力
2023-03-18陈芳荣毛东瑞陈小菊
陈芳荣,毛东瑞,陈小菊
(海南省人民医院,海南医学院附属海南医院 产科,海南 海口 570311)
子痫前期(preeclampsia, PE)是一种妊娠期特发性疾病,以孕期出现高血压和蛋白尿为主要特征,国外文献报道其发病率和死亡率分别占孕妇的5%~7%[1]。成功的妊娠在很大程度上取决于母胎界面上独特的免疫微环境[2]。胎儿来源的滋养细胞、孕妇蜕膜基质细胞与孕妇蜕膜免疫细胞共同构成母胎界面[3]。滋养细胞形成胎盘的胎儿部分,其功能障碍被证实与PE 的发病密切相关[4]。巨噬细胞是蜕膜中数量第二的免疫细胞,在妊娠期参与先天性子宫免疫、胚胎着床、胎盘形成和分娩起始,对于维持妊娠时期母胎界面的正常微环境起到重要的作用[5]。然而,巨噬细胞对滋养细胞的具体作用尚不明确。作为一种细胞外囊泡,外泌体通过其包含的核酸、脂质和蛋白等活性物质,参与胎儿与孕妇物质交换[6]。研究表明,蜕膜巨噬细胞源性外泌体可以通过介导微小RNA(miRNA)调控妊娠疾病[7],但该类外泌体在PE 中作用尚未清晰。本研究将验证蜕膜巨噬细胞源性外泌体中的miR-146a-5p对滋养细胞的调控作用,及其相关分子机制,为PE分子调控机制深入理解提供新的思路。
1 材料与方法
1.1 研究对象
选择2021 年1 月~2021 年12 月在海南省人民医院妇产科住院的PE 患者15 例(诊断及分类标准依据谢幸主编第九版《妇产科学》)作为PE 组,正常妊娠孕妇15 例为正常对照组。PE 组与正常组患者的年龄、孕周等一般资料无统计学差异(见表1)。未曾患过高血压、糖尿病、肝炎、甲亢、感染等内外科疾病,无妊娠其他并发症,无服用免疫抑制药物史,且均为单胎妊娠首次剖宫产分娩。本研究经过海南省人民医院伦理委员会审批(医伦研[2021]300 号),并签署了患者知情同意书。
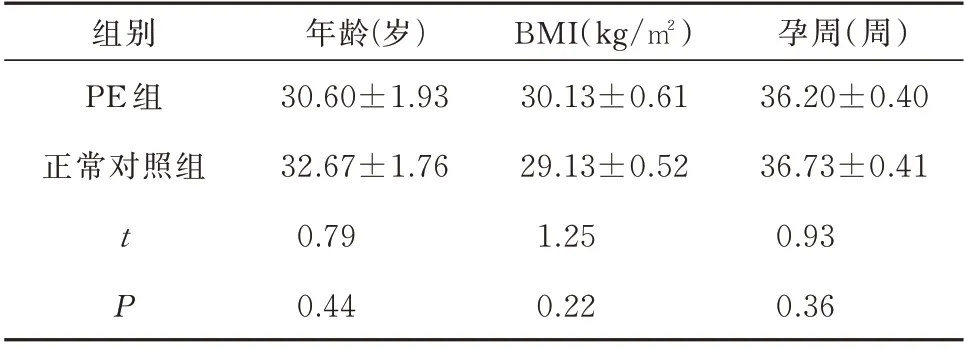
表1 两组患者一般资料比较(n=15)Tab 1 General data comparison between the two groups(n=15)
1.2 实验试剂
RPMI-1640 培养基(C11875500BT)、胎牛血清FBS(30044333)、青霉素/链霉素(15070063)购于Gibco;外泌体RNA 纯化试剂盒(EZB-exo-RN1)购自美国EZBioscience 公司;逆转录试剂盒(P312)和实时荧光定量PCR(Q331)购于南京诺唯赞生物科技有限公司;CCK8 检测试剂购于MedChemExpress公 司;CD14(ab221678)、CD63(ab134045)、HIF1α(ab179483)和GAPDH(ab181602 )一抗购于Abcam;HRP-羊抗兔IgG(BA1054)购于博士德生物科技有限公司。HTR8/Snveo 和293T 细胞均购买于中科院上海细胞库。
1.3 实验方法
1.3.1 蜕膜巨噬细胞分离和原代培养 在两组患者的胎盘娩出后立即刮取胎盘母面上的蜕膜组织,使用预冷的无菌PBS 冲洗干净,将组织剪碎过滤,采用RPMI-1640 完全培养基制成细胞悬液。使用密度梯度法离心分离得到单个核细胞,接着采用流式细胞术进行CD14 阳性细胞分选,进而获得巨噬细胞。使用包括10%胎牛血清,100 mg/L 青霉素和链霉素的RPMI-1640 完全培养基培养,置于37.5 ℃、含5% CO2的细胞培养箱。
1.3.2 外泌体分离 培养蜕膜巨噬细胞48 h 后,4 ℃, 1 2377 r/min 离心20 min,收集细胞培养液上清液至新试管。加入1/4 体积的ExoQuick Solution(购自美国System Biosciences 公司),混匀置于4 ℃孵育2 h, 接着1 500 g 离心30 min,去除上清液,继续离心5 min 去除残留液体,最后使用无核酸酶水重悬外泌体。
1.3.3 巨噬细胞外泌体鉴定 使用透射电镜拍照记录外泌体粒径长度与外形。采用western blot 验证CD63 蛋白表达量。
1.3.4 CCK8 检测细胞活性 滋养细胞HTR8-Svneo 使用RPMI 1640 添加10% FBS 和1%青霉素/链霉素培养。取对数生长期的滋养细胞,以1 000个/孔密度接种于96 孔板中培养。按100 mg/L 的外泌体浓度将PE 组与对照组收集的外泌体加入到滋养细胞培养基中。在共培养的第1,2,3,4 和5天,分别每孔加入10 μL CCK8 溶液置于培养箱静置2 h,放在酶标仪中测量OD450 的OD 值。每组实验设置3 复孔进行。
1.3.5 Transwell 检测滋养细胞迁移 取对数生长期的滋养细胞,以1×104个/100 μL 密度接种于6 孔板的上层小室,下层加入800 μL 含 PE 或对照组外泌体的RPMI 1640 完全培养基。上层加入无血清的培养基,培养48 h 后下层细胞使用1%结晶紫进行染色30 min 后用倒置显微镜进行观察计数。
1.3.6 qPCR 检测外泌体中miR-146a-5p 表达 外泌体RNA 提取使用外泌体 RNA 纯化试剂盒(BHS63743, 上海博湖生物科技有限公司)分别从两组细胞上清分离的外泌体中提取RNA 后qPCR 检测miR-146a-5p。用NanoDrop 2000 (美国赛默飞)评估提取RNA 的浓度和纯度。使用逆转录试剂盒将RNA 逆转录成cDNA,在ABI 7500qPCR 仪上进行qPCR 反应,反应条件为:95 ℃预变性5 min,95 ℃变性5 s,62 ℃复性20 s,72 ℃延伸30 s, 40 个循环。以U6 基 因 为 内 参,采 用2-ΔΔct法 计 算PE 组 相 对 于 正 常组中miR-146a-5p 的表达量。miR-146a-5p 上游引物 :5'- ACACTCCAGCTGGGTGAGAACTGAATTCCA-3', 下游引物:5'TGGTGTCGTGGAGTCG-3'; U6 上 游 引 物:5'CTCGCTTCGGCAGCACA-3',下 游 引 物:5'AACGCTTCACGAATTTGCGT-3'。
1.3.7 western blot 检测外泌体中CD63 与滋养细胞中HIF1α 表达 使用添加蛋白酶和磷酸酶抑制剂的RIPA 裂解液提取外泌体中总蛋白或外泌体处理后滋养细胞总蛋白,使用BCA 法测定蛋白样品浓度和纯度,接着进行上样、电泳及转PVDF 膜操作,分别加入稀释后的CD63,HIF1α、GAPDH 一抗置于4 ℃孵育过夜,第2 天TBST 洗涤PVDF 膜后加羊抗兔IgG 二抗,在37 ℃条件下孵育1 h,ECL 显色,暗室曝光、拍照并将图片进行灰度分析。
1.3.8 双荧光素酶报告基因检测 根据Genebank收录HIF1α 基因序列,利用引物分析软件Primer Premier 5.0 设计针对HIF1α-UTR 引物,以293T 细胞基因组DNA 为模板行PCR 扩增,扩增得到的产物连接到携带萤火虫荧光与海肾荧光的载体中,得到野生型HIF1α 载体(HIF1α-WT),根据预测结合位点,将结合位点突变为GCGGACA,构建得到突变荧光素酶载体(HIF1α-MUT),使用lipofectamineTM3000,将 上 述 质 粒 和miR-146a-5p mimic 或mimic control 共转染293T 细胞48 h,采用酶标仪分别检测萤火虫荧光值与海肾荧光值,并计算各组相对萤火虫荧光值。
1.4 统计学处理
2 结果
2.1 蜕膜巨噬细胞源性外泌体鉴定
透射电镜结果显示,巨噬细胞源性外泌体形态为直径30~130 nm 的中间凹陷的“饼状”结构,见图1。CD63 蛋白表达结果表达,巨噬细胞不表达外泌体标记蛋白CD63(0.02±0.00),而巨噬细胞源性外泌 体 中CD63 表 达 显 著 较 高(86.88±18.27,P<0.001),见图2。以上结果表明,分离的巨噬细胞源性外泌体符合外泌体的特征,可以用于后续实验。
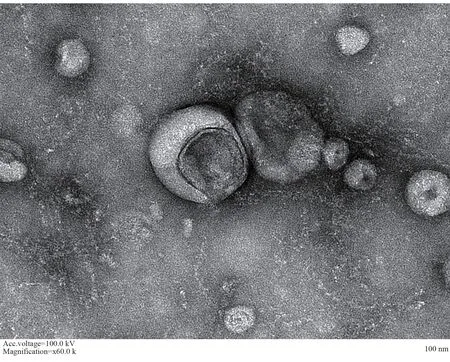
图1 电镜观察蜕膜巨噬细胞源性外泌体形态Fig 1 The morphology of exosomes of decidual macrophages observed by electron microscopy

图2 western blot 检测CD63 蛋白表达Fig 2 Detection of CD63 protein expression by Western blot
2.2 巨噬细胞源性外泌体抑制滋养细胞活力和迁移
CCK8 检测结果显示,与正常对照组相比,实验组显著抑制滋养细胞活力,在第五天时实验组(1.916±0.12)相对正常对照组(1.30±0.06)差异更显著(t=10.23,P<0.001),见图3A。迁移实验结果显示,实验组的滋养细胞迁移数(115.3±3.51)较对 照 组(212.3±5.03)显 著 下 降(t=27.37,P<0.001),见图3B。这提示PE 蜕膜巨噬细胞源性外泌体降低滋养细胞的活性和迁移能力。
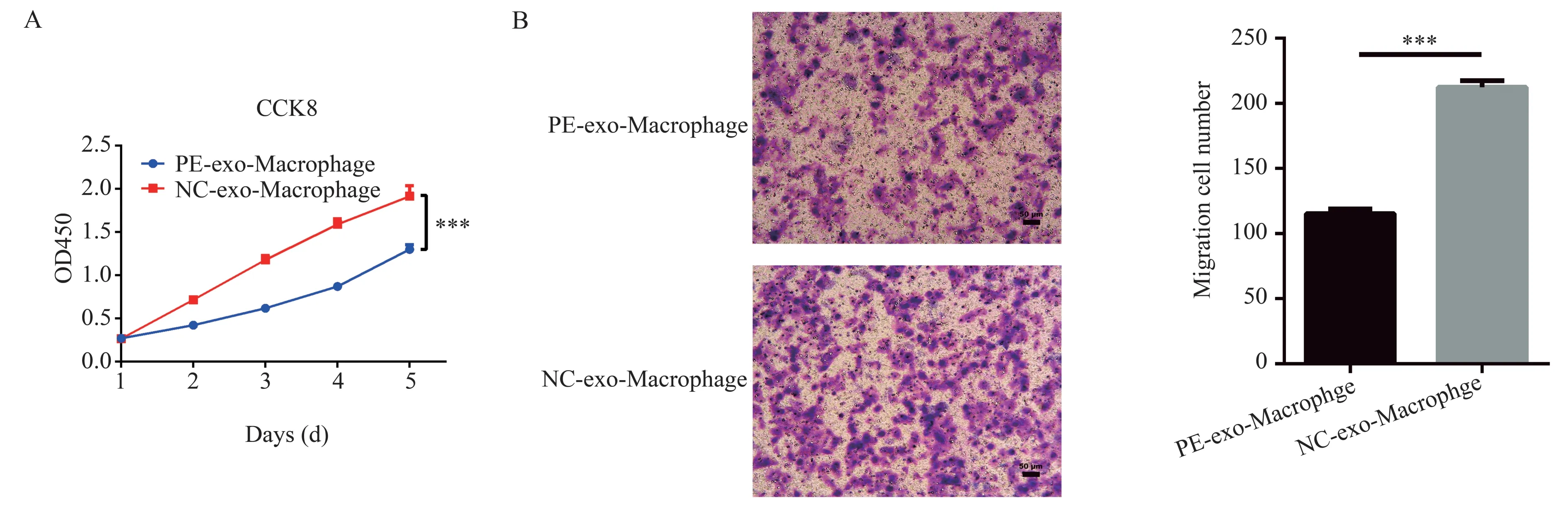
图3 蜕膜巨噬细胞源性外泌体抑制滋养细胞活力和迁移Fig 3 Exosomes from decidual macrophages suppressed the proliferation and migration of trophoblast cells
2.3 qPCR 检测外泌体中miR-146a-5p 表达
qPCR 结果显示,同对照组相比(3.45±0.20),实验组miR-146a-5p 的相对表达显著下降(1.00±0.09,t=19.48,P<0.001),见图4A。
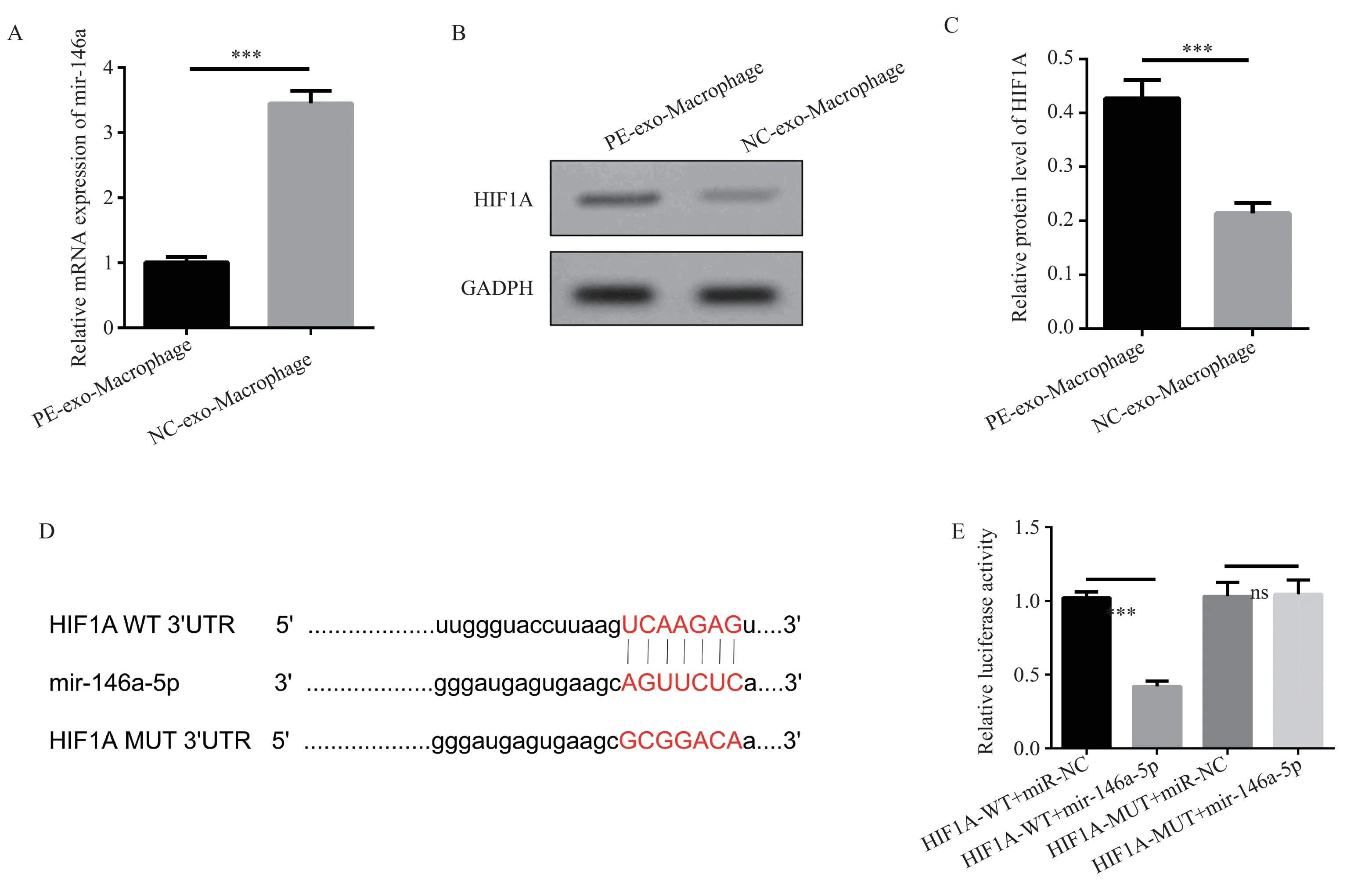
图4 miR-146a-5p 靶向调控HIF1αFig 4 miR-146a-5p binds directly to HIF1α
2.4 western blot 检测外泌体处理滋养细胞中HIF1α 蛋白表达
外泌体处理滋养细胞后检测HIF1α 蛋白表达结果表明,PE 蜕膜巨噬细胞源性外泌体处理滋养细胞后HIF1α 蛋白表达量显著增加(0.43±0.21vs.0.03±0.02,t=9.40,P<0.001),见图4B、4C。
2.5 miR-146a-5p 与HIF1α 结合位点的检测
通 过RNAhybrid 数 据 库(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid)预测发现miR-146a-5p和 HIF1α之间存在靶向结合位点(WT),根据结合位点设计突变型(MUT),见图4D。双荧光素酶报告基因结果表明,miR-146a-5p mimic 减少HIF1α-WT荧光素酶活性(0.42±0.03vs.1.02±0.04,t=19.69,P<0.001),而对HIF1α-MUT 荧光素酶活性无明显影响(1.05±0.10vs.1.03±0.09,t=0.17,P=0.88),见图4E。以上结果提示,miR-146a-5p 与HIF1α 存在靶向结合位点,负性调控HIF1的蛋白表达。
3 讨论
作为母胎界面母体来源的重要组成部分,孕妇蜕膜组织是联系胎儿滋养细胞的桥梁,是完成正常妊娠功能与平衡孕妇与胎儿免疫功能的关键[8]。巨噬细胞作为妊娠期重要免疫细胞,具有吞噬、抗原提呈、分泌细胞活性因子等功能,是维持妊娠与免疫稳定的关键免疫细胞之一[9]。滋养细胞增殖与迁移能力的异常可[10]。但蜕膜巨噬细胞是否对滋养细胞具有调控作用,以及其参与调控子痫前期的分子机制尚不清楚。
外泌体是一种直径为30~100 nm 的胞外囊泡,内含DNA、蛋白质、脂质、miRNA 等活性物质,在不同细胞和组织之间的信号传递和物质运输中起着重要作用[11]。分泌外泌体的细胞不同,会给外泌体带来不同的功能,可以影响细胞增殖、侵袭、分化和免疫等[12]。例如,M2 型巨噬细胞分泌的外泌体缓解肥胖小鼠中的炎症反应并改善对胰岛素的敏感性[13]。
存在于母胎界面的外泌体是母胎间信息交流的载体,在妊娠维持、PE 等正常和病理妊娠过程中都发挥重要的作用[14]。巨噬细胞通过外泌体调控胎盘释放抗炎细胞因子,抑制母体炎症和感染的反应,从而防止对胎儿的伤害[15]。本研究中,我们分离PE 和正常妊娠蜕膜巨噬细胞源性外泌体,将其和滋养细胞共培养,发现PE 组蜕膜巨噬细胞源性外泌体处理组相对对照组显著抑制滋养细胞的活力和迁移能力,表明PE 蜕膜巨噬细胞源性外泌体可能通过降低滋养细胞增殖与迁移能力,参与PE的发生、发展。
miRNA 可以调控滋养细胞的增殖、迁移和血管生成[16]。miR-146a 已被报道参与免疫调控、神经发生、肿瘤发生发展、血管形成等[17]。我们前期研究发现,miR-146a-5p 通过抑制TRAF6/NF-KB 信号传导来抑制滋养细胞释放促炎细胞因子[18]。本研究中,通过提取PE 与正常蜕膜组织巨噬细胞组外泌体,检测发现PE 组外泌体中miR-146a-5p 表达下调,并且这种变化与滋养细胞活力与迁移变化相关,因此认为miR-146a-5p 可能通过调节滋养细胞活力与迁移参与PE 的发生。缺氧诱导因子-1(Hypoxia inducible factor-1,HIF-1α)是在生理和病理条件下对低氧张力的细胞反应中起核心作用关键转录的因子[19]。在10 周前,胎盘在低氧环境中生长,HIF-1α 作为缺氧诱导因子在低氧下调控滋养细胞正常生长。[20]。研究证实,HIF-1α 能够激活PE 病理学因子sFlt-1 基因的转录,导致 sF1t-1 表达上调,进而 促 进PE 进 展[21]。而miR-146a-5p 被 证 实 可 靶 向HIF-1a 减少糖尿病患者的视网膜病变[22]。本研究中,我们发现PE 蜕膜巨噬细胞源性外泌体中miR-146a-5p 表达量显著减少,与滋养细胞共培养后滋养细胞中HIF1α 蛋白表达显著增加,提示miR-146a-5p 与HIF1α 可能存在靶向调控关系。通过双荧光素酶报告基因进一步证实miR-146a-5p 和HIF1α 之间存在靶向结合位点。这提示miR-146a-5p 调节滋养细胞活性可能与靶向调控HIF1a 蛋白的表达有关。
然而本课题还存在一些不足之处,还需要扩大样本进行多中心研究以确认临床中miR-146a-5p/HIF1α 调控轴的作用与临床意义,以及同时处理的体内外实验验证是否PE 蜕膜巨噬细胞源性外泌体通过miR-146a-5p/HIF1α 抑制滋养细胞的生物学行为。
综上所述,本研究提示蜕膜巨噬细胞分泌外泌体可能是导致PE 的发生及进展的重要原因之一,而外泌体中miR-146a-5p 低表达与其高度相关,可能通过靶向促进HIF1α 的表达抑制滋养细胞活力与迁移,从而介导PE 的发生,为PE 的机制研究和靶向诊治提供了新的思路,但具体作用及机制需要进一步深入研究。
作者贡献度说明:
陈芳荣:经费支持与实验进行;毛东瑞:数据分析与统计;陈小菊:课题设计与实验指导。
所有作者声明不存在利益冲突关系。
