高良姜的化学成分及抗肿瘤活性研究
2023-03-18欧虹雅屈慧娟周小妹张海莹靳德军
欧虹雅,屈慧娟,周小妹,张 迎,张海莹,靳德军,魏 娜
(海南医学院药学院,海南 海口 571199)
中药高良姜是姜科植物高良姜(Alpinia officinarumhance)的干燥根茎,味辛性热,具有散寒止呕、温胃止痛的功效,临床上广泛用于脘腹冷痛、胃寒呕吐、嗳气吞酸等症[1]。目前主要产地在广东、海南等地,其中道地性产地为广东徐闻县[2]。高良姜的化学成分有黄酮类、二芳基庚烷类、苯丙素类、糖苷类和挥发油等多种成分,其中黄酮类和二芳基庚烷类是高良姜主要活性成分[3-7]。现代药理研究表明高良姜具有抗炎、抗肿瘤、镇痛、抗菌等药理作用,黄酮类成分在抗炎、抗菌、抗氧化方面具有良好的活性,而二芳基庚烷类成分在镇痛、抗肿瘤等方面具有良好的活性[8-13]。
课题组前期进行了高良姜有效部位和有效组分的分离,得到了黄酮组分和二芳基庚烷组分,并进行了黄酮组分和二芳基庚烷组分的药效学研究,明确了高良姜黄酮组分和二芳基庚烷组分具有抗胃黏膜损伤的作用[14,15]。本文研究高良姜中黄酮组分和二芳基庚烷组分的化学成分及其单体化合物的活性,为高良姜有效利用与进一步开发奠定基础。
1 材料与方法
1.1 材料
高良姜药材购自广东徐闻,经海南医学院生药学教研室田建平教授鉴定为姜科山姜属植物高良姜(Alpinia officinarum hance)的干燥根茎。凭证标本(No.AOH-20140228)存放于海南医学院天然药物化学实验室。
1.2 方法
1.2.1 提取分离
取高良姜总庚烷组分用制备薄层法分离(图1),将其以二氯甲烷溶解,以环己烷:二氯甲烷:甲醇(6∶2.5∶1.5)为展开剂,展开后刮下荧光色带,合并Rf 值相同色带,共得5 个组分Fr.1~Fr.5。接着用半制备HPLC 纯化Fr.1~Fr.5,以75%甲醇洗脱,得到化合物1~6。
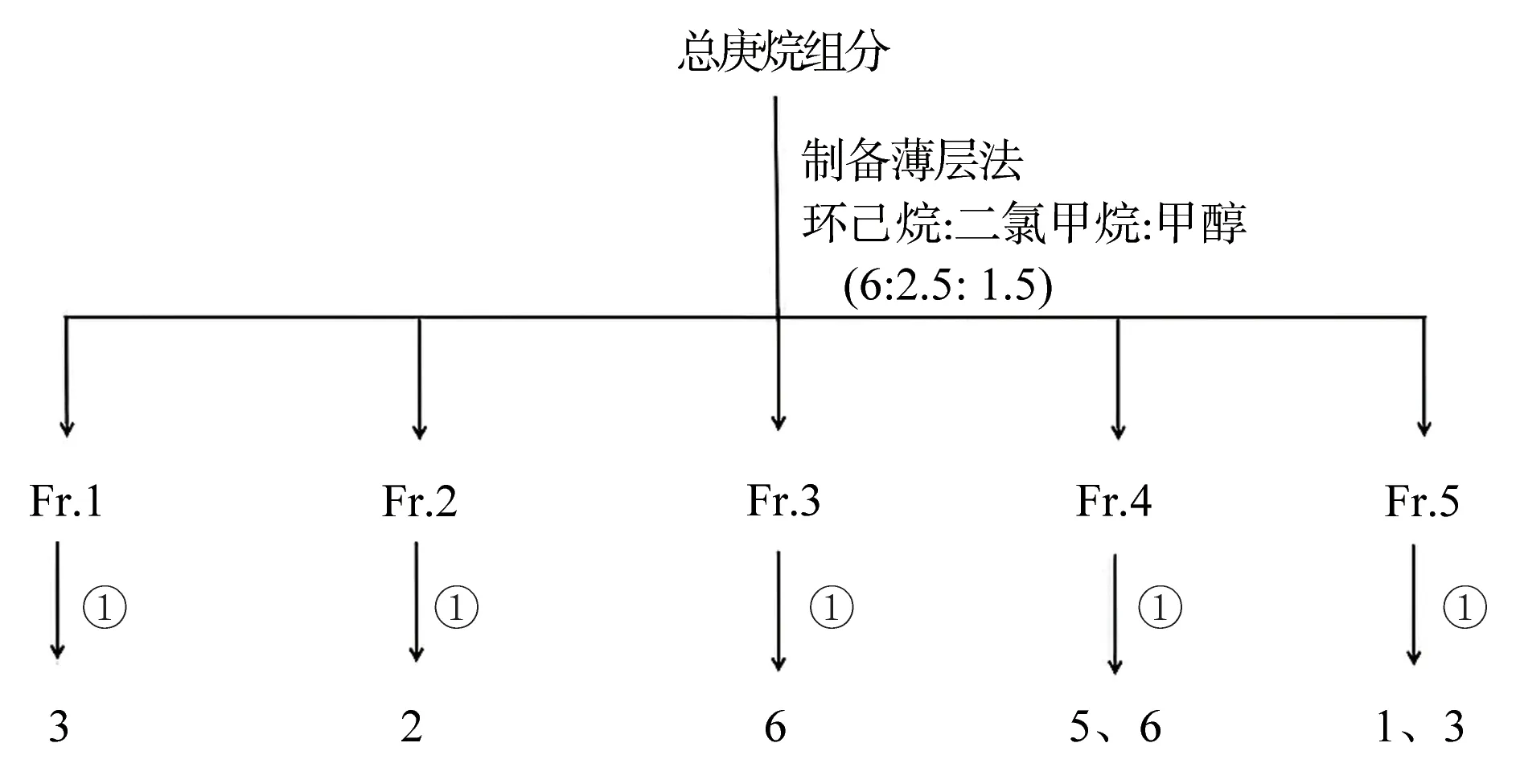
图1 总庚烷分离纯化流程图Fig 1 Flow chart of separation and purification of total heptane
取高良姜总黄酮组分用硅胶柱色谱分离(图2),用石油醚-乙酸乙酯(30∶1~5∶1)梯度洗脱,共得到3个粗分组分Fr.1~Fr.3,Fr.1 利用硅胶柱色谱分离,以石油醚-二氯甲烷(1∶2)起梯度洗脱,得到Fr.1.1后用半制备HPLC 纯化得到化合物7,Fr.2 利用硅胶柱色谱进行分离以石油醚-二氯甲烷(1∶2)起梯度洗脱,后用甲醇洗脱,得到化合物8,Fr.3 利用硅胶柱色谱分离,以石油醚-二氯甲烷(1∶1、1∶10、1∶40、0∶1)洗脱,再用半制备HPLC 纯化得到化合物9。
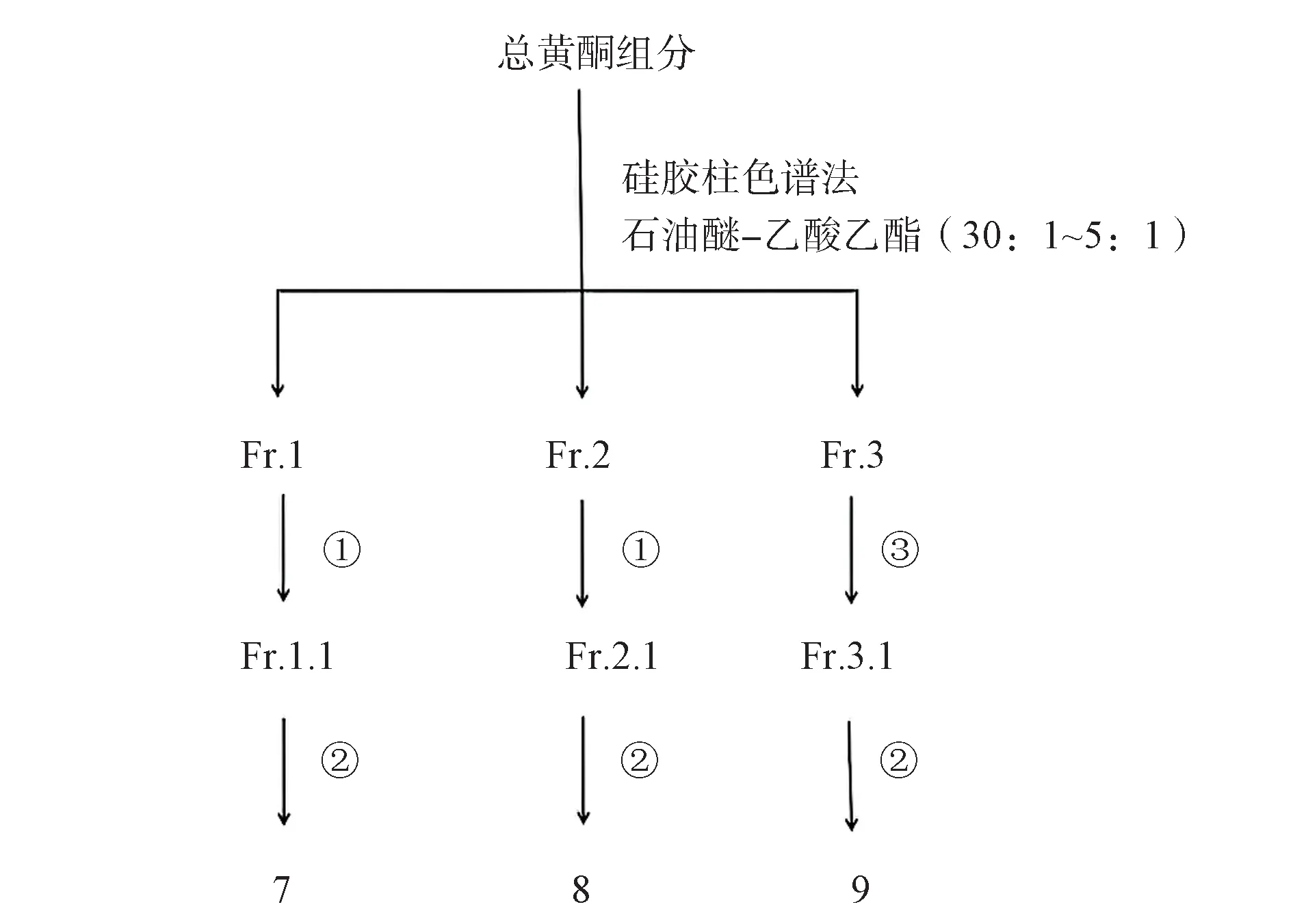
图2 总黄酮分离纯化流程图Fig 2 Flow chart of separation and purification of total flavonoids
1.2.2 细胞毒活性筛选
1.2.2.1 药物配制 将所分离纯化得到的单体化合物用DMSO 溶解,然后加入培养基稀释至浓度为100、50、25、12.5、6.25、3.12、1.56 μmol/L,阳性药为姜黄素通过培养基稀释至25 μmol/L。
1.2.2.2 细胞毒活性测试 取生长状态良好的MDA-MB-231(乳腺癌)、HepG-2(肝癌)、MKN-45(胃癌)细胞,胰酶消化后,接种于96 孔板中,密度为5 000 个/孔,培养24 h。弃去培养基,实验组加入不同浓度的药物,阳性对照组加姜黄素25 μmol/L,同时设空白组和对照组,每组6 个复孔,继续培养24 h。弃去旧培养基,加入10% 的CCK-8,孵育30 min,酶联免疫检测仪450 nm 处测量各个孔的吸光度,每组实验重复3 次。抑制率%=1-(A 给药-A 空白)/(A 对照-A 空白),根据A 值计算半数抑制浓度(median inhibitory concentration, IC50)。
2 结果与分析
2.1 结构鉴定
根据理化性质和核磁进行结构鉴定,从高良姜总庚烷组分中分离得到6 个二芳基庚烷(化合物1~6),从总黄酮中分离得到3 个黄酮(化合物7~9),其结构如图3 所示。
化合物1(图3 中1):淡黄色油状物,共分离得到124.2 mg。1H-NMR(CDCl3,400 MHz),δH:7.16~7.30(5H, m, H-2’至6’芳环上未取代H),6.66~6.83(3H, m, H-2’’, 5’’, 6’’),5.66(1H,s, 4’’-OH ),4.02~4.08(1H, m, H-5),3.86(3H,s, 3’’-OCH3),2.54~2.91(8H, m, H-1, 2, 4, 7),1.63~1.82(2H, m, H-6);13C-NMR(CDCl3,100 MHz),δc:211.35(C-3),146.57(C-3’’),143.84(C-4’’),140.77(C-1’’),133.82(C-1’’),128.68(C-3’, C-5’),128.39(C-2’, C-6’),126.35(C-4’),121.02(C-6’’),114.44(C-5’’),111.23(C-2’’),66.99(C-5’),55.98(3’’-OCH3),49.38(C-4),45.12(C-2),38.46(C-6),31.52(C-1),29.58(C-7)。以上数据与文献报道的基本一致[16],故鉴定化合物1 为5-hydroxy-7-(4-hydroxy-3-methoxyphenyl)-1-phen -ylheptan-3-one(DPHA)。
化合物2(图3 中2):淡黄色油状物,共分离得到289.4 mg。1H-NMR(CDCl3,400 MHz),δH:7.17~7.25(5H, m, H-2’至6’芳环上未取代H),6.87(1H, dt,J=16.0,6.8 Hz, H-5),6.75(1H, d,J=1.92 Hz, H-2’’),6.65(1H, d,J=7.9 Hz,H-5’’),6.56(1H, dd,J=1.9, 7.96 Hz, H-6’’),6.10(1H, d,J=16.0 Hz, H-4),3.71(1H, s,-OCH3),2.78~2.85(4H, m, H-1, 2),2.60~2.63(2H, m, H-7),2.48~2.49(2H, m, H-6);13C-NMR(CDCl3,100 MHz)δc:30.01(C-1),33.79(C-7),34.43(C-6),41.25(C-2),56.07(-OCH3),113.10(C-2’’),115.85(C-5’’),120.94(C-6’’),126.40(C-4’),128.82(C-2’, C-6’),128.85(C-3’, C-5’),130.83(C-4),132.20(C-1’’),141.78(C-1’,C-4’’),145.25(C-4’’),147.60(C-5),147.96(C-3’’),199.53(C-3)。以上数据与文献报道基本一致[17],故鉴定化合物2 为(E)-7-(4-hydroxy-3-methoxyphenyl)-1-phenylhept-4-en-3-one(DPHB)。
化合物3(图3 中3),白色粉末,共分离得到226.4 mg。1H-NMR(CDCl3,400 MHz),δH:7.13~7.31(10H, m, 苯环H),4.03~4.09(1H, m, H-5),2.74~2.93(8H, m,H-1, 2, 4, 7),1.65~1.85(2H,m, H-6);13C-NMR(CDCl3,100 MHz)δc:211.29(C-3), 141.92(C-1’),140.78(C-1’’),128.69(C-3’, 5’),128.59(C-3’’, 5’’), 128.55(C-2’’,6’’), 128.40(C-2’, 6’),126.36(C-4’),126.01(C-4’’),66.97(C-5),49.39(C-4),45.13(C-2),38.14(C-6),31.85(C-1),29.60(C-7)。以上数据与文献报道基本一致[18],故鉴定化合物3(图1 中3)为5-hydroxy-1,7-diphenylheptan-3-one(DPHC)。
化合物4(图3 中4):棕黄色油状物,共分离得到22.1 mg。1H-NMR(CDCl3,400 MHz),δH:7.09~7.22(5H, m, 苯环H-2’至6’),6.93(2H, d,J=7.6 Hz, H-2’’, 6’’),6.65(2H, d,J=7.6 Hz, H-3’’,5’’),3.60(1H, m, H-5),3.22(1H, s, -OCH3),2.46~2.80(8H, m, H-1, 2, 4, 7),1.62~1.72(2H,m, H-6);13C-NMR(CDCl3,100 MHz)δc:211.07(C-3),156.46(C-4’’),142.50(C-1’),133.93(C-1’’),116.14(C-3’’, 5’’),130.27(C-2’’,6’’),129.43(C-3’, 5’),129.41(C-2’, 6’),127.02(C-4’),77.92(C-5),48.10(C-4),45.97(C-2),37.02(C-6),31.38(C-7),30.53(C-1),57.06(-OCH3)。以上数据与文献报道基本一致[19],故鉴定化合物4 为7-(4-hydroxyphenyl)-5-methoxy-1-pheny-lheptan-3-one。
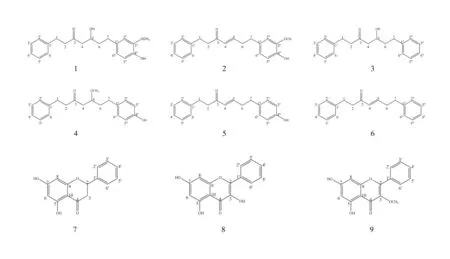
图3 化合物1~9 化学结构Fig 3 Chemical structures of compounds 1~9
化合物5(图3 中5):深黄色油状物,共分离得 到205.3 mg。1H-NMR(CDCl3,400 MHz),δH:7.19~7.32(苯环H-2’至6’),7.02(2H, d,J=8.8 Hz, H-2’’, 6’’),6.90(1H, m, H-5),6.82(2H,m, H-3’’, 5’’),2.86~2.97(4H, m, H-1, 2),2.67~2.71(2H, m, H-7),2.46~2.52(2H, m,H-6);13C-NMR(CDCl3,100 MHz)δc:200.99(C-3),154.63(C-4’’),141.15(C-1’),132.40(C-1’’),115.62(C-3’’, 5’’),129.53 (C-2’’,6’’),128.66(C-3’, 5’),128.52(C-2’, 6’),126.30(C-4’),147.89(C-5),130.65(C-4),41.74(C-2),34.65(C-6),33.59(C-7),30.31(C-1)。以上数据与文献报道基本一致[20],故鉴定化合物5为(E)-7-(4-hydroxyphenyl)-1-phenylhept-4-en-3-one。
化合物6(图3 中6):黄色油状物,共分离得到 9.4 mg。1H-NMR(CDCl3,400 MHz),δH:7.16~7.30(10H, m, 苯 环H),6.84(1H, dt,J=6.8, 15.92 Hz, H-5’’),6.11(1H, d,J=16.0 Hz, H-4),2.84~2.93(4H, m, H-1, 2),2.75~2.78(2H, m, H-7),2.52~2.56(2H, m, H-6);13C-NMR(CDCl3,100 MHz)δc:199.63(C-3),146.46(C-5),141.32(C-1’),140.76(C-1’’),130.79(C-4),128.61(C-3’, 5’),128.57(C-2’,6’),128.45(C-3’’, 5’’),128.42(C-2’’, 6’’),126.32(C-4’),126.18(C-4’’),41.79(C-2),34.48(C-7),34.23(C-6),30.17(C-1)。以上数据与文献 报 道 基 本 一 致[21],故 鉴 定 化 合 物6 为(E)-1,7-diphenylhept-4-en-3-one。
化合物7(图3 中7):无色针状结晶,共分离得 到200 mg。1H-NMR(DMSO-d6,400 MHz),δH:7.31~7.47(5H, m, H-2’- 6’),12.09(1H, s,5-OH),10.86(1H, s, 7-OH),5.58(1H, s, H-6),5.88(1H, s, H-8),5.51~5.54(1H, dd,J=17.3,3.28 Hz, H-3);13C-NMR(DMSO-d6, 100 MHz)δc:78.91(C-2),42.63(C-3),196.46(C-4),163.25(C-5),96.50(C-6),166.40(C-7),95.61(C-8),164.04(C-9),102.28(C-10),139.23(C-1’),127.15(C-2’, 6’),129.08(C-3’, 4’, 5’)。以上数据与文献报道基本一致[22],故鉴定化合物7 为pinocembrin。
化合物8(图3 中8):黄色针状结晶,共分离得 到278 mg。1H-NMR(DMSO-d6,400 MHz),δH:7.42~7.52(3H, m, H-3’, 4’, 5’),8.10(2H,d,J=7.7 Hz, H-2’, 6’),9.65(1H, s, 3-OH),12.32(1H, s, 5-OH),10.83(1H, s, 7-OH),6.16(1H, s, H-6),6.42(1H, s, H-8);13C-NMR(DMSO-d6, 100 MHz)δc:146.25(C-2),137.66(C-3),176.83(C-4),161.30(C-5),98.86(C-6),164.77(C-7),94.12(C-8),156.95(C-9),103.76(C-10),131.49(C-1’),129.07(C-2’,6’),128.09(C-3’,5’),130.49(C-4’)。以上数据与文献报道基本一致[23],故鉴定化合物8 为 galangin。
化合物9(图3 中9):黄色粉末,共分离得到5.6 mg。1H-NMR(DMSO-d6,400 MHz),δH:7.53(3H, m, H-3’, 4’, 5’),7.96(2H, m, H-2’,6’),12.52(1H, s, 5-OH),10.88(1H, s, 7-OH),6.18(1H, s, H-6),6.41(1H, s, H-8),3.75(3H,s, 3-OCH3);13C-NMR(DMSO-d6, 100 MHz)δc:60.56(3-OCH3),155.75(C-2),139.32(C-3),178.68(C-4),161.83(C-5),99.26(C-6),164.94(C-7),94.38(C-8),157.14(C-9),105.01(C-10),130.59(C-1’),128.72(C-2’, 6’),129.28(C-3’,5’),131.59(C-4’)。以上数据与文献报道基本一致[24],故鉴定化合物9 为 3-O- methylgalangin。
2.2 体外抗肿瘤活性
从表1 可以看出,化合物2、化合物 3、化合物5 、化 合 物6 和 化 合 物 7 对MDA-MB-231 细 胞 具有微弱的细胞毒活性,化合物2、化合物 5 、化合物7 和化合物8 对HepG-2 细胞具有微弱的细胞毒活性,化合物2 和化合物 6 对MKN-45 细胞具有微弱的细胞毒活性。
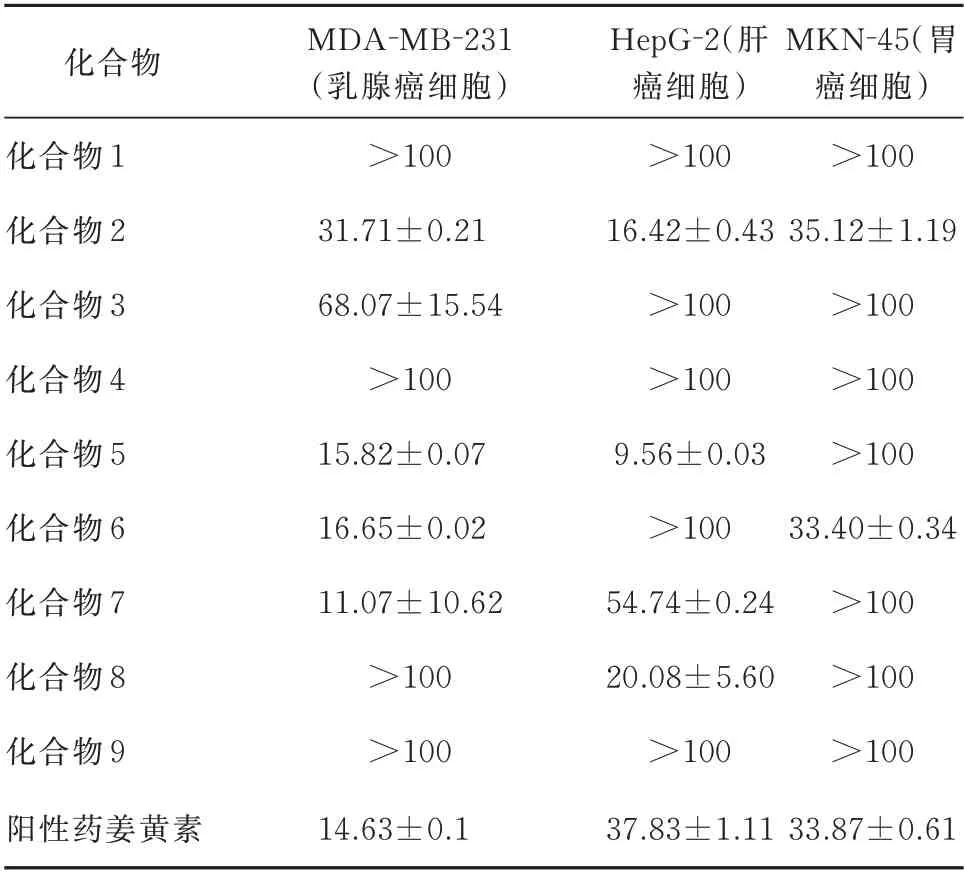
表1 化合物1~9 的细胞毒活性IC50(μmol/L)Tab 1 Cytotoxicity IC50(μmol/L) of compounds 1~9(μmol/L)
3 讨论
高良姜有抗炎、抗氧化、抗肿瘤的作用,现代临床常用于胃炎、胃溃疡、胃癌等疾病的治疗,具有良好的开发和应用前景[25,26]。本实验通过色谱方法结合波谱法,从高良姜二芳基庚烷组分和黄酮组分分离得到了9 个化合物,通过CCK-8 法考察了所有化合物对肿瘤细胞的体外抑制活性,本研究结果显示高良姜具有潜在的抗肿瘤活性。
在高良姜黄酮类化合物中高良姜素(化合物8)对HepG-2(肝癌细胞)具有细胞毒活性,IC50值为(20.08±5.60) μmol/L,同时相关研究表明高良姜素(化合物8)可通过上调肝癌细胞(HepG-2)中的p53 表达,引起细胞凋亡的原因可能是自噬而与凋亡无关[27,28]。相关研究还显示高良姜素在体内外可抑制胃癌(MGC-803)细胞的生长,其作用机制可能是 通 过 抑 制NF-κB 通 路 和 增 强 自 噬 而 实 现 的[29]。但本研究中高良姜素对胃癌细胞(MKN-45)没有表现出明显的细胞毒活性,可能原因是胃癌细胞株不同。
高良姜中的二芳基庚烷类化合物对肝癌、乳腺癌、胃癌细胞具有细胞毒性[22,30],本研究结果显示(E)-1,7-diphenylhept-4-en-3-one(化合物6)对乳腺癌细胞(MDA-MB-231)和胃癌细胞(MKN-45)具有细 胞 毒 活 性,IC50 值 分 别 为(16.65±0.02)、(33.40±0.34) μmol/L,相 关 研 究[22]显 示(E)-1,7-diphenylhept-4-en-3-one(化合物6)对乳腺癌细胞(MCF-7)和胃癌细胞(SGC-7901)的细胞毒活性强,IC50值分别为26.13,23.36 μM,与本文研究结果相似。
总的来说,二芳基庚烷类化合物比黄酮类化合物的细胞毒活性强,黄酮类化合物中增强细胞毒活性的重要基团是C-3 位的羟基,二芳基庚烷类化合物中C-3 位的羰基和C-4 位的双键是影响细胞毒活性的重要基团。
综上,根据本文研究显示高良姜在抗肿瘤方面具有潜在的应用前景,但本文未对每种肿瘤细胞进行多种细胞系进行研究,这是本文的不足之处以及下一步需要进行的工作,下一步需要进行的工作还包括对活性单体化合物6、化合物8 的抗肿瘤机制研究。
作者贡献度说明:
欧虹雅承担本文细胞活性及文章撰写工作;屈慧娟、周小妹、张迎承担本文化合物分离工作;张海莹负责本文体外细胞实验指导;靳德军负责本文化学成分实验指导;魏娜负责本文实验指导及本文写作指导等工作。所有作者对稿件的编辑做出了贡献,并就最终内容达成了一致。
所有作者声明不存在利益冲突。
