模拟放牧采食对典型草原土壤中AM真菌分解枯落物的影响
2023-03-05赵心雨田丽华赵学春桂维阳
赵心雨, 田丽华, 赵学春, 陈 超, 桂维阳
(贵州大学动物科学学院, 贵州 贵阳 550025)
枯落物是天然草原碳库的主要组成部分之一,是草地生态系统物质和能量的重要来源[1-2]。枯落物经矿化作用分解后或被植物吸收利用,或以CO2的形式返回至大气中,在维持草地生态系统碳平衡中起到关键作用[2-3]。
草地生态系统中的大部分碳库位于土壤中[4]。典型草原中80%的植物可以和丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)形成共生体,其中AMF菌丝是地下碳库的重要载体之一[5]。大多数研究认为AMF并不具有腐生能力,因此AMF参与枯落物分解的过程主要通过影响其与土壤微生物之间的互作关系,改变土壤微生物对酶的分泌,调控枯落物的分解率[6]。有研究发现,AMF会通过分泌易分解有机质刺激土壤微生物活性,加快枯落物的分解[7]。Cheng等研究发现,土壤中的AMF被隔离后,枯落物的分解减少,土壤微生物的活性下降[8]。此外,AMF还会与土壤微生物竞争养分,进而刺激或抑制微生物的活性。Jannoura等发现,由于土壤中氮素的缺乏,豆科植物接种AMF后,微生物活性受抑制,导致枯落物—玉米(Zeamays)的分解率降低[9]。
水解酶和氧化酶是土壤微生物降解复杂有机化合物的重要物质,可以反映土壤生化过程的大小和趋势[10]。纤维素是植物残体进入土壤的碳水化合物的重要组分之一,是一种含碳量较高的化合物,结构相对简单,分解较快[11]。纤维素二糖水解酶在参与纤维素的分解过程中可将纤维素分解为纤维二糖[12]。β-葡糖苷酶的主要作用是参与分解纤维素类多糖的水解过程,裂解β-葡糖苷和多聚糖形成葡萄糖,其作用产物是土壤微生物重要的营养源[13]。氧化酶中起主要作用的为多酚氧化酶,其可以促进腐殖质的形成,分解枯落物中的木质素,进一步将酚类物质氧化为醌[14]。有研究发现,AMF的生长会促进土壤酶的活性,例如β-葡糖苷酶、磷酸酶和脲酶等[15]。然而,较少有研究系统调查AMF是否通过调控土壤酶活性影响枯落物的分解。
植物功能群会影响土壤微生物的群落结构和功能[16]。不同植物功能群的地上净初级生产力并不一致,这会改变植物对土壤微生物群落的碳分配,从而使微生物的活性受到干扰[17]。植物群落结构的改变会影响土壤的固碳能力,还会影响土壤微生物碳源(根系分泌物)的多样性,植物与土壤微生物之间的相互关系以及土壤微环境的多样性等[18-19]。并且,很多研究均指出不同植物功能群对AMF的依赖性表现差异较大,其中C4禾草相比于C3禾草及固氮杂草对AMF的依赖性更大,更易于形成共生体[20]。但植物功能群对AMF参与枯落物分解的影响却鲜有报道。
植物的光合作用可以为地下部分输送大量碳源[21]。因此,宿主植物光合作用的削弱,例如植物地上部分的刈割,会限制宿主植物为其共生的AMF的碳分配[22]。因此,刈割会通过调控宿主植物共生的AMF来影响土壤微生物群落,进而降低枯落物的分解率[23]。放牧是草地生态系统的主要土地利用方式之一,会对植物功能性其家畜采食作用中采食量的部分可以通过刈割处理代表,用于探究刈割对土壤微生物的影响,有助于我们预测草地生态系统中由放牧导致的土壤碳流转的变化。放牧过程中家畜采食过程会改变地上植被的丰富度和多样性,影响根际微生态环境[24-25]。
前人对AMF参与枯落物的分解主要在温室和盆栽试验中进行,AMF和土壤微生物之间的互作受控制试验的条件限制,难以展现其在野外原位环境中的真实性[26]。本试验采用网袋法,使用两种不同孔径的尼龙网(隔离植物根系但允许AMF菌丝通过、同时隔离植物根系和AMF菌丝),并通过测量枯落物的分解率、土壤酶活性,以阐明在典型草原中,放牧的采食作用(植物功能群和刈割处理)对AMF参与枯落物分解过程的影响。
本研究提出3个假设:(1)不同植物功能群处理中枯落物的分解率有差异;(2)AMF会通过影响土壤酶活性改变枯落物的分解;(3)刈割会抑制枯落物分解。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古多伦县中科院植物所十三里滩恢复草地生态系统试验示范基地(42°02′N ~ 116°17′E、海拔1 324 m)。气候为温带内陆型季风气候,年降水量为385.5 mm,年均温为2.1℃。研究区土壤为栗钙土,肥力低,结构疏松。植被类型为温带典型草原,主要植被:大针茅(Stipakryroii)、羊草(Leymuschinensis)、糙隐子草(Cleistogenessquarrosa)、冷蒿(Artemisiafrigida)等。
1.2 试验设计
本研究采用随机区组试验设计,选取研究区地势开阔、平坦且植被均匀的位置设立试验。选择植物功能群和刈割两种利用方式模拟放牧中的采食作用(采食种类和采食量),其中植物功能群处理:C3禾草、C4禾草、杂类草和对照(CK),共4水平。刈割处理:刈割和不刈割,共两水平,五个区组,共40个小区。小区面积:1.5 m × 1.5 m样方,间隔:2 m。
每种植物功能群处理仅保留本功能群植物,其余植物地上部分全部使用剪刀剪去,使地下部分凋萎死亡但不破坏土壤结构。试验于2015年5月1日开始,每隔两周剔除一次,10月1日结束。刈割为每月一次(5—10月),留茬5 cm,属于中度放牧强度。
1.3 测定项目及方法
1.3.1枯落物分解袋 2014年10月中旬,在研究区内用剪刀齐地面采集当地优势物种羊草。挑选植株长度在15~20 cm,4~5片叶子的羊草立枯体,以保证材料质量的均匀度,切碎成1 cm左右的小段备用。
枯落物分解袋使用两种规格尼龙网制成,分别为0.45 μm(完全隔离AMF菌丝和植物根系)和25 μm(仅隔离植物根系允许AMF菌丝通过)。分解袋长10 cm、直径 6.5 cm(见图1),袋内装原位土150 g和羊草立枯物2 g,每种孔径各小区均有3个重复,混合均匀后回填,填埋时间为每年5月1号,每年10月1号取样。
枯落物分解袋取出后,将袋内的剩余枯落物小心取出,经清洗后烘干称重。袋内的土壤用于测定土壤酶活和AMF菌丝密度。
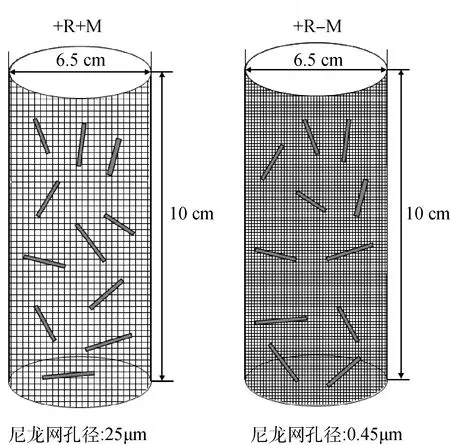
图1 凋落物分解袋示意图Fig.1 Litter decomposition bag
1.3.2AMF菌丝密度测定方法 AMF菌丝密度的测定使用真空泵微孔抽滤法[27]。取5.000 g风干土壤于1 L烧杯中,加入1 L去离子水和搅拌子,置于磁力搅拌器上搅拌5 min以使菌丝充分脱落,从而形成土壤悬浊液;将此悬浊液静置至无明显漩涡后过双层筛,上筛为20目,下筛为400目,过滤土壤悬浊液;再向烧杯中加水1 L后重复过滤一次,保证烧杯中所有土壤全部转移至筛中;上筛中的杂质丢弃,下筛中的土用约100 mL水冲洗至搅拌机中,搅拌10 s,停止5 s,再搅拌20 s;搅拌后的悬浊液全部转移至250 mL三角瓶中,用去离子水定容至250 mL,置于220 r·min-1摇床中剧烈摇晃后,静置1 min;使用移液器在同一液面下1 cm处吸取5 mL悬浊液,转移至放有0.45 μm滤膜的抽滤装置的过滤杯中,进行真空抽滤;抽滤后将滤膜转移至载玻片,滴数滴0.05%曲利苯蓝溶液染色,盖上盖玻片后静置20 h;重复“剧烈摇晃”和“抽滤”4次,即每个土壤样品制4片滤膜。使用“100 ×”倍数下用显微镜(CX41,Olympus,Japan)观察并计数。使用网格交叉法估算菌丝长度,随机观察圆形滤膜上25个视野,每个视野的交叉点数为一根菌丝与十字交叉格横竖方向上的全部点数。
菌丝密度计算公式:
菌丝长度(m)=11/14×总交叉点数×网格单元格长度×滤膜上样块面积/网格面积
菌丝密度(m·g-1)=菌丝长度/所称土的质量
1.3.3土壤酶活性测定方法 试剂配制:
(a)醋酸钠缓冲液:配制50 mmol·L-1的醋酸盐溶液(将6.804 g三水合乙酸钠溶解在800 mL去离子水中),再使用12 mol·L-1的盐酸将缓冲液调节pH至5.0后保存在4 ℃冰箱,需在8天内使用完毕。
(b)甲基伞型酮(MUB)及酶底物(表1):配制200 μmol·L-1的底物和10 μmol·L-1MUB,提前一天配制,放置在4oC冰箱保存,3天内使用完毕。
测量方法:
(1)称取1.00 g鲜土于250 mL锥形瓶中,加入125 mL的醋酸钠缓冲液,使用磁力搅拌器(搅拌子长度为3.5 cm)使土壤成均一悬浊液,后置于往复式摇床中震荡1 h(200 r·min-1);
(2)用八通道移液器吸取200 μL醋酸钠缓冲液于黑色96微孔板上,分别是空白对照,标准荧光,底物对照,依次加入50 μL缓冲液、10 μmol·L-1-MUB和200 μmol·L的底物;
(3)用八通道移液器吸取200 μL土壤悬浊液于黑色96微孔板上,每一个土壤样品设置8个重复,并设置样品对照和标准对照;吸取50 μL的200 μmol·L-1的底物,加到96孔板对应的样品池里,样品对照加50 μL缓冲液,标准对照加50 μL 10 μmol·L-1的MUB。
(4)点样结束后,立即20oC暗光培养2 h,培养结束后添加10 μL 1 mol·L-1的氢氧化钠溶液终止反应;
(5)使用多功能酶标仪(SpectraMax i3x,Molecular Devices,CA,USA)在365 nm激发光,450 nm透射光下测定荧光值(DeForest,2009),土壤酶活性计算过程如下:
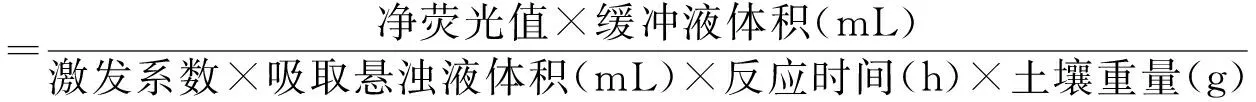


表1 土壤酶种类及其缩写和酶作用底物Table 1 Enzymes measured in soil samples,and their substrates and abbreviation
1.4 数据统计与分析
采用SAS 8.0(SAS Institute,USA)对各指标进行三因素方差分析(Three-way ANOVA)。结果显示刈割对各指标的影响均不显著,故将刈割处理合并为重复(附表1),再使用双因素方差分析(Two-way ANOVA)进行检验,多重比较方法使用Duncan检验。使用一元线性回归分析(Linear regression)AMF菌丝密度与枯落物分解率的相关性。
2 结果与分析
2.1 枯落物分解率和AMF菌丝密度
两年间,植物功能对枯落物分解率有显著影响,且变化趋势相似(图2,2016:P<0.001;2017:P<0.001)。杂类草和CK显著高于C3禾草处理,C4禾草处理最低。两年中,AMF均促进了枯落物的分解(图2a,2b,P<0.001)。
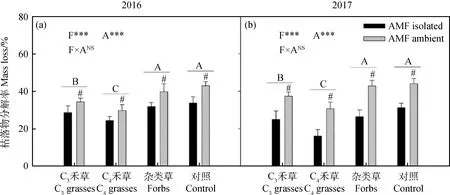
图2 2016年(a)和2017年(b)植物功能群处理(F)和AMF处理(A)对枯落物分解率的影响Fig.2 The effect of AMF Treatment (A) on mass loss of different plant functional groups (F) in 2016 (a) and 2017 (b)注:不同字母表示植物功能处理中差异显著。#表示在植物功能群处理内差异显著。*=P<0.05;**=P<0.01;***=P<0.001;NS=P>0.05Note:Different letters indicate significant differences among the plant functional groups. #that a significant difference between the treatments of AMF isolated or not within one plant functional group. *P<0.05;**P<0.01;***P<0.001;NSP>0.05. The same as below
两年间,植物功能群对AMF菌丝密度有显著影响,但趋势并不一致(图3,2016:P<0.01;2017:P<0.01)。2016年,杂类草和CK较高,C3和C4禾草处理较低;2017年,杂类草显著高于C3和C4禾草处理。2017年,AMF菌丝密度在各功能群中均呈显著差异,说明尼龙网在所有处理中都显著阻隔了AMF菌丝的生长(图3,P<0.05)。
2.2 土壤酶活性
两年间,β-葡糖苷酶在不同植物功能群中呈显著差异(图4a,4d:P<0.001)。2016年,杂类草和CK处理较高,C3和C4禾草处理较低;2017年,C4禾草显著低于其余三种处理。2016年,AMF仅对C3禾草中β-葡糖苷酶活性有显著影响(图4a,P<0.05)。
2017年中,纤维素二糖水解酶在不同植物功能群间呈显著差异,杂类草高于C3禾草和CK处理,C4禾草处理呈最低值(图4e,P<0.05)。
两年间,多酚氧化酶在不同植物功能群中呈显著差异(图4c,4f,2016:P<0.001;2017:P<0.001)。2016年,杂类草和CK处理较高,显著高于C3和C4禾草处理;2017年,多酚氧化酶活性在杂类草和CK处理中最高,C3禾草较低,最低为C4禾草处理。2016年,AMF显著提高除C3禾草外其余处理中的多酚氧化酶活性(图4c,P<0.05);2017年,AMF显著提升了所有处理的多酚氧化酶活性(图4f,P<0.05)。
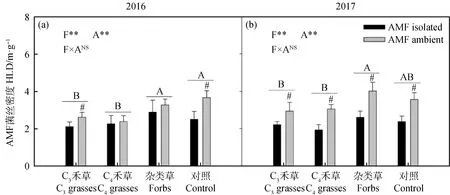
图3 2016年(a)和2017年(b)植物功能群处理(F)和AMF处理(A)对AMF菌丝密度(HLD)的影响Fig.3 The effect of AMF treatment (A) on extra-radical mycorrhizal hyphal length (HLD) among different plant functional groups (F) in 2016 (a) and 2017 (b)注:不同字母表示植物功能处理中差异显著。#表示在植物功能群处理内差异显著。*P<0.05;**P<0.01;***P<0.001;NSP>0.05Note: Different letters indicate significant differences in plant functional treatment. #indicates that there is significant difference in plant functional group treatment. * P<0.05;**P<0.01;***P<0.001;NS P>0.05
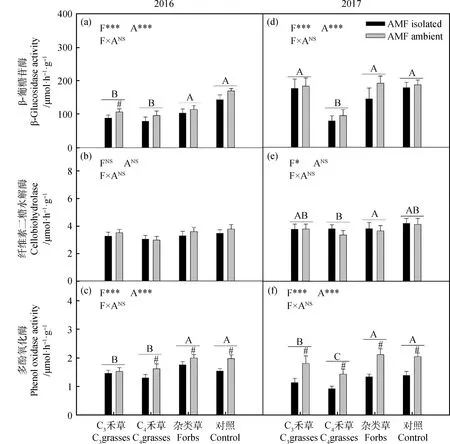
图4 2016年(a)和2017年(b)植物功能群处理(F)和AMF处理(A)对土壤酶活的影响Fig.4 The effect of AMF treatment (A) on enzymes activity among different plant functional groups (F) in 2016 (a) and 2017 (b)注:不同字母表示植物功能处理中差异显著。#表示在植物功能群处理内差异显著。*P<0.05;**P<0.01;***P<0.001;NSP>0.05Note: Different letters indicate significant differences in plant functional treatment. #indicates that there is significant difference in plant functional group treatment. * P<0.05; ** P<0.01; ***P<0.001; NS P>0.05
2.3 AMF菌丝密度与枯落物分解率的关系
两年间,AMF菌丝密度与枯落物分解率间均有显著的线性正相关关系(图5a,5b,2016年:P=0.033 1;2017年:P=0.006 6)。
3 讨论
本试验使用网袋法,通过适宜孔径的尼龙网可以成功隔离AMF菌丝,显著降低了0.45 μm网袋内的AMF菌丝密度,通过比较枯落物分解率、土壤水解酶活性和氧化酶活性,在天然草地探究了植物功能群和刈割对AMF参与枯落物分解的影响,明确AMF促进枯落物分解的可能原因。试验结果发现,2016和2017两年中AMF根外菌丝的生长均会加速枯落物的的分解,且不同功能群处理之间的差异显著,杂类草处理中的枯落物分解率显著高于C3禾草处理,C4禾草处理中枯落物分解率最小。枯落物的分解对刈割的响应不显著。使用线性回归分析发现,两年间AMF菌丝密度和枯落物分解率之间均有显著的正相关关系。本研究说明AMF会通过调控土壤酶活促进枯落物的分解,且植物功能群和刈割处理不会影响AMF对枯落物的分解作用。
Leifheit等发现,AMF通过改变土壤微环境中的养分和水分条件可以直接影响土壤中的微生物(分解者)活性,或通过为微生物提供或改变碳源间接影响微生物活性,进而影响土壤中的有机质分解[28]。与Armada等试验结果类似,本试验结果发现AMF的生长会促进土壤中β-葡糖苷酶的活性[15]。Toljander等研究得出,AMF根外菌丝的分泌物中包含有低分子量糖类,可被β-葡糖苷酶快速分解,为土壤中的其他微生物提供碳源,刺激其活性加快枯落物分解[29]。另外,AMF会显著增加土壤中的多酚氧化酶,说明AMF的生长会促进土壤中其他微生物上调对多酚氧化酶的分泌。天然草地的羊草中,木质素含量相比与纤维素含量较少,但却是枯落物中最难以分解的复合物。木质素的分解过程中起主要作用的是多酚氧化酶,此酶主要由土壤中的白腐菌分泌,很多研究发现,当土壤中氮素缺乏时,会抑制土壤中其他微生物与白腐菌之间的竞争作用,从而使得白腐菌活性上升[30]。AMF会吸收土壤中的氮素并将其转运给宿主植物,所以AMF的生长会加剧土壤微环境中氮素的匮乏,进而刺激土壤微生物(白腐菌等)的活性,以分泌更多的多酚氧化酶,促进枯落物中木质纤维素的分解。但AMF的出现对土壤中纤维素二糖水解酶活性无显著作用,说明AMF对枯落物中纤维素的分解效果不明显。土壤中大量的细菌和真菌均可以分泌纤维素二糖水解酶,故其活性的控制因子复杂较难以被单一因素影响;并且AMF获取碳源的主要方式是跟与其共生的宿主植物进行养分交换,并不需要从土壤中直接获取碳源用于自身生长[31]。所以枯落物纤维素的分解率并不受AMF控制,但可能会是其他环境因子。
植物功能群处理之间对枯落物分解率的影响有显著差异,主要是因为不同植物功能群对碳分配的策略不同[32]。C4禾草处理中物种多样性较低,仅糙隐子草(Cleistogenessquarrosa)一种,且这种植物株型矮小生物量低。2016和2017年中,C4禾草的地上和地下生物量均较其他功能群植物更少,导致与植物共生的AMF的菌丝密度较小,对土壤酶活的激发程度低。且C4禾草处理中的盖度相比其他功能群植物更少,导致地表裸露面积较大,会接受更多的太阳辐射,使土壤水分蒸发效率上升,抑制土壤微生物的活性,进而减少了对枯落物的分解。而杂类草和CK(多样性较高)处理中,土壤酶活性显著高于其他植物功能群处理。前人已有研究得出,植物多样性的增会促进土壤微生物生物量的升高,因为植物多样性高的群落会为土壤微生物提供更为丰富的碳源[33]。且2016和2017两年中杂类草和CK处理中地下生物量较高,表明其会为地下部分提供更多的碳,增加微生物的数量,促进土壤酶活性,加快枯落物的分解。
本研究发现,刈割对枯落物的分解无影响。Ren等研究发现,放牧过程中仅7%的土壤微生物变异与放牧过程本身有关,而89%的变异更可能来自于其他因素,说明微生物群落变化与土地管理方式引起的环境变化关系可能更密切,而不是放牧中的采食过程[34]。适度刈割会激发土壤微生物的活性[35]。但是,这也取决于时间尺度[36],本研究仅有三年跨度,刈割对枯落物分解的影响需要更长时间跨度才会显示。
4 结论
通过植物功能群和刈割处理模拟放牧过程中家畜采食作用,探究此过程中AMF对枯落物分解的影响。结果发现AMF主要通过提升土壤β-葡糖苷酶和多酚氧化酶活性,加速枯落物的降解。不同植物功能群分解枯落物的能力不同,其中杂类草处理分解枯落物的能力更强,而C4禾草处理中的枯落物分解率最低。AMF和植物功能群处理无显著交互作用,表明植物群落组成的变化并不会改变AMF对枯落物的分解作用。刈割对枯落物的分解在短时间内无显著影响。
