甘肃陇西黄芩灰霉病病原菌分离鉴定及田间药剂防治
2023-03-05孙雪艳蒋晶晶陈爱昌张敏敏漆永红
孙雪艳, 蒋晶晶, 杜 蕙, 陈爱昌, 张敏敏, 漆永红*
(1.临洮县农业技术推广中心, 甘肃 定西 730500; 2.甘肃省农业科学院植物保护研究所, 甘肃 兰州 730070; 3.定西市植保植检站, 甘肃 定西 743000; 4.甘肃省农业科学院生物技术研究所, 甘肃 兰州 730070)
中图分类号:S432.45文献标识码:A
文章编号:1007-0435(2023)02-0349-09
Identification of Grey Mould Pathogens Isolation fromScutellariabaicalensisand Fungicides Control in Field in Longxi,Gansu
SUN Xue-yan1#, JIANG Jing-jing2#, DU Hui2, CHEN Ai-chang3, ZHANG Min-min4*,QI Yong-hong2*
(1. Lintao Agricultural Extension Center, Dingxi, Gansu Province 730500, China;2. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu Province 730070, China;3. Plant Protection Station, Dingxi, Gansu Province 743000, China;4. Institute of Biotechnology, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu Province 730070, China)
Abstract:The aim of this study was to explore pathogens that harmed stem base and root and caused grey mould inScutellariabaicalensis. The typical samples with grey mould were collected in Longxi County,Gansu Province in the spring of 2019 to 2021,and fungi were isolated and cultured. The morphological method and molecular identification based on multiple genes,including internal transcribed spacer (ITS),glyceraldehyde-3-phosphate dehydrogenase (G3PDH),heat shock protein 60 (HSP60) and the second largest subunit of the nuclear RNA polymerase enzyme II (RPB2),were used to determine the pathogens. Meanwhile,toxicity test was determined by hyphal growth inhibition,and fungicides experiments were conducted in the field. The results showed thatBotrytiscinereawas the pathogen responsible for grey mold inS.baicalensis. When the disease occurred in spring,the sprouts did not come out of the soil and the aboveground plant parts died. The root surface near the ground turned dark green and watery,and the xylem of the underground root became soft and brown rot,while the boundary between the rot and healthy root parts was obvious. Toxicity test showed that 97% Fludioxonil had the strongest inhibition forB.cinerea,with EC50of 0.019 2 mg·L-1,followed by 98% Boscalid and 97% Procymidone with EC50of 1.248 0 and 1.758 5 mg·L-1respectively. Field experiments showed that 20% Fludioxonil SC had the best performance and the control efficacy reached 76.07%. The above results provided an important theoretical basis for the disease diagnosis and field control ofS.baicalensisgrey mould.
Keywords:Scutellariabaicalensis;Grey mould;Botrytiscinerea;Toxicity test;Fungicides control
黄芩(ScutellariabaicalensisGeorgi)为唇形科(Labiatae)黄芩属(Scutellaria)植物,是多年生草本植物。从药用植物学角度,黄芩分为根、茎叶、种子和种壳四个部位,以根和种子入药,味苦,性寒,有消炎、健胃等功效[1]。黄芩主产于我国北方的甘肃、陕西、山西等省[2],其中甘肃省定西市作为道地黄芩主产区之一,生产的黄芩具有产量高、品质佳、功效好等优势。近年来,黄芩种植面积逐步扩大,生产上连年种植,导致黄芩上的病害呈加重趋势。目前,国内已报道危害黄芩的主要病害和病原菌为:镰孢属(Fusariumspp.)引起的根腐病[3]、北方根结线虫(Meloidogynehapla)引起的根结线虫病、齐整小核菌(Sclerotiumrolfsii)引起的叶枯病、白粉菌属(Erysiphespp.)引起的白粉病[4]、立枯丝核菌(Rhizoctoniasolani)引起的茎基腐病[5]等。
灰霉病发生寄主范围广,包括蔬菜、果树、中药材等1 000多种农作物并遍布全世界,给农业造成了严重的经济损失[6]。中药材灰霉病有很多报道,李美芽等鉴定出白及叶斑灰霉病的病原菌为灰葡萄孢[7];支叶研究表明,刺五加灰霉病的病原菌为灰葡萄孢[8];马维思等报道,引起滇重楼花器腐烂的灰霉病病原菌为葡萄孢属1个新种[9];吴大椿和严清平研究发现,引起盾叶薯蓣叶、茎呈暗绿色至黑褐色水渍状软腐灰霉病的病原菌为灰葡萄孢[10];陈书珍报道,灰葡萄孢是甘肃省党参灰霉病的主要病原菌[11];王帆帆等发现,湖北和湖南两省华重楼灰霉病的病原为灰葡萄孢[12];游景茂等研究发现,湖北省铁皮石斛叶部灰霉病的病原菌为灰葡萄孢[13]。国内关于黄芩灰霉病的报道很少,发病部位局限于茎秆和叶部,且仅通过形态学特征进行病原菌鉴定[14-15],但关于危害黄芩茎基部和根部的灰霉病的病原菌未见报道。
本试验对甘肃陇西县危害黄芩茎基部和根部的灰霉病进行调查,采集症状典型的样品进行病原菌分离鉴定,通过柯赫法则进行致病性测定,开展室内和田间药效试验,旨在明确该病害的危害程度、发病症状和病原菌种类并筛选出好的药剂,为该病害的科学诊断及田间防治提供重要参考。
1 材料与方法
1.1 试验材料
1.1.1样品采集 2019—2021年连续3年于每年3—5月在黄芩主产区甘肃省陇西县福星镇(35°10′46″N,104°34′46″E)、首阳镇(35°04′51″N,104°26′16″E)、菜子镇(34°59′20″N,104°28′36″E)和通安驿镇(35°17′56″N,104°41′31″E),每个地区随机选取3~5块田进行病根调查和采集,共获得30份样品,观察并记录病害相关的症状,调查发病情况,将病样置于自封袋中,保持新鲜状态,及时带回实验室进行病原菌分离。
致病性测定供试黄芩种子及一年生黄芩苗,品种为‘甘肃’黄芩。
1.1.2培养基 马铃薯葡萄糖琼脂(PDA)培养基:参照常规方法制备。1%水琼脂培养基(1% WA)培养基:琼脂10 g、蒸馏水1 000 mL,121℃灭菌备用。L-asp培养基:K2HPO41 g,MgSO4·7H2O 1 g溶于30 mL去离子水中,将两者混合后用10 mL HCl(10 mol·L-1)溶解沉淀,KCl 0.5 g,FeSO4·7H2O 0.01 g,L-天冬酰胺2 g,葡萄糖22 g,琼脂15 g,加去离子水至1 000 mL,121℃灭菌备用。
1.1.3药剂 室内毒力测定药剂:98%腐霉利原药,江西禾益化工有限公司;97%异菌脲原药,新兴农化工(南通)有限公司;97%咯菌腈原药,河北冠龙农化有限公司;97%嘧霉胺原药,江苏丰登作物保护股份有限公司;98%啶酰菌胺原药,江苏省南通嘉禾化工有限公司。
田间防治试验药剂:50%腐霉利可湿性粉剂(WP),浙江威尔达化工有限公司;50%啶酰菌胺水分散粒剂(WG),山东兆丰年生物科技有限公司;500 g·L-1异菌脲悬浮剂(SC),江苏省苏州富美实植物保护剂有限公司;20%咯菌腈悬浮剂(SC),山东省青岛凯源祥化工有限公司。
1.2 试验方法
1.2.1病原菌分离纯化 采用组织分离法[16],将春季不发芽的病株整体挖出,经清水冲洗后,选择具有典型暗绿色软腐状的病根,在病根表皮病健交界处及撕开的木质部病健交界处刮或剪取5 mm × 5 mm的病组织,用1%次氯酸钠溶液消毒40 s,75%酒精消毒40 s,灭菌水冲洗2次后置于灭菌滤纸上晾干。将病组织移至PDA平板上,每皿4块,置25℃恒温培养箱黑暗培养3 d,挑取菌落边缘菌丝进行纯化后转接PDA斜面,4℃保存备用。
1.2.2病原菌形态观察 用灭菌打孔器在菌落边缘打出直径5 mm的菌饼分别接种在PDA培养基平板中央,设3个重复,置20℃黑暗恒温条件下培养15 d后观察菌落、菌核的颜色和形态并在光学显微镜(40×)下观察形态特征及测量大小[17]。
1.2.3致病性测定 改良烧杯水琼脂法[18]:菌株活化后,在菌落边缘打取菌饼,置于已灭菌1% WA培养基(30 mL)的一次性小纸杯中央,每杯放入1个菌饼,盖上灭菌锡箔纸;在20℃、相对湿度60%的人工气候箱中黑暗培养4 d。黄芩种子先用75%酒精消毒1 min,再用1%NaClO溶液消毒1 min,灭菌水冲洗3次后,置于垫有保湿滤纸的已灭菌玻璃培养皿中,在25℃培养箱中黑暗保湿催芽4 d。挑取发芽一致的种子均匀摆放在带菌WA培养基上,以不接菌的WA培养基为对照,每杯放入3粒,每个菌株3次重复,用灭菌锡纸封口后放入25℃,16 h光照+20℃,8 h黑暗、相对湿度60%的人工气候箱中,待黄芩苗长至纸杯口时揭去锡纸。10 d后观察发病情况,统计发病幼苗数,计算发病率,发病率(%)=发病幼苗数/幼苗总数×100。
离体根部接种法[19]:将纯化的菌株接种于PDA平板上,20℃黑暗恒温培养7 d,用直径5 mm灭菌打孔器打取菌块备用。将一年生健康黄芩幼根消毒后置于铺有灭菌浸湿纱布的铁盘中,用无菌接种针在黄芩根部表面刺伤四个定点,接种菌株于定点上,以刺伤接种空白PDA培养基为对照CK,每个根上接4个菌饼,每处理重复3次。接菌后用保鲜膜包裹铁盘,20℃培养箱中黑暗培养、观察并记录发病清况。6 d后观察记录离体根感病形态并对病变部位进行组织分离,鉴定分离到的病菌是否与原始病菌相同。
1.2.4病原菌分子生物学鉴定 将菌株分别接种于表面平铺灭菌玻璃纸的PDA平板中央,25℃黑暗培养5 d,收集菌丝于陶瓷研钵中,加入适量液氮研磨成细粉,刮取100 mg粉末于2.0 mL离心管,用试剂盒(OMEGA)提取基因组DNA。
从2019年及2021年分离的菌株中各随机选取2株,利用ITS,基因G3PDH,HSP60,RPB2进行PCR扩增,引物由生工生物工程(上海)股份有限公司合成,扩增条件见表1。PCR反应体系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,引物各1 μL,ddH2O 9.5 μL。制备1.2%琼脂糖凝胶,120 V电泳30 min,0.5 μg·mL-1EB溶液中染色10 min,置于凝胶成像仪进行拍照保存。将具特异性条带PCR产物送上海生工生物工程(上海)股份有限公司测序,所测序列与NCBI的GenBank数据库中已知核酸序列进行相似性比较,多基因测序结果采用ClustalX 2.0.10将所有基因比对并将比对结果首尾相连,利用BioEdit 5.0.6软件进行校正;通过MEGA 5.0软件以邻接法(Neighbour-Joining)重复1 000次进行聚类分析,构建系统发育树。

表1 引物序列Table 1 Primer sequences
1.2.5病原菌中B.cinerea的检测 利用灰葡萄孢特异性检测引物Bc-f/Bc-r对分离获得的所有菌株的DNA进行PCR扩增[22],检测所有菌株中的B.cinerea。引物Bc-f(5′-CAGGAAACACTTTTGGGGATA-3′)和Bc-r(5′-GAGGGACAAGAAAATCGACTAA-3′)均由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,引物各1 μL,ddH2O 9.5 μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,56℃复性30 s,72℃延伸60 s,共 27 个循环,72℃延伸10 min,16℃保温5 min。制备含核酸染料的1.5%琼脂糖凝胶,120 V电泳20 min,置于凝胶成像仪进行拍照保存。
1.2.6杀菌剂对灰葡萄孢(B.cinerea)菌丝生长的影响 采用菌丝生长抑制率法[23]。用丙酮将原药配成有效成分浓度为(1×104) mg·L-1的母液用于后续稀释,每种杀菌剂设5个不同的浓度梯度(表2)。将供试菌株活化培养5 d后,在菌落边缘打取直径为5 mm的菌饼,分别接入不同浓度杀菌剂的培养基平板中央,其中腐霉利、啶酰菌胺、异菌脲、咯菌腈使用PDA培养基,嘧霉胺使用L-asp培养基。以不含药PDA和L-asp培养基为空白对照,每处理3次重复,置于25℃恒温黑暗培养箱培养观察,第8 d采用十字交叉法量取菌落直径,计算菌丝生长抑制率,以杀菌剂浓度的对数值作为自变量(x)和菌丝生长抑制率的几率值作为因变量(y),利用最小二乘法建立“浓度对数-几率值”,建立回归方程y=ax+b,采用Excel 2010、SPSS 17.0数据处理软件计算得到相关系数(R2)和致死中浓度(EC50),根据EC50分析比较不同杀菌剂对供试病原菌的毒力效果。
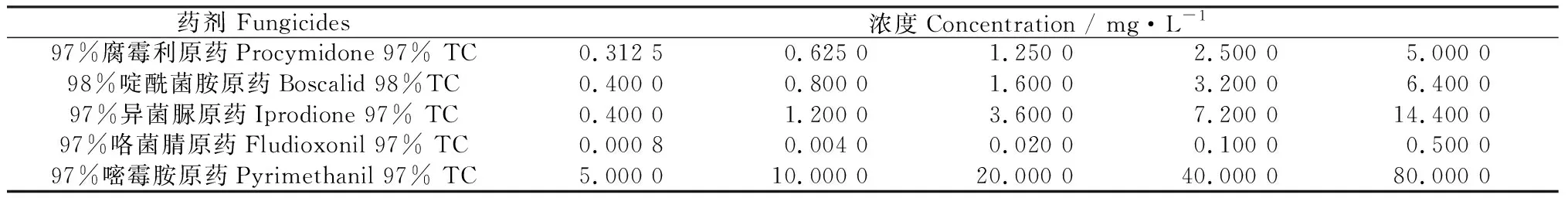
表2 供试药剂及其浓度Table 2 Different fungicides and their concentrations
1.2.7田间防治试验 试验地位于甘肃陇西福星镇黄芩结籽田,于2021年10月20日黄芩割茎后进行喷药。选择室内药效较好的药剂,每种药剂按照推荐浓度喷施,每个小区面积30 m2,每处理3次重复,以喷施清水为空白对照。2022年4月12日调查各处理小区黄芩苗发芽情况,每小区连续调查100株,共300株进行各处理防效调查。记录调查总株数及病株数,计算病株率和防治效果。病株率(%)=病株数/总调查株数×100;防治效果(%)=(对照病株率-处理病株率)/对照区病株率×100[24]。
2 结果与分析
2.1 黄芩灰霉病田间发病症状
该病在2-3年生地块发生严重,病田率50%以上,病株率35%~75%,田块形成斑秃(图1A)。茎秆自下而上变为黄褐色,后病斑扩展为中央灰褐色,边缘黑褐色绕茎一周,湿度大时产生灰色霉层,后期全株失绿枯死(图1B);地下根部表面呈暗绿色至黑褐色水渍软腐状,发病根部由上而下逐渐软腐,病斑扩大后绕茎一周(图1C),撕开表皮,木质部变软呈黄褐色,发病严重时整个根内部变褐色腐烂(图1D,1E)。
2.2 形态学鉴定特征
2019—2021年每年春季分别从甘肃省陇西县福星镇、首阳镇、菜子镇和通安驿镇等黄芩主产区采集典型不发芽的病根共计54份,分离纯化得到67株菌株(表3)。
PDA培养基20℃恒温、黑暗培养15 d后,67株菌株的菌落特征表现出明显差异,其中4株为菌丝型,63株为菌核型,未发现孢子型。初期菌丝稀疏,大多数为白色放射状,后期菌丝体颜色逐渐加深,形成球状或不规则的黑色菌核(图2A~2D)。分生孢子梗细长,淡褐色,直立或稍弯曲,丛生、单支或树状分枝;分生孢子梗顶端膨大成球型,并形成小柄,小柄上着生大量分生孢子,形状似葡萄穗状(图2E)。分生孢子为单孢,近圆形、无色,大小约为7~11×6~10 μm(图2F)。根据形态学特征,将分离获得的67株菌株初步鉴定为灰葡萄孢菌(B.cinerea)。

图1 黄芩灰霉病发病症状Fig.1 Symptoms of Scutellaria baicalensis grey mould注:A,春季田间发病症状;B,茎基部发病;C~E,根部发病Note:A,Field symptoms in the spring;B,Symptoms of stem base;C~E,Symptoms of root

表3 陇西县不同地区菌株的分离信息Table 3 Isolation of strains in Longxi County
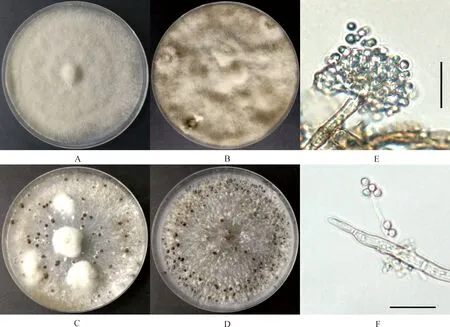
图2 黄芩灰霉病菌的形态特征Fig.2 Morphological characteristics of Scutellaria baicalensis grey mould注:A~D,菌落形态(PDA,20℃,15 d);E,分生孢子梗和分生孢子;F,分生孢子和菌丝;标尺=20 μmNote:A~D,Colonial morphology(PDA,20℃,15 d);E,Conidiophorand conidia;F,Conidia and hyphae;Scar bars=20 μm
2.3 致病性测定
改良烧杯水琼脂法致病性测定结果表明,67株菌株均经过柯赫法则验证,对催芽的黄芩根部和茎全都有极强的致病性,发病率达100%(图3A),而对照接种没有发病,黄芩幼苗长势良好(图3B)。随机选取一部分菌株利用离体根部接种法测定菌株致病性,结果表明,接种4 d后,在接种部位产生明显的暗绿色软腐病斑(图3C);随着病斑逐渐扩展,第6 d整个接种根部呈暗绿色软腐状,并有少量的菌丝缠绕或菌核产生,而对照接种根没有发病(图3D)。将上述发病根重新分离,分离率为100%,且与原接种菌一致,表明该病原菌是引起黄芩灰霉病的致病菌。

图3 致病性测定Fig.3 Pathogenicity testing注:A,黄芩幼苗接种10 d后;B,CK-A;C,离体根接种4 d后;D,离体根接种6 d后;E,CK-C和DNote:A,Scutellaria baicalensis seedlings 10 d after inoculation;B,CK-A;C,Inoculation root in vitro after 4 d;D,Inoculation root in vitro after 6 d;E,CK-C and D
2.4 病原菌分子生物学鉴定及亲缘关系分析
采用真菌通用引物对随机挑选的4个菌株rDNA-ITS基因进行PCR扩增后,获得基因序列并上传至NCBI获得GenBank登录号,其中菌株HQ-5-1和HQ-8-4为2019年病样,菌株HQ-X-3和HQ-R-31为2021年病样。BLAST比对发现其与葡萄孢属(Botrytisspp.)的同源性为100%,构建系统发育树发现4个菌株均与登录号为MN589850和MK370689的灰葡萄孢(B.cinerea)聚在一支(图4);进一步利用G3PDH,HSP60,RPB2基因进行PCR扩增,测序回来的序列采用ClustalX 2.0.10将所有基因比对并将比对结果首尾相连,利用BioEdit 5.0.6软件进行校正,通过MEGA 5.0软件构建系统发育树,结果表明4个菌株均与灰葡萄孢菌MUCL87聚为一支(图5)。以上通过4个菌株的ITS,G3PDH,HSP60和RPB2序列并结合形态学特征,将病原菌鉴定为灰葡萄孢菌(B.cinerea)。
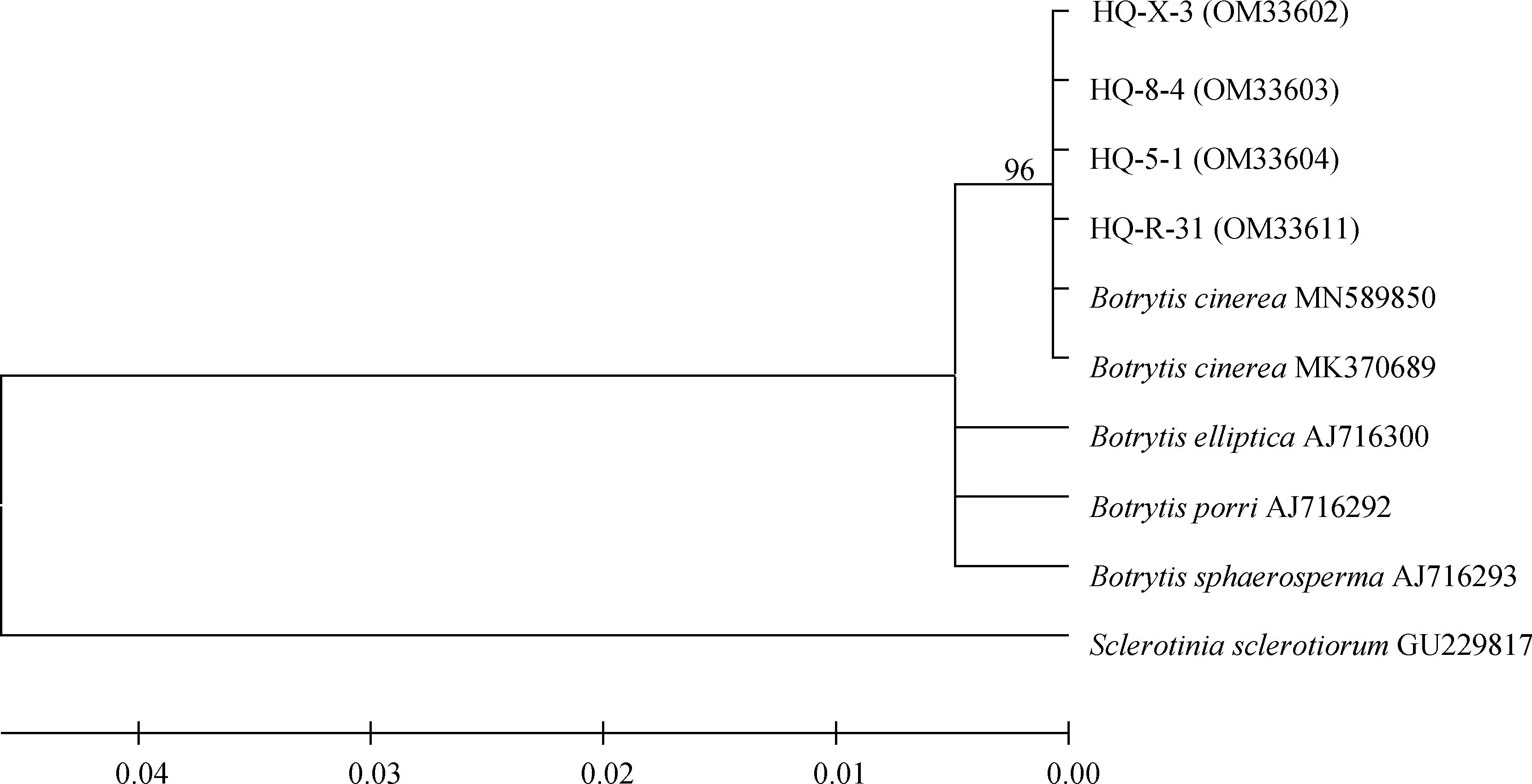
图4 基于rDNA-ITS序列邻接法构建系统发育树Fig.4 Neighbour-Joining phylogenetic tree based on rDNA-ITS gene sequences
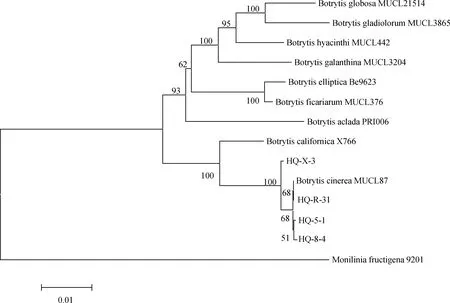
图5 基于G3PDH,HSP60和RPB2基因序列构建的系统发育树Fig.5 Phylogenetic tree based on G3PDH,HSP60,and RPB2 gene sequences
2.5 病原菌中B. cinerea的检测
对67株菌株进行灰葡萄孢特异性引物扩增,结果表明,67株菌株均可由Bc-f/Bc-r引物直接检测出大小约为300 bp的特异性条带,表明该菌株均为灰葡萄孢菌(B.cinerea)(图6)。

图6 部分菌株经灰葡萄孢菌特异性引物扩增结果Fig.6 PCR amplification results of some strains with specific primers of B. cinerea注:M,Marker II;1~16,菌株为HQ-6-2~HQ-6-23Note:M,Marker II;1~16,Strains HQ-6-2~HQ-6-23
2.6 杀菌剂对灰葡萄孢(B. cinerea)菌丝生长的影响
5种杀菌剂对灰葡萄孢(B.cinerea)菌丝生长均有不同程度的抑制作用,各药剂对菌丝的抑制作用随着处理浓度的升高而增加(表4)。在不同药剂中97%咯菌腈对灰葡萄孢的菌丝抑制作用最强,EC50仅为0.0192 mg·L-1,其次为98%啶酰菌胺和97%腐霉利,EC50分别为1.2480和1.758 5 mg·L-1,97%嘧霉胺抑制效果最差,EC50达60.584 9 mg·L-1。综合EC50筛选出对灰葡萄孢(B.cinerea)菌丝有较强抑制作用的药剂为97%咯菌腈、98%啶酰菌胺和97%腐霉利。
2.7 田间药剂防效测定
田间试验结果表明(表5),4种药剂对黄芩灰霉病的防效均在46.01%以上,其中20%咯菌腈悬乳剂的防效最高,达76.07%,与其他3种药剂差异显著(P<0.05)。
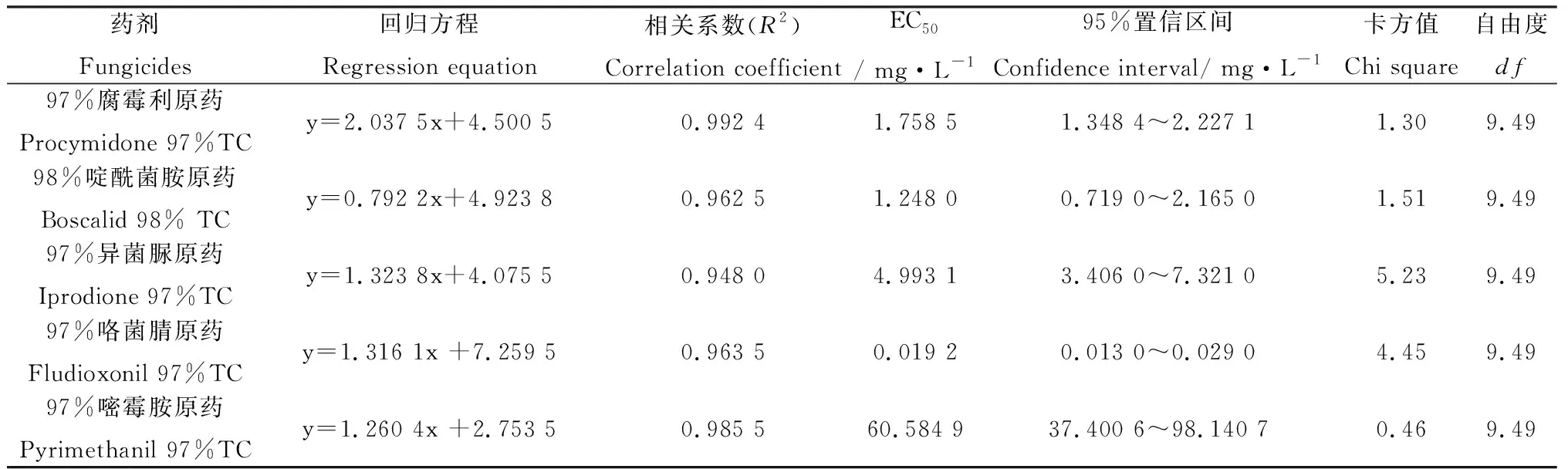
表4 5种杀菌剂对灰葡萄孢菌丝生长的抑制效果Table 4 Inhibition of five fungicides against mycelium growth of B. cinerea
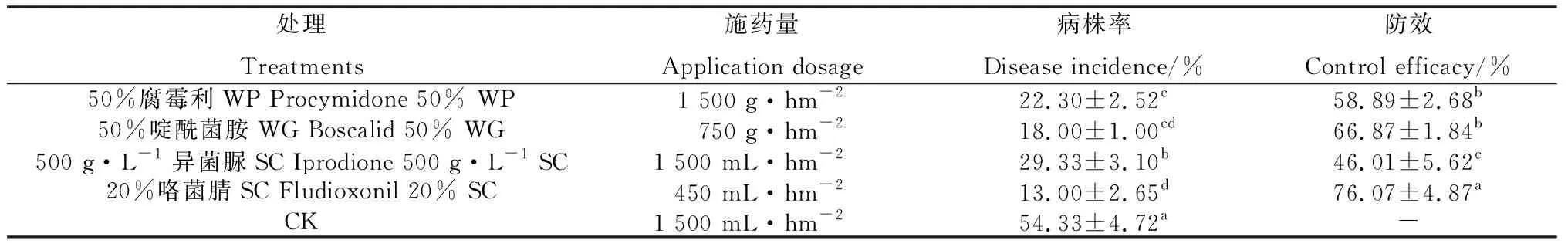
表5 4种杀菌剂对黄芩灰霉病的田间防治效果Table 5 Field control efficacy of four fungicides on Scutellaria baicalensis grey mould
3 讨论
葡萄孢属(Botrytisspp.)是常见的一种病原菌,具有适应强、寄主范围广,危害严重等特点,该属真菌包括22个种和1个杂交种,大多数种的寄主范围较窄,只侵染1个或几个相似种的寄主[25]。灰葡萄孢(B.cinerea)寄主范围最广,可引起生长期和贮藏期200多种植物的灰霉病,表面产生大量的灰色霉层,症状表现为花腐、果腐和叶斑等[26]。目前研究表明灰葡萄孢(B.cinerea)可侵染黄芩的叶片、叶柄、嫩茎和花器[27],本试验首次发现灰霉病菌可以侵染黄芩的茎基部和根部,同时通过形态学和多基因分子生物学特征鉴定出病原菌为灰葡萄孢菌(B.cinerea)。课题组研究发现,镰孢属(Fusariumsp.)可危害黄芩根部引起根腐(另文发表),而灰葡萄孢(B.cinerea)也可以危害黄芩的茎基部和根部,但两者之间有很大的差别,相似处是地上部均表现为叶片发黄,植株萎蔫,而地下部表现的症状不同,镰孢菌危害的黄芩根部表面有黑色或黑褐色的裂纹,受害部位木质部坚硬[28],而灰葡萄孢危害的根表面呈现水渍状暗绿色,撕开表皮,木质部变软呈黄褐色,发病严重时整个根变褐色腐烂和腐朽;同时镰孢菌引起的根腐病在黄芩每茬均发生,发病的植株翌年可以成活,而灰葡萄孢引起的灰霉病主要发生在2~3年生黄芩植株茎基部和根部,发病植株冬天枯死或翌年不发芽。
灰葡萄孢菌的菌丝体、分生孢子和菌核都能越冬,成为翌年的初侵染源,分生孢子传播快,自然孔口或伤口均可侵染[27-28]。割茎是中药材栽培技术中获得高产优质的一项有效措施[28-29],黄芩在秋季割茎和采收种子后,病原菌可通过秋季割取黄芩地上部分后残留在地表附近的植株残体伤口进行侵染,继而在越冬时由茎基部侵染到根部,翌年部分植株发病死亡或地上部分不发芽。因此,建议秋季黄芩割茎后喷施药剂消灭伤口及茎基部的病原菌,对减轻或阻止灰霉病的发生起到重要作用。
毒力回归方程能有效反映不同浓度杀菌剂与抑菌效果的关系[30],EC50是衡量杀菌剂毒力强弱的标准。咯菌腈属于苯基吡咯类非内吸性杀菌剂,防病谱较广,通过抑制菌体葡萄糖磷酰化反应抑制病原菌的生长[31]。腐霉利和异菌脲均属二甲酰亚胺类杀菌剂,通过抑制菌体内甘油三脂的合成,阻碍菌丝发育,兼保护和治疗作用[32]。啶酰菌胺属于新型烟酰胺类内吸性杀菌剂,通过抑制琥珀酸基质的氧的呼吸妨碍病原菌的能量代谢[33]。嘧霉胺属于苯并咪唑类杀菌剂,其作用靶点单一,易使病菌产生抗性[34]。本研究发现,咯菌腈、啶酰菌胺和腐霉利对引起黄芩灰霉病的灰葡萄孢菌有较强的抑菌活性和防治效果,该结果与赵建江、张江兆等人在番茄和黄瓜灰霉病菌抗药性监测结果一致[36-37],建议生产上在黄芩割茎伤口处使用咯菌腈或者与腐霉利、异菌脲和啶酰菌胺这三种药剂混合交替喷施来预防黄芩茎基部和根部灰霉病。
4 结论
黄芩灰霉病严重危害其茎基部和根部,造成植株冬天枯死或翌年不发芽,鉴定其病原菌为灰葡萄孢菌(B.Cinerea);室内毒力测定和田间防效结果表明咯菌腈对黄芩灰霉病的防效最好,建议生产上将咯菌腈与腐霉利等药剂混合交替喷施防治黄芩灰霉病。
