罕见RET融合及MET扩增双突变的肺癌脑转移1例
2023-03-03邢淑静滑兰兰
邢淑静 滑兰兰
1威海市中心医院肿瘤内科,威海 264400;2威海市中心医院超声科,威海 264400
病例资料
患者,男性,72岁,“慢性阻塞性肺疾病”病史7年余。因“左侧嘴角下垂2 d”于2022年6月3日就诊于威海市中心医院。查体:神志清,精神一般,左侧口角下垂,左侧鼻唇沟浅,伸舌居中;双肺呼吸音减弱,未闻及明显干湿性啰音;心律齐,各瓣膜听诊区未闻及杂音;腹软、平坦,无压痛、反跳痛;四肢肌力、肌张力均正常,双侧巴彬斯基征阴性。入院后完善检查,男性肿瘤标志物:癌胚抗原1.43 μg/L,神经元特异性烯醇化酶9.5 μg/L,血清糖类抗原19-9 35.6 U/ml,其余均在正常范围内。血常规、肝功能、血生化、血凝均正常。颈部淋巴结彩超未见异常肿大淋巴结。肝胆胰脾肾腹腔彩超未见异常。胸部CT示双肺纹理增粗紊乱,双肺小叶间隔增厚,以左肺为著,双肺见多发结节影,左肺下叶背段见软组织密度影,范围约38 mm×27 mm,背段支气管截断,纵隔内见多发肿大淋巴结影(图1)。颅脑MRI示右侧额颞叶见类圆形稍长T1信号影,大小约2.0 cm×1.6 cm,周围见片状水肿信号,右侧脑室受压变窄(图2)。患者考虑肺原发恶性肿瘤合并脑转移瘤,2022年6月6日行支气管镜检查,结果示右肺各叶段支气管管腔通畅,未见狭窄、出血及新生物,左肺上叶固有支气管黏膜充血水肿,管腔略狭窄,左肺下叶背段支气管黏膜水肿明显,管腔闭塞,病理示(左肺下叶背段)钳检标本:浸润性低分化肺腺癌。免疫组化:TTF-1(+)、CK5/6(-)、P40(-)、Ki-67(阳性率60%)、Napsin-A(+)、CgA(-)、Syn(-)。2022年6月13日开始予全脑图像引导三维适型调强放射治疗;肿瘤区(gross tumor volume,GTV):右额颞叶脑转移瘤;计划肿瘤区(planning gross tumor volume,PGTV):GTV外扩3 mm;临床靶区(clinical target volume,CTV):全脑;计划靶区(planning target volume,PTV):CTV外扩3 mm。95% PGTV:300 cGy/f x 18f,5f/W,剂量54 Gy;95% PTV:300 cGy/f x 10f,5f/W,剂量30 Gy。放疗期间予甘露醇联合激素改善脑水肿,同时完善肺癌基因检测。2022年6月16日基因检测回报为原癌基因(rearranged during transfection,RET)KIF5B基因融合合并间充质上皮转移因子(mesenchymal-to-epithelial transition,MET)基因扩增(表1),2022年6月20日患者开始服用克唑替尼250 mg bid联合卡博替尼60 mg qd靶向治疗。2022年7月6日结束全脑放疗,继续双靶药物治疗。2022年9月18日复查胸部CT提示对比前片(2022年6月3日):左下肺门见混杂软组密度影,内见钙化,范围较前缩小,周围斑片影较前略少,双肺见多发结节影,较前未见明显变化,纵隔内见多发淋巴结影较前减小(图3)。患者服药期间出现轻度皮疹,经对症治疗后好转,总体耐受性良好。

表1 1例肺癌脑转移患者基因检测结果

图1 1例肺癌脑转移患者2022年6月3日入院胸部CT。A为肺窗,B为纵膈窗
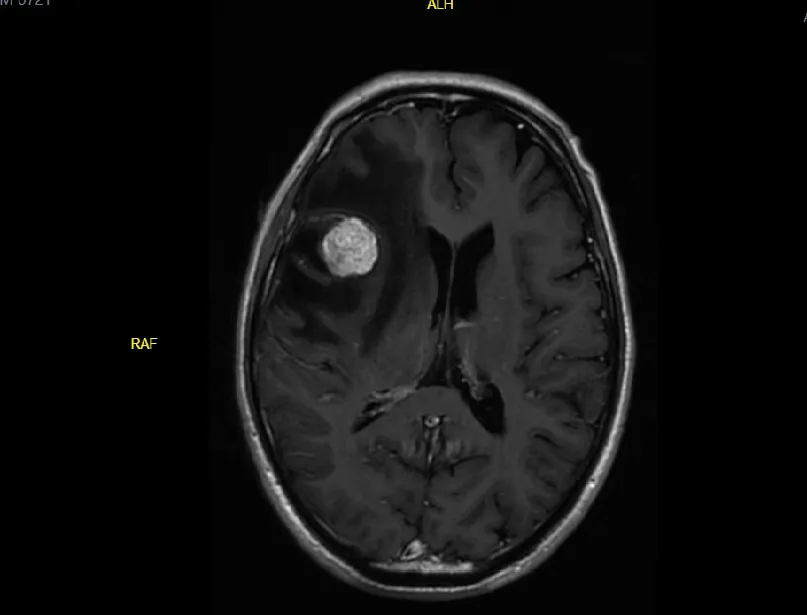
图2 1例肺癌脑转移患者2022年6月3日颅脑MRI:右侧额颞叶占位,伴有周围水肿

图3 1例肺癌脑转移患者2022年9月18日复查胸部CT。A为肺窗,B为纵膈窗
讨 论
肺癌发病率目前居世界恶性肿瘤首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌患者的80%~85%;晚期NSCLC患者预后较差,5年总生存率不超过5%[1]。近年来,针对NSCLC发生、发展过程中的驱动基因采取特异的靶向治疗显著延长了驱动基因阳性晚期NSCLC患者的生存期。NSCLC中最常见的驱动基因突变为表皮生长因子受体(epidermal growth factor receptor,EGFR)基因及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合基因阳性。非常见突变基因包括c-ros原癌基因1(ROS proto-oncogene 1,ROS1)、B-raf原癌蛋白(B-raf proto-oncoprotein,BRAF)V600E、类表 皮 生长因子 受 体2(human epidermal growth factor receptor,HER2)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,Kras)、MET、RET;近年来越来越多针对此类非常见突变的靶向药物得以研发并投入使用,为这部分肺癌患者治疗带来了希望。本例患者经基因检测后证实为RET扩增及MET融合双基因突变,罕见发生,治疗上采用两种靶向药物联合治疗,结合全脑放疗,目前达到了临床部分缓解。
RET基因融合在肺腺癌和腺鳞癌中发生率为1%~2%[1],其 中 最 常 见 的RET融 合 是KIF5B、CCDC6、NCOA4等[2]。流行病学提示RET融合多见于女性、小于60岁、不吸烟及腺癌患者[3]。RET融合的患者大多数确诊时已处于晚期[4],其中合并脑转移较为常见,预后较差。Lee等[5]对59例接受过治疗的RET融合NSCLC患者进行了分析,发现诊断时已有17例(28.8%)发生脑转移,随访期间又有11例(18.6%)发生脑转移,发生脑转移的中位时间为19个月,24个月时脑转移的累积发生率大于60%。因此,研究者普遍认为RET基因融合阳性是脑转移的独立危险因素。常见的RET抑制剂为塞尔帕替尼、普拉替尼。美国食品药品监督管理局(Food and Drug Administration,FDA)于2020年批准这两种药物用于RET基因融合晚期NSCLC的治疗。一些小分子多靶点酪氨酸受体拮抗剂(tyrosine kinase inhibitor,TKI)如卡博替尼、乐伐替尼及凡德他尼等对于RET融合基因阳性晚期NSCLC患者也显示出一定的疗效,客观缓解率(objective response rate,ORR)为15%~53%,中位无进展生存期(progression free survival,PFS)为4.5~7.3个月[1]。
MET基因最常见的突变为14外显子跳跃和扩增,其中14外显子跳跃发生率为3%[6],MET扩增在初治的NSCLC中发生率为1.4%~5.6%[7]。MET扩增的NSCLC患者整体预后较差,为EGFR突变患者应用EGFR-TKI获得性耐药的机制之一[1]。Baldacci等[8]研究发现,MET扩增可增加EGFR突变的NSCLC患者远处转移发生概率。针对MET通路的小分子TKI药物包括克唑替尼、卡马替尼等。克唑替尼可通过阻止c-MET自身磷酸化而抑制细胞增殖,2019年美国国家癌症综合网络(National Comprehensive Cancer Network,NCCN)指南推荐克唑替尼治疗高水平的MET扩增或MET 14外显子突变的NSCLC患者。卡马替尼通过与三磷酸腺苷竞争性与MET受体结合进而诱导肿瘤细胞凋亡。2020年5月FDA批准卡马替尼用于治疗MET 14外显子跳跃突变的转移性成年NSCLC患者。另外一大类针对MET的靶向药物为MET单克隆抗体,如Onartunzumab、TAK701、Emibetuzumab等,这些药物在临床研究中也看到了一定的疗效,但研究结果并不令人满意,与其他药物联合应用具有一定前景[1]。
本例肺癌脑转移患者同时合并RET融合及MET扩增双突变。关于驱动基因共突变的分子机制尚不清楚,目前主要有两种假说。部分研究者认为是由于肿瘤的异质性所致,肿瘤细胞具有多克隆性,携带不同驱动基因的肿瘤细胞组成肿瘤组织,从而可检测到不同的驱动基因突变。然而,另有研究指出,不同驱动基因突变可发生在同一细胞[9]。针对RET融合及MET扩增双突变的晚期NSCLC患者的治疗,尚无大型临床试验数据支持,如突变丰度与靶向药物剂量的相关性、双靶治疗同时带来TKI不良反应的叠加等问题需要进一步探索和研究。本例患者针对突变结果采用克唑替尼联合卡博替尼治疗,虽然治疗期间出现轻度皮疹,但总体耐受,目前临床获益,可为驱动基因双突变的晚期NSCLC患者提供治疗思路。对于该例患者,随着双靶用药时间的延长,我们不仅需要关注患者的临床缓解率和总生存期,TKI常见不良反应,如皮疹、高血压、转氨酶升高、蛋白尿等也是不可忽视的。
