局部进展期结直肠癌新辅助免疫治疗临床研究及应用进展*
2023-02-14陈顺仵朝晖解有成王俊科梁昭君李斌综述于晓辉审校
陈顺 仵朝晖 解有成 王俊科 梁昭君 李斌 综述 于晓辉 审校
结直肠癌(colorectal cancer,CRC)是全球第三大最常诊断的癌症,也是癌症相关死亡的第二位原因[1]。据2022 年中国癌症统计报告显示:在所有恶性肿瘤中,CRC 发病率据第2 位,死亡率据第4 位,每年新发病例约40.8 万例,死亡病例约19.6 万例,极大威胁着人类健康[2]。近年来,随着人口老龄化趋势加快以及工业化和城市化的发展,CRC 发病率和死亡率呈现上升趋势,且多数患者确诊时已属于局部进展期,这使得有效的治疗变得更加困难。目前根治性手术切除仍然最佳的治疗手段,然而术后局部高复发率使得患者长期生存面临挑战[3]。
1 局部进展期结直肠癌传统治疗的局限性与挑战
局部进展期结直肠癌(local advanced colorectal cancer,LACRC)指Ⅱ期(cT3~4,N0)/Ⅲ期(cT1~4,N+)的CRC。对于局部进展期直肠癌(locally advanced rectal cancer,LARC)患者术前化学放射治疗(neoadjuvant chemoradiotherapy,nCRT)即以氟嘧啶为基础的化疗加50.4 Gy 的放疗,后进行全直肠系膜切除术(total mesorectal excision,TME)是美国国立综合癌症网络(NCCN)指南推荐的标准治疗方法[4]。而对于局部进展期结肠癌(locally advanced colon cancer,LACC)患者,当前nCRT 治疗仍存在争议。研究显示,nCRT 并不能提高患者长期生存率。此外,该方案还存在术后各种严重的短期或长期并发症的风险,如吻合口漏、会阴部伤口愈合不良、泌尿生殖器和性功能障碍、肠道功能紊乱等,这些使得患者临床获益受到极大限制[5]。因此,对LACRC 患者而言,探索更有效的治疗方法是迫切需求。而新辅助免疫治疗(neoadjuvant immunotherapy,nIT)的出现,引起了研究者的广泛关注。
2 免疫检查点抑制剂应用于新辅助治疗的优势
针对程序性死亡受体-1(programmed cell death protein-1,PD-1)与其配体(programmed cell death-ligand 1/2,PD-L1/PD-L2)或细胞毒性T 淋巴细胞相关蛋 白-4(cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)途径的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)疗法,已成为多种恶性肿瘤治疗的重要组成部分[6-7]。鉴于ICIs 在晚期癌症治疗中良好的安全性和令人鼓舞的客观反应性,越来越多的研究者探索这些药物在新辅助治疗中的益处。有研究显示,相比于新辅助化疗主要是在术前减少或清除肿瘤,nIT 可通过增强针对肿瘤抗原的全身免疫力,更好地靶向和消除微转移灶,降低复发风险[8]。其存在的机制主要有以下两点:1)ICIs 可使已经驻留在肿瘤微环境中的肿瘤特异性细胞毒性T 细胞恢复活力,使其激活、增殖,并运输至微转移灶。2)树突状细胞向肿瘤引流淋巴结中的T 细胞呈现肿瘤抗原并使其激活,这些活化肿瘤特异性T 细胞随后可以进入血液并重新迁移至肿瘤部位(图1)。

图 1 nIT 增强机体全身免疫消除微转移灶的机制
3 新辅助免疫治疗在不同微卫星状态CRC 的临床研究进展
基于CRC 突变模式不同,可分为具有错配修复缺陷(mismatch repair deficient,dMMR)或微卫星高度不稳定(microsatellite instability⁃high,MSI⁃H)特征的肿瘤和具有微卫星稳定(microsatellite stability, MSS)或错配修复正常(mismatch repair proficient,pMMR)特征的肿瘤[9]。其中,dMMR/MSI-H 型占比约15%,pMMR/MSS 型占比85%[10]。2015 年Le 等[11]首次报道帕博利珠单抗治疗dMMR/MSI-H CRC 患者,高达40%的客观反应率(objective response rate,ORR)以及78%无进展生存期(progression-free survival,PFS),开启了CRC 免疫治疗新时代。此后的临床试验进一步探究了ICIs 应用于MSI-H/dMMR CRC 的价值,并取得了令人振奋的结果。居于此,美国食品药品监督管理局(FDA)于2020 年6 月批准帕博利珠单抗作为MSI-H/dMMR CRC 患者的一线治疗方案[12]。而在pMMR/MSS CRC患者中,尽管对ICIs 的反应不理想,但随着研究CRC肿瘤特性以及ICIs 原发性耐药机制的深入了解,nIT 联合其他治疗模式也显示出了一定的临床效果。
4 dMMR/MSI-H LACRC 的临床试验
目前,以ICIs 为基础的nIT 在LACRC 中的研究正在如火如荼地开展,并取得了令人鼓舞的初步证据[13]。
4.1 dMMR/MSI-H LACRC 患者ICIs 单药新辅助免疫治疗
近年来,国内外相继报道了ICIs 单药在dMMR/MSI-H LACRC 患者中的nIT 的临床研究。Hu 等[14]的PICC 试验第一个报道了单药特瑞普利单抗在dMMR/MSI-H LACRC 患者中nIT 的前瞻性研究,单药组17 例患者中11 例达到病理完全缓解(pathological complete response,pCR),其中10 例发生1~2 级免疫相关不良事件(immune-related adverse events,irAE)。Liu 等[15]回顾性分析了8 例接受帕博利珠单抗或纳武单抗dMMR/MSI-H LACRC 患者的效果,所有患者均接受手术,术后pCR 率达100%,其中2 例患者术后证实为pCR,1 例达到临床完全缓解(clinical complete response,cCR)后采取了“观察等待”治疗策略。
以上小样本研究显示出dMMR/MSI⁃H LACRC 患者接受ICIs 单药nIT 的良好效果,正在进行的临床上试验也进一步论证其可行性(表1)。
4.2 dMMR/MSI-H LACRC 患者ICIs 组合的新辅助免疫治疗
2018 年欧洲肿瘤学会公布的第一项nIT 的Ⅱ期研究结果,在纳入的7 例dMMR/MSI-H LACRC 患者均接受伊匹木单抗联合纳武单抗的nIT,后接受根治性切除手术,未出现手术延迟且有4 例患者术后病理显示为pCR[16]。Trojan 等[17]报道了1 例Lynch 综合征的dMMR/MSI-H LACRC 年轻患者,为保持生育能力而拒绝放化疗,最后接受伊匹木单抗联合纳武单抗的nIT,在治疗的第30 天接受了TME,术后标本证实为pCR。
尽管ICIs组合的nIT 在MSI-H/dMMR LACRC 患者中研究较少,但也显示出了较好的临床效果,值得进一步去探索(表1)。
4.3 dMMR/MSI-H LACRC 患者新辅助免疫治疗联合放化疗
2021 年欧洲肿瘤学年会上报道了R⁃IMMUNE研究,在nCRT 结束后,加入4 次阿替利珠单抗治疗后手术,在纳入的26 例患者中,25 例完成手术,6 例术后病理显示为pCR[18]。Shamseddine 等[19]的AVERECTAL 研究中,在40 例至少完成了1 个周期的ICIs联合放化疗后进行TME 的患者中,有27 例达到主要病理反应(major pathological remission,mPR)(<10%的存活肿瘤细胞),15 例达到pCR,后续研究将进一步报告3 年无病生存率和总生存率。
ICIs 联合放化疗新辅助治疗在MSI-H/dMMR LACRC 患者中产生了良好的病理反应和轻微irAE,不影响随后的手术,可能会改变当前的治疗模式,但需要进行大样本的临床试验来证实(表1)。
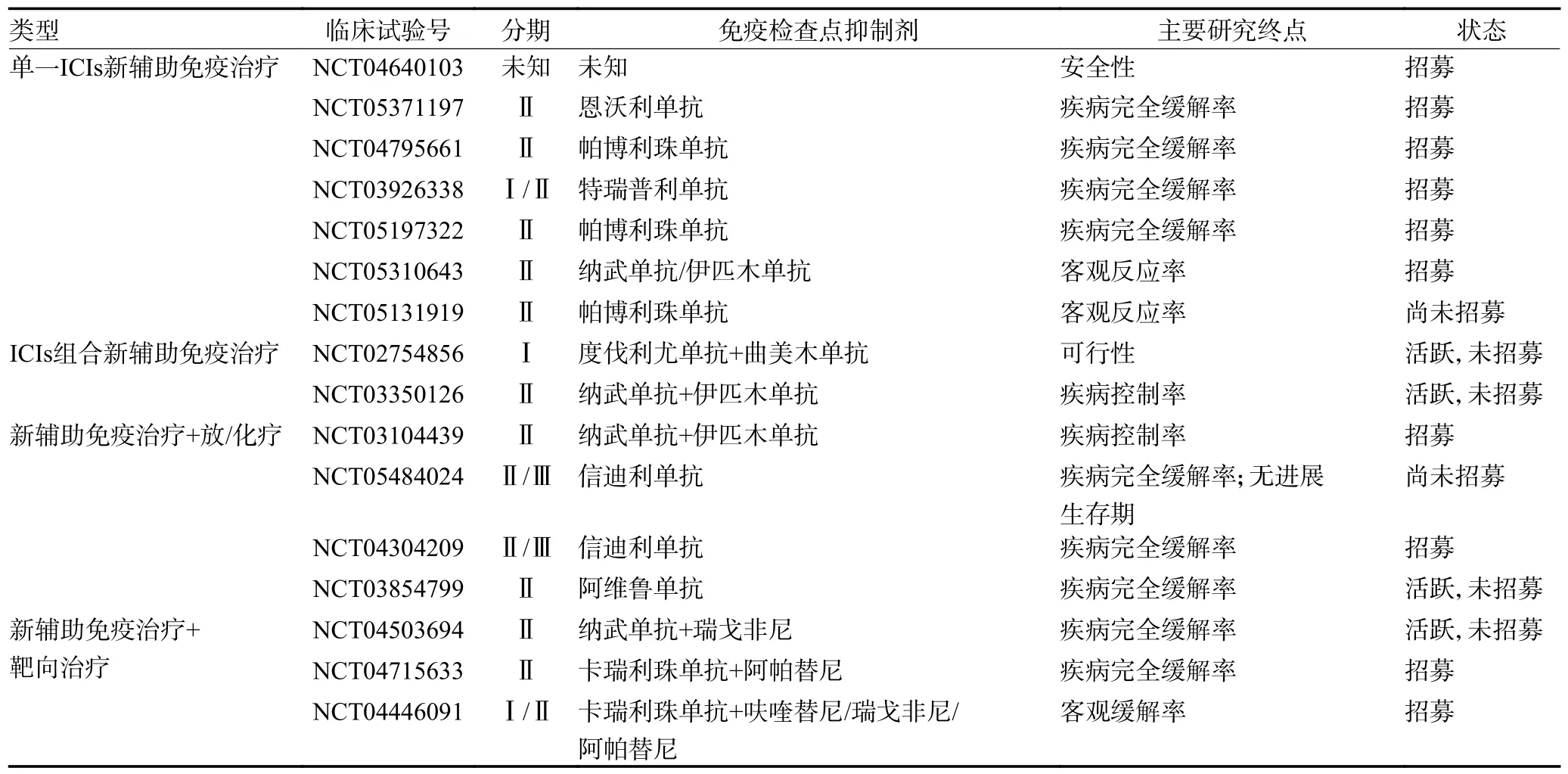
表1 正在进行dMMR/MSI-H LACRC 患者nIT 的单一或联合的新辅助免疫治疗临床试验
4.4 dMMR/MSI-H LACRC 患者新辅助免疫治疗联合靶向治疗
一项来自中国回顾性病例研究,评估了nIT 联合靶向药物治疗对dMMR/MSI-H 胃肠道恶性肿瘤患者的有效性和安全性,在报道的MSI-H LACRC 患者中2 例患者术后均证实为pCR,且治疗过程中未出现严重的irAE,该研究表明MSI-H/dMMR LACRC 患者可从ICIs 联合靶向药物的治疗中受益[20]。其他的正在进行研究,其结果可能会进一步证明nIT 联合靶向治疗作用(表1)。
5 pMMR/MSS LACRC 的临床试验
与dMMR-MSI-H 型CRC 不同,pMMR/MSI-L型肿瘤的突变负荷较低,对免疫细胞的招募差,导致对ICIs 的反应不理想。近期的临床试验在pMMRMSI-L LACRC 患者中探索多种治疗模式。
5.1 pMMR/MSS LACRC 患者ICIs 单药新辅助免疫治疗
Chalabi 等[21]的NICOLE 研究首次报道了在pMMR/MSS LACRC 患者中纳武单抗单药的nIT,患者在第1 天和第15 天接受240 mg 的纳武单抗治疗,手术在治疗开始后5 周内进行。在纳入的22 例患者(19 例pMMR,3 例dMMR)均接受了TME,未延误或发生手术并发症,3 例pMMR 肿瘤中观察到mPR,包括1 例pCR。然而,在KEYNOTE 016 研究中,pMMR/MSS LACRC 患者对单一ICIs 基本无效[11]。基于以上矛盾结果,研究者们在新的联合模式上进行广泛探索。
5.2 pMMR/MSS LACRC 患者ICIs 组合的新辅助免疫治疗
ICIs 的组合治疗有可能会产生协同效应。NICHE研究作为nIT 的“开山鼻祖”,2018 年的研究报告了第一个探索性结果,在14 例患者中(7 例dMMR,7 例pMMR),采用了纳武单抗联合伊匹木单抗治疗,结果显示,4 周治疗后7 例dMMR 患者肿瘤得到了明显缓解,4 例患者达到了cCR,pMMR 患者几乎未出现缓解,但在2020 年更新的进一步的研究结果显示出了对pMMRLACRC 患者的作用[22]。Avallone 等[20]报道了68 例患者行ICIs 组合nIT 治疗患者情况,其pCR率为 35.3%,mPR 为58.8%(40/68)。
5.3 pMMR/MSS LACRC 患者nIT 联合放化疗
Yuki 等[23]VOLTAGE-A 作为第一项将nCRT 与免疫疗法联合起来的研究,其短期结果表明,nCRT 后再进行纳武单抗和根治性手术可以有效治疗MSS LACRC 患者。在37 例患者中,11 例患者获得pCR,14 例达到mPR。上述数据表明,ICIs 与nCRT 相结合的治疗策略有巨大潜力。Lin 等[24]一项前瞻性、单臂、Ⅱ期试验评估术前nCRT 联合随后的卡培他滨、奥沙利铂和卡瑞利珠单抗对LARC 患者的疗效和安全性,可评估的27 例患者均进行手术治疗,其中26例患者中12 例发生pCR,未发生严重的irAE,该结果证实了nCRT 联合卡培他滨、奥沙利铂和卡瑞利珠单抗后延迟手术,尤其在pMMR 患者中显示出了LARC患者良好的pCR 率和耐受性。以上研究表明,nIT 联合放化疗可能成为MSS/pMMR LACRC 群体的标准治疗方法,正在进行的临床试验将进一步评估其可行性(表2)。
5.4 pMMR/MSS LACRC 中nIT 联合靶向治疗
临床前数据表明,抗血管生成剂可通过上调PDL1 的表达,减少免疫抑制细胞,以及增强抗原呈递细胞和树突状细胞之间的相互作用,增加CD8+T 细胞的浸润,提高CD8+T 细胞的抗肿瘤活性[25]。Fukuoka 等[26]的一项开放性、剂量递增和剂量扩展期Ⅰb 临床试验探究了瑞戈非尼联合纳武单抗治疗转移性胃癌和CRC,在pMMR/MSS LACRC 患者中,免疫联合靶向药物治疗的有效率达36%,中位数PFS 为7.9 个月,显示出了联合用药具有可管理的安全性和良好的抗肿瘤活性。正在进行的更大的临床研究将进一步论证其可行性(表2)。
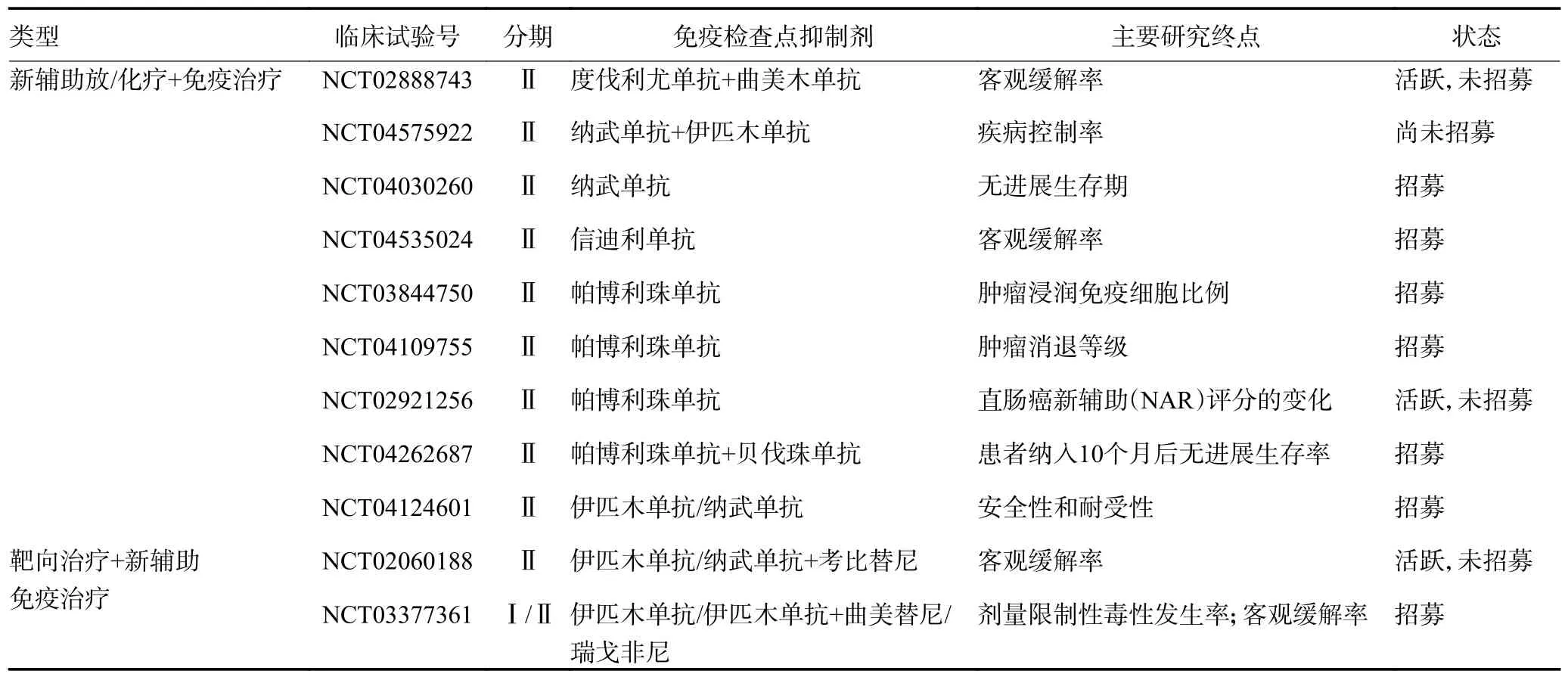
表2 正在进行pMMR/MSS LACRC 患者nIT 的单一或联合的临床试验
6 新辅助免疫治疗在器官保留和功能保留中的作用
2004 年Habr-Gama 等[27]首次报道了“W&W”非手术器官保留策略。这种方法适用于经nCRT 后有cCR 的直肠癌患者,未接受传统的手术,而直接进入了密切的随访和观察期,在不影响患者生存期的情况下保留器官功能。基于nIT 中较高的pCR 和cCR 以及持久的临床获益特点,使得LARC 的nIT 后获得cCR 的患者成为“W&W”策略理想的人群。与传统的nCRT 相比,nIT 对括约肌功能、性功能和膀胱功能的损伤风险较小,避免手术及其伴随的并发症,从而提供器官保存并改善长期预后。此外,对虚弱和不适合MET 的CRC 手术患者,采取“W&W”策略,可能会降低死亡率[28]。综上所述,基于nIT 在直肠癌患者器官中保留和功能保留中的作用,因此其进一步研究成果令人期待。
7 结语与展望
来自早期的临床试验证据表明,nIT 在LACRC患者中对减少局部高复发风险、消除术后微转移灶等方面存在着极大的优势。此外,研究发现,nIT 与放化疗的联合使用能带来更好的临床疗效,但最佳的放射线剂量和免疫检查点抑制剂治疗的时间仍不确定。除此以外,对联合应用的疗效评估的生物学标志物还需要进一步探索。正在进行的高质量临床试验有可能回答上述问题,其结果将有助于nIT 纳入CRC 的多学科管理,可进一步塑造免疫疗法研究的未来格局,使更多LACRC 患者受益。
