肿瘤患者T 细胞受体多样性和克隆性的高通量测序分析*
2023-02-14杨黎张茹黄建敏宋亚东张志新张毅
杨黎 张茹 黄建敏 宋亚东 张志新 张毅
根据2019 年世界卫生组织(WHO)统计,癌症作为目前全球主要死因之一,肺癌、食管癌是发病率和死亡率均较高的主要恶性肿瘤[1]。继常规治疗(手术、放疗、化疗)、靶向治疗之后,免疫疗法已成为癌症治疗的第四大支柱[2],且具有效果好、不良反应小和防止复发等优点。T 细胞在病原体清除和肿瘤监测中起着核心作用,且已被证实具有杀伤恶性细胞的能力[3]。因此,目前肿瘤免疫治疗以T 细胞为中心,主要集中于增强T 细胞特异性反应,增强抗肿瘤免疫反应[4]。
T 细胞是获得性免疫系统的主要组成部分。T 细胞表达细胞表面的抗原受体,即T 细胞受体(TCR),识别抗原提呈细胞提呈的主要组织相容性复合体(major histocompatibility complex,MHC)分子结合的多肽。克隆型TCR 为α 链和β 链组成的异二聚体[5]。α 链和β 链由恒定区(C 区)、可变区(V 区)、跨膜区及胞质区等组成;V 区,又称互补决定区(complementarity-determining region,CDR),是特异性识别抗原肽/组织相容性抗原复合物的关键部位[6]。CDR3 代表可变区域中最多样化和最复杂的部分。因此,可以通过CDR3 序列的多样性来衡量TCR 的多样性[7-9]。TCR测序已成为分析宿主-肿瘤相互作用的一种强有力的新技术。
本研究旨在通过对健康人、恶性肿瘤患者外周血以及肿瘤组织进行TCR 测序,阐述恶性肿瘤患者TCR 谱的特点,为未来肿瘤的诊断和治疗提供潜在的生物标志物,具有重要的临床指导意义。
1 材料与方法
1.1 临床资料
收集2019 年4 月至2021 年5 月郑州大学第一附属医院8 例食管癌和8 例肺癌患者的外周血标本,以及1 例食管癌患者肿瘤切除标本,病理诊断均明确,具有完整的临床病理资料(表1),其中男性13 例,女性3 例,年龄50~71 岁。所有患者均未行放、化疗,并排除严重感染性疾病、自身免疫性疾病以及近期使用免疫抑制剂治疗史情况。根据美国癌症联合会(AJCC)第8 版食管癌及肺癌TNM 分期体系进行肿瘤分期。以17 例健康人外周血作为对照组,排除恶性肿瘤、严重感染性疾病、自身免疫性疾病以及近期使用免疫抑制剂治疗史情况,其中男性4 例,女性13 例,年龄20~19 岁5 例,30~39 岁3 例,50~59岁6 例,60~69 岁2 例,70~79 岁1 例。
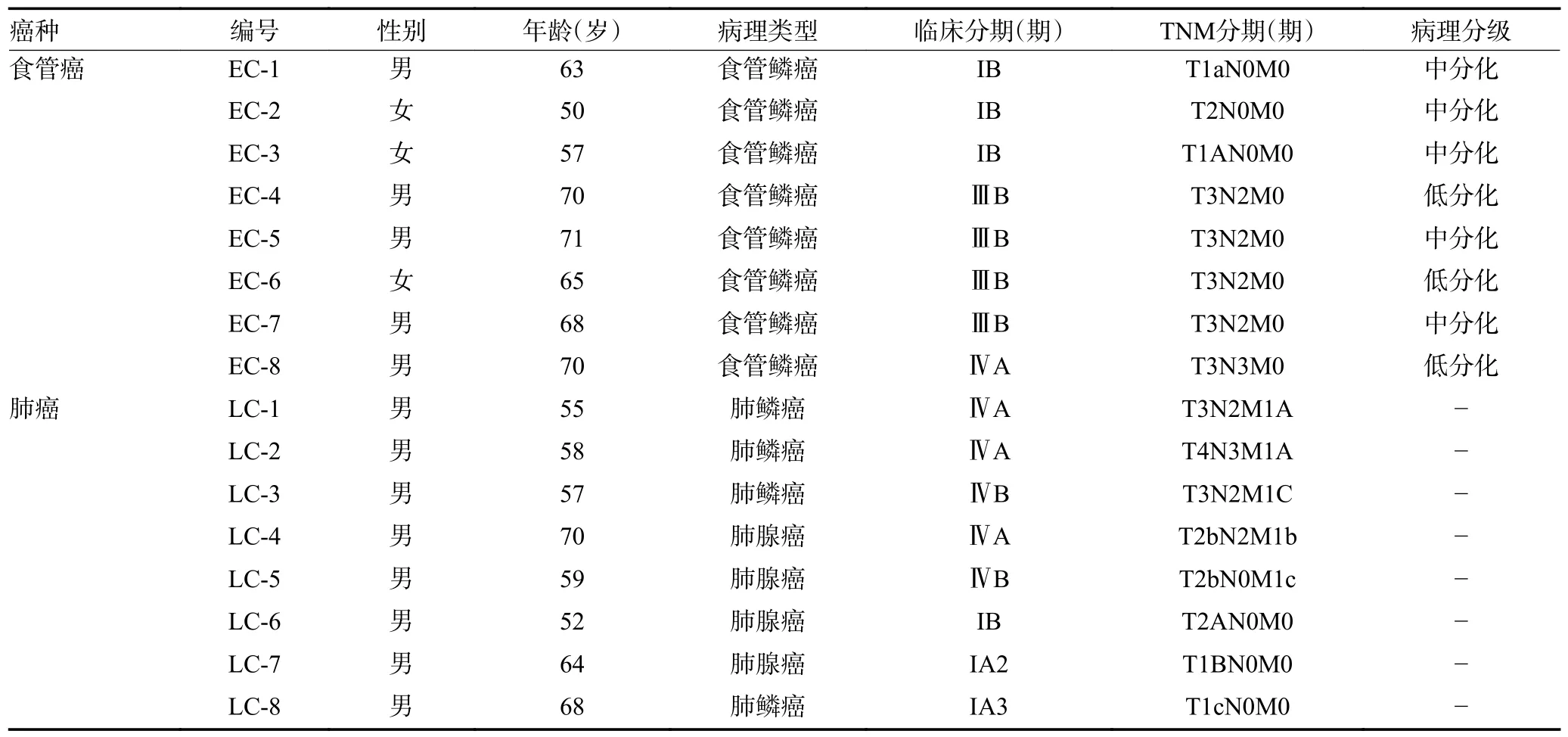
表1 16 例肿瘤患者临床资料
主要试剂:Trizol(购自美国Ambion 公司,货号15596026),QIAGE 一步RT-PCR 试剂盒(购自美国QIAGEN 公司,货号210212),Golden Taq DNA 聚合酶(购自上海Toneker Biotech 公司,货号TK10002),DNA 片段纯化试剂盒(购自无锡BioMagbeads 公司,货号BMSX),IonPlus Fragment Library Kit(购自美国Thermal-Fisher 公司,货号4471252)、Ion Xpress Barcode Adaptors 1-16Kit(购自美国Thermal-Fisher 公司,货号4471250)、AgencourtAMPure XP(购自美国Thermal-Fisher 公司,货号A63881),Ion 520/530 ExTChef-4rxns&4Init NEW-For600bp(购自美国Thermal-Fisher 公司,货号A30670),Ion 530 Chip Kit(购自美国Thermal-Fisher 公司,货号A27764 )。
1.2 方法
1.2.1 标本收集 外周血标本:使用EDTA 抗凝管静脉采集外周血5~15 mL,采血后4 h 内4℃分离外周血淋巴细胞,加入Trizol 1 mL 及时放至−80℃临时保存;肿瘤组织:术中留取肿瘤标本约1 cm3,4℃加入Trizol 1 mL 及时−80℃临时保存。标本保存时间保证样品及时有效的检测。本研究得到郑州大学第一附属医院科研项目伦理审查委员会批准,获得研究对象或其家属知情同意。
1.2.2 RNA 提取 将加入1 mL Trizol 的细胞或组织裂解液于冰上融解,加入500 μL 氯仿,上下颠倒摇匀,静置 5 min 后,12 000 rpm,4℃,离心15 min。将透明水相层小心转移到1 个新的1.5 mL 离心管,与等体积异丙醇混合,冰上静置10 min 后,12 000 rpm,4℃,离心10 min。弃上清,用1 mL 预冷75%乙醇清洗(用无水乙醇及DEPC 水配制)清洗2 次,12 000 rpm,4℃,离心5 min。吸干乙醇,室温下风干5 min。将RNA 溶于30 μL DEPC 水中,−80℃保存。
1.2.3 逆转录聚合酶链反应 扩增TCRβ 基因以提取的RNA 作为模板,用QIAGE 一步逆转录聚合酶链反应(RT-PCR)试剂盒进行TCRβ 基因的第一轮PCR扩增。RT-PCR含有:1 μg RNA模板,TRTmix 引物和Vβmix引物各0.5 μM,0.4 μM 的dNTP,1 μL OneStep RT-PCR酶混合物,1×OneStep RTPCR 缓冲液和5 单位RNA 酶抑制剂于25 μL 的体积中。TRTmix 引物是基于功能性人类TRBC 等位基因设计的4 个引物的1∶1 混合物(表2),而Vβmix引物是基于功能性人类TRBV 等位基因设计的36 个引物的1∶1 混合物(表3)。RT-PCR 条件:逆转录,50℃,30 min;PCR 激活,95℃,15 min,然后20 个反应周期,95℃,30 s;58℃,30 s;72℃,30 s。

表3 Vβmix 引物序列

表3 Vβmix 引物序列(续表3)
1.2.4 TCRβ 基因的PCR 扩增 以第1 轮RT-PCR产物为模板,对TCRβ 基因进行第2 轮PCR 扩增。PCR 体系含有:7.5 μL 第1 轮RT-PCR 产物,0.5 μM的 hTCRCbBCX 引物和Vβmix 引物,0.4 μM 的dNTP,1×Gold Taq PCR 缓冲液,3 μL Golden Taq DNA 聚合酶以及2 mM 的MgCl2在50 μL 的体积中。Vβmix引物是用于RT-PCR 反应的相同混合物,而hTCRCb-BCx 引物含有barcodes(表4,大写碱基对表示barcodes)。PCR 条件:活化,95℃,10 min,20 个反应周期,95℃,30 s;58℃,30 s;72℃,30 s。PCR 产物经DNA 片段纯化试剂盒纯化。

表4 hTCRCbBCx 引物序列
1.2.5 TCR 测序 根据说明书,使用Thermal-Fisher Ion Plus Fragment Library Kit、Ion Xpress Barcode Adaptors 1-16Kit、Agencourt AMPure XP 制备测序文库。使用 Ion 520/530 ExT-Chef-4rxns&4Init NEW-For600 bp 在Thermal-Fisher Ion Chef 系统上进行自动模板制备和芯片加载。然后,使用Ion 530 Chip Kit 在Thermal-Fisher Ion S5 系统上进行 TCRβ 可变区测序。由成都益安博生物技术公司进行测序。
1.2.6 TCR 测序数据分析 测序结果根据barcodes导出至每个样品分离的FASTA 文件中。使用默认参数通过IgBLAST 程序分析Fasta 文件,确定每个TCRβ 序列使用的种系Vβ、Jβ 基因、CDR3 区域、CDR3 氨基酸序列。其V-D-J 连接产生具有非空CDR3 区域的TCRβ 肽的生产性翻译的TCRβ 序列被定义为“功能性”。为了进行比较研究,从每个样本中随机选择30 000 个功能性TCRβ 序列。
外周血TCR 的多样性由D50值确定,并以此评估受试者的免疫力健康水平[10-11]。根据测得的TCR 可变区序列信息,将所有功能性基因可变区CDR3 序列总数记为N,不同克隆的CDR3 类型记为C,每一种克隆的拷贝数即为N1、N2……NC,并且按照从多至少排序(N1≥N2≥……NC-1≥NC),拷贝数和占CDR3 序列总数50% 的克隆类型数记为H,H 与C 的比值为D50;D50的数学公式定义:当(N1+N2+…+NH-1)≤0.5×N 且(N1+N2+…+NH)≥0.5×N,D50=H/C。
外周血TCR CDR3 序列最大克隆频率定义为占CDR3 序列总数的最多拷贝数的克隆类型的序列总数的百分比,其数学表达式为:CDR3 拷贝数最多克隆类型的序列总数/CDR3 序列的总数。
1.3 统计学分析
采用GraphPad Prism 8.0 和SPSS 19.0 软件用于统计学分析和图表构建。定量数据表述为。通过Pearson 相关性检验评估两个连续变量之间的关联性。影响因素分析应用多因素方差分析,两样本均数比较采用t检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 健康人与肿瘤患者外周血TCR 多样性比较
通过多因素方差分析,评估性别、年龄以及是否为肿瘤对外周血TCR CDR3 序列D50值的主效应。结果显示,修正模型的显著性数值P<0.05,表明主体间效应具有显著性。由性别、年龄以及是否为肿瘤的显著性数值提示,肿瘤对D50值的主效应显著(P<0.05),性别、年龄对D50无显著性影响(表5)。排除年龄、性别的干扰因素,比较健康人与食管癌、肺癌患者的外周血TCR 序列的D50值,结果表明,食管癌(0.031±0.028,P<0.000 1,图1A)及肺癌患者(0.077±0.034,P=0.005 3,图1B)的D50明显低于健康人(0.145±0.057)的D50值。D50值的结果变化同时表明,相比于健康人,食管癌和肺癌患者的总体免疫力较差。TCR CDR3 Vβ 和Jβ 基因的三维柱状图(图1C)显示,相比于健康人,食管癌与肺癌患者Vβ 和Jβ 基因组合使用减少,存在明显的单一性。上述数据表明,肿瘤患者外周血TCR 多样性减少,免疫水平降低。
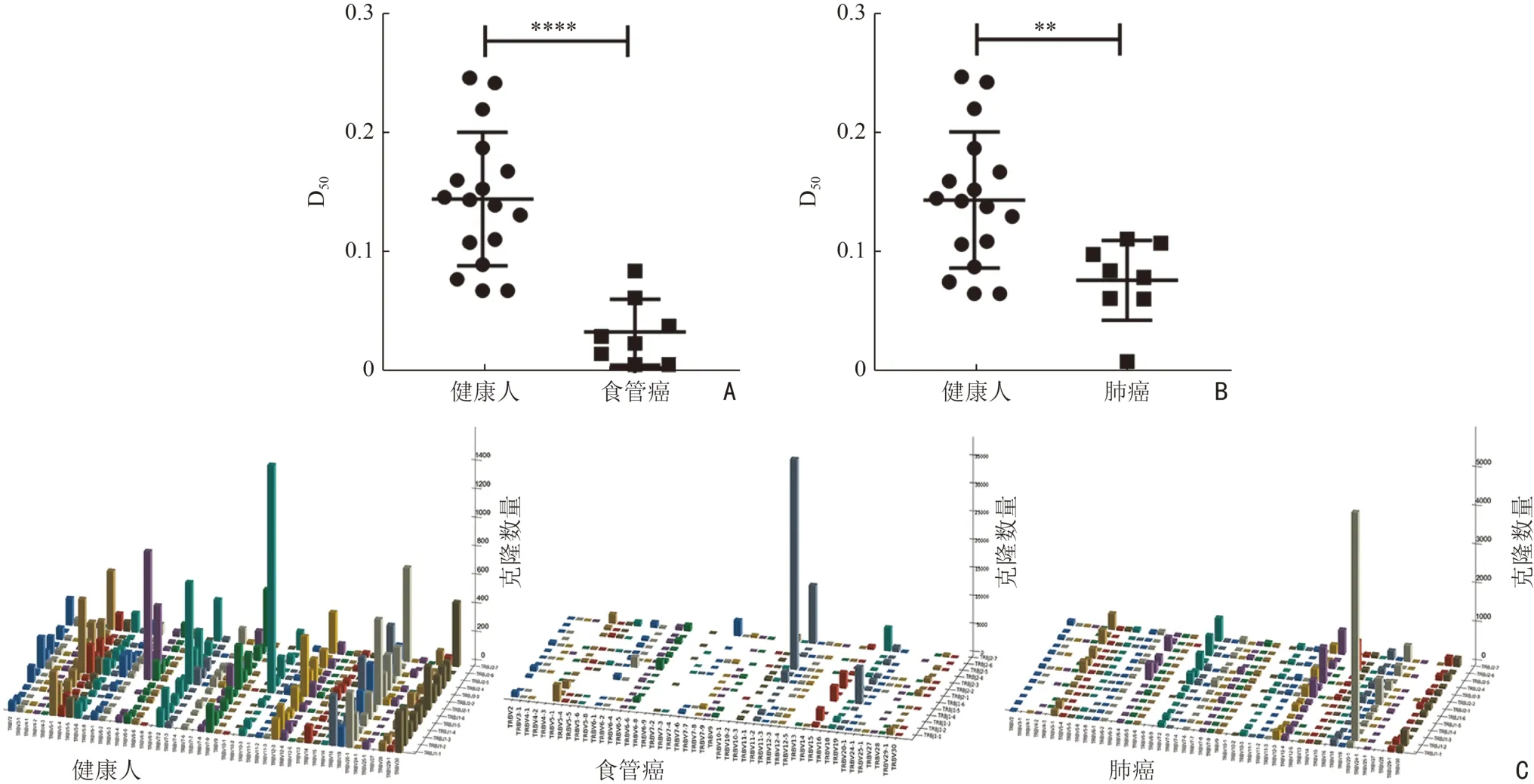
图1 食管癌、肺癌患者以及健康人外周血TCR 多样性分析
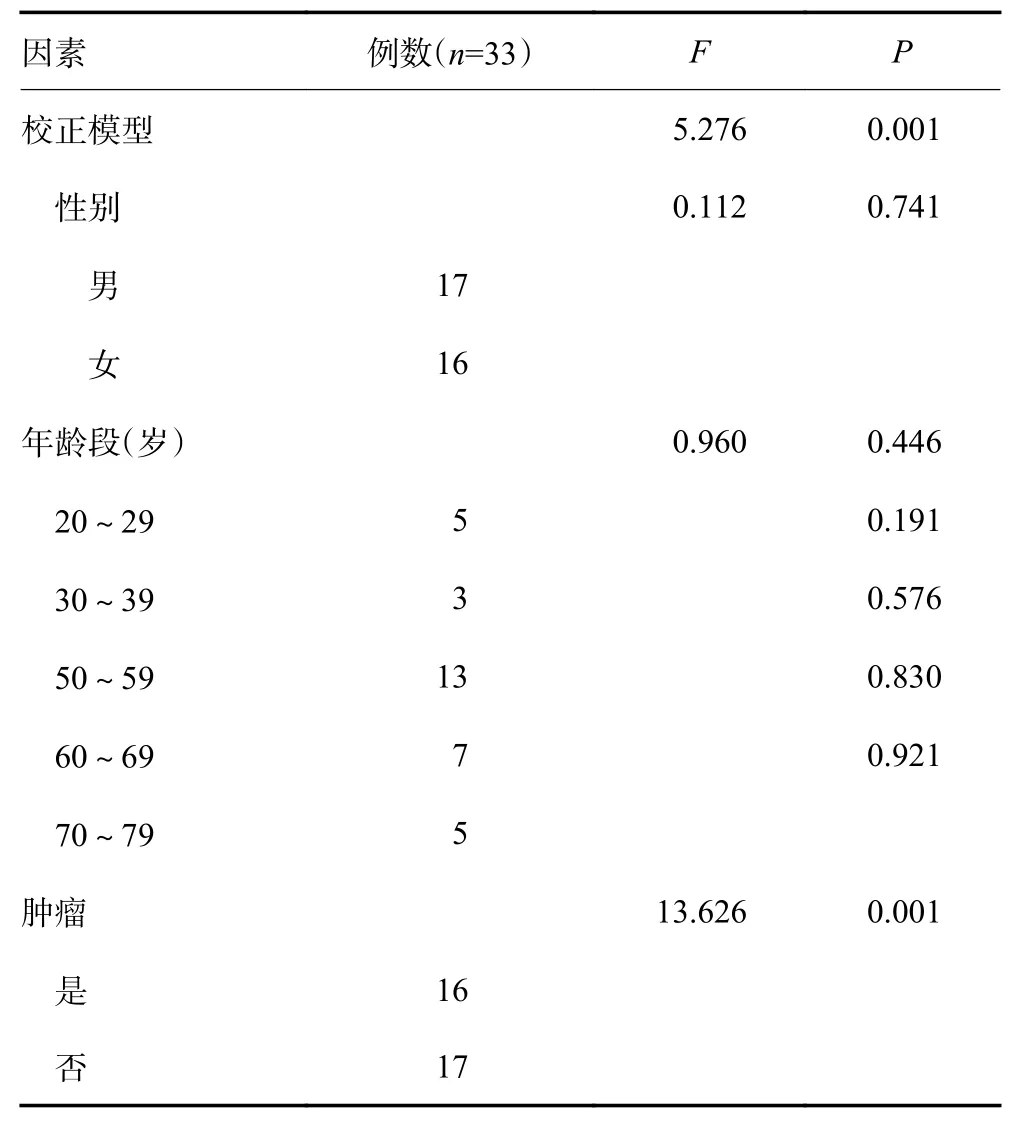
表5 影响外周血TCR CDR3 序列D50 值的多因素方差分析
2.2 健康人与肿瘤患者外周血中TCR CDR3 序列克隆特征
通过比较健康人与肿瘤患者外周血TCR CDR3序列最大克隆频率,发现健康人的最大克隆型频率(4.070±2.341)%明显低于食管癌[(10.640±7.640)%,P=0.003 1]、肺癌[(8.334±5.575)%,P=0.011 9]患者(图2A)。同时,TCR 多克隆比例分布图也显示,相比于健康人TCR 克隆均匀分布,食管癌、肺癌患者单个或多个TCR 克隆占比明显增高(图2B),表明肿瘤患者体内异常T 细胞克隆增生。此外,TCR 序列的D50值与最大显性克隆出现的频率呈负相关(图2C),表明TCR 谱系多样性的减少可以通过高度扩增的克隆出现进行反映。同时,在肿瘤抗原的刺激下,不同个体的最大CDR3 序列不同,不同肿瘤类型也各不相同(表6)。
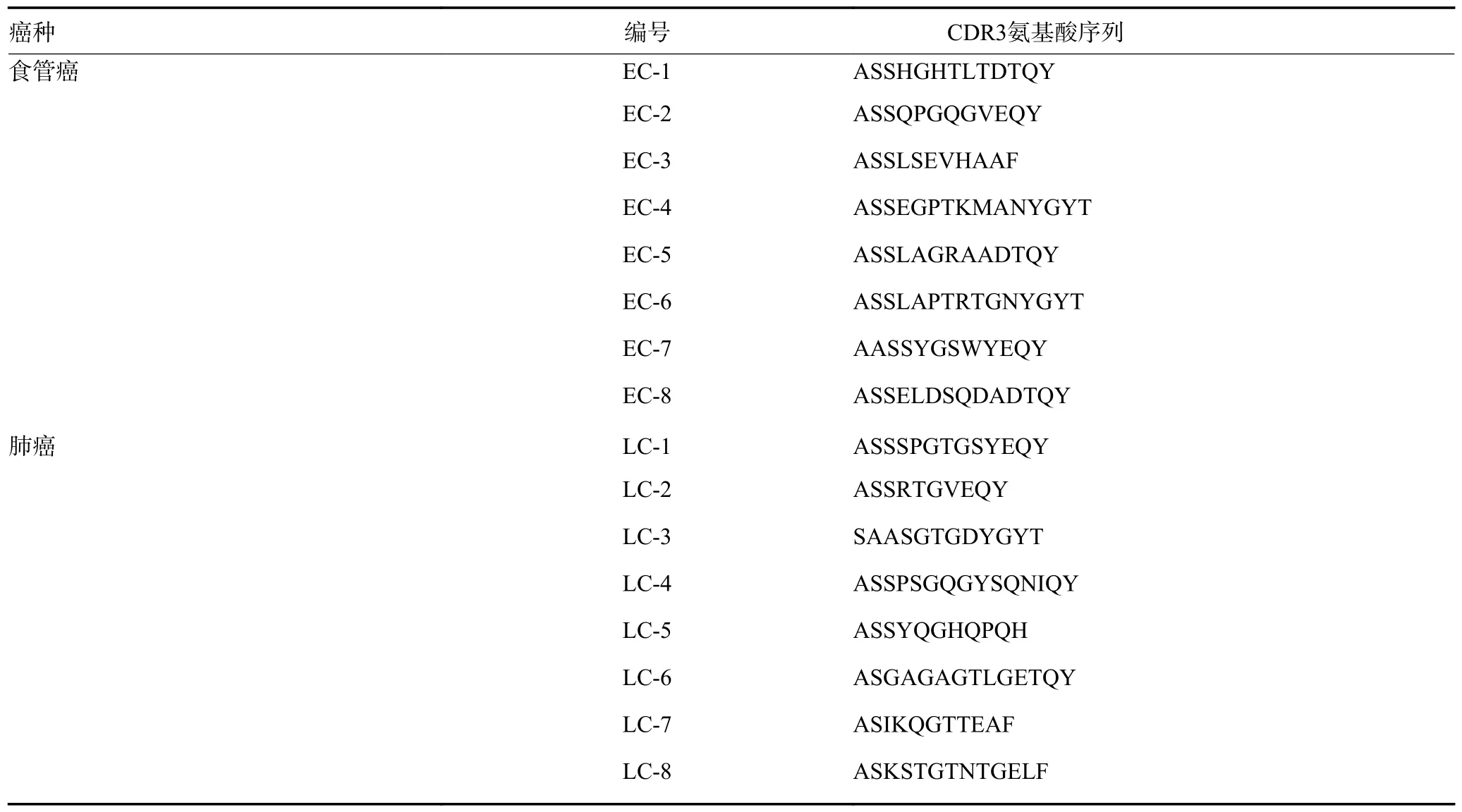
表6 食管癌、肺癌患者外周血TCRCDR3 序列中最大克隆频率的氨基酸序列
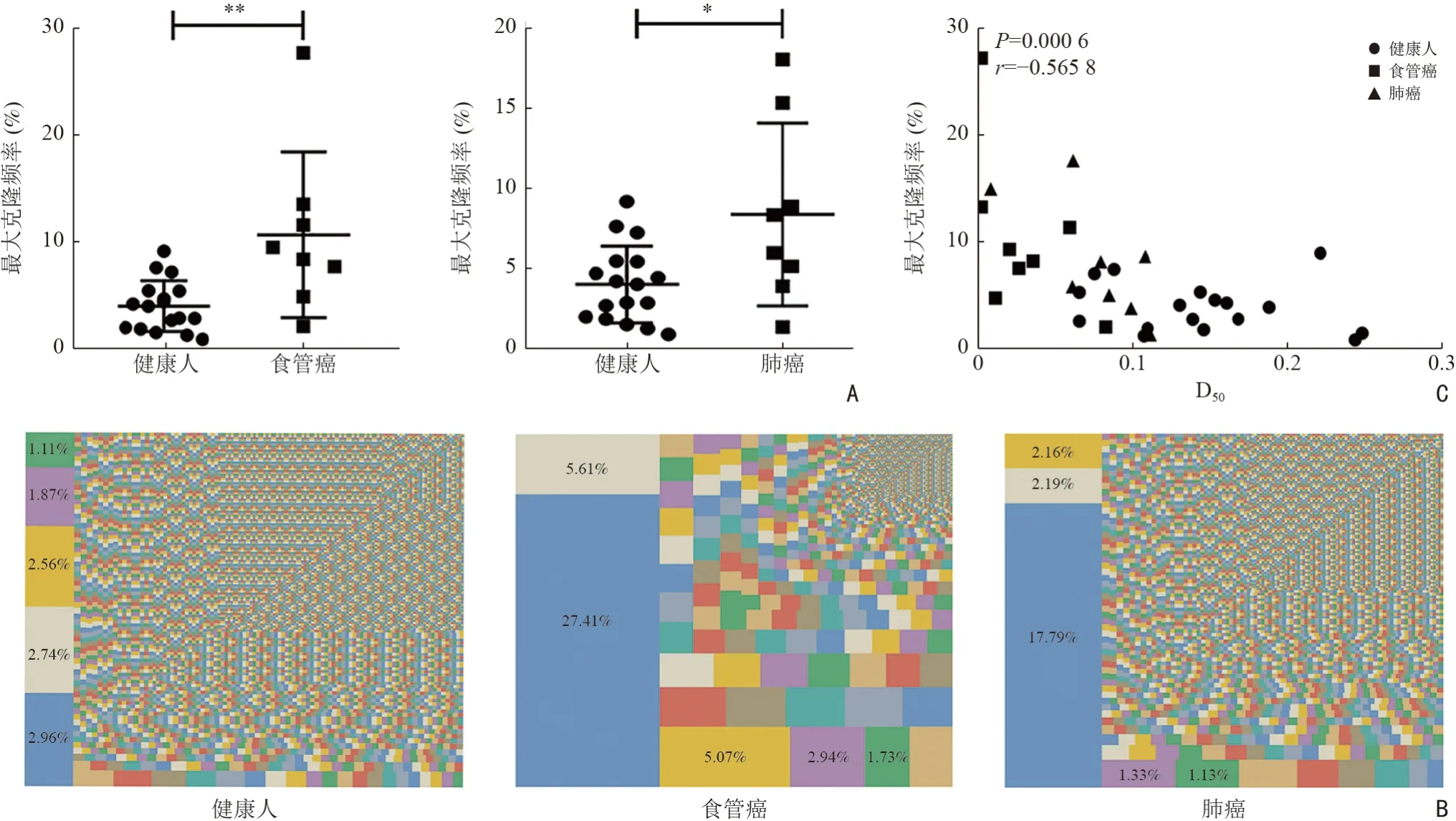
图2 食管癌、肺癌患者与健康人外周血TCR CDR3 克隆性分布
2.3 食管癌患者外周血TCR 多样性与临床特征的关系
进一步分析食管癌患者的临床分期、病理分化程度对外周血TCR 多样性的影响,结果显示:晚期食管癌患者外周血TCR 的CDR3 独特的氨基酸序列数量(7 812±3 836,P=0.015,图3A)及D50值(0.015±0.014,P=0.028 5,图3B)明显低于早期食管癌患者(21 454±7 896;0.057±0.028),表明随着肿瘤进展,外周血TCR多样性降低。然而,TCR 多样性在不同分化程度[(0.020±0.017)vs.(0.037±0.034),P=0.454] 之间无显著性差异(图3C)。
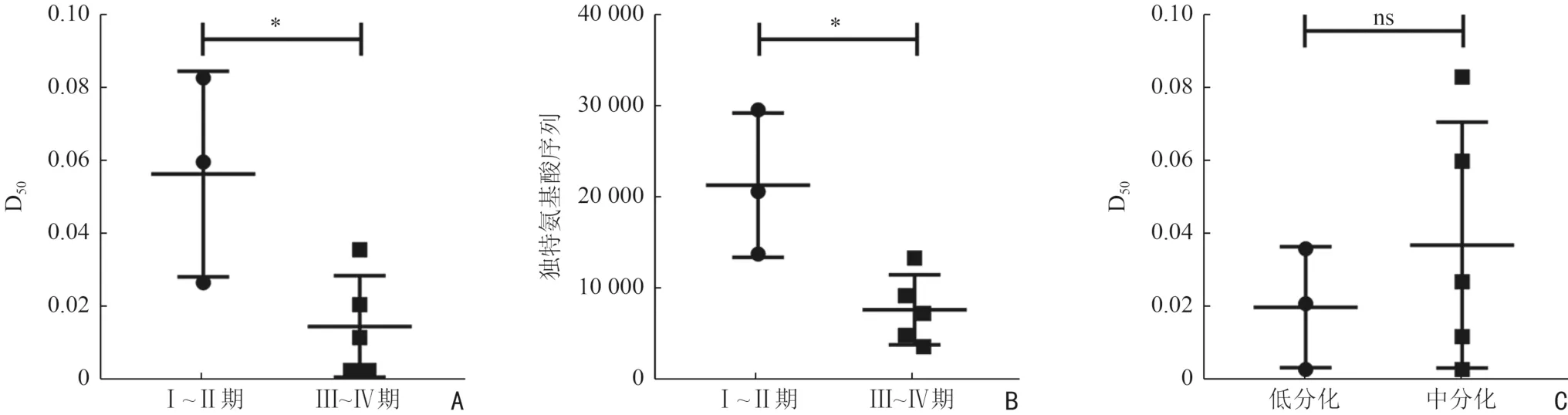
图3 食管癌患者外周血TCR 多样性分析
2.4 TCR CDR3 序列TRBV、TRBJ 基因在食管癌中的频度分布
统计8 例食管癌患者外周血TCR CDR3 序列TRBV 和TRBJ 基因的拷贝数,发现食管癌患者外周血中共45 个TRBV 基因和13 个TRBJ 基因,可产生585个基因重组,其 中TRBV2、TRBV11-2 和TRBV11-3 在TRBV 谱系中被大量使用(图4A)。同时,TRBJ 基因之间也存在较大差异,相比于TRBJ1-1、TRBJ2-1、TRBJ2-3、TRBJ2-7 基因的高表达,TRBJ1-3、TRBJ1-4、TRBJ1-6、TRBJ2-2、TRBJ2-4、TRBJ2-6 表达水平明显下降(图4B)。早期、晚期食管癌患者外周血TCR CDR3 TRB 基因的使用情况比较分析,发现晚期食管癌患者中Vβ 和Jβ 基因组合使用减少,存在明显的单一性(图4C)。
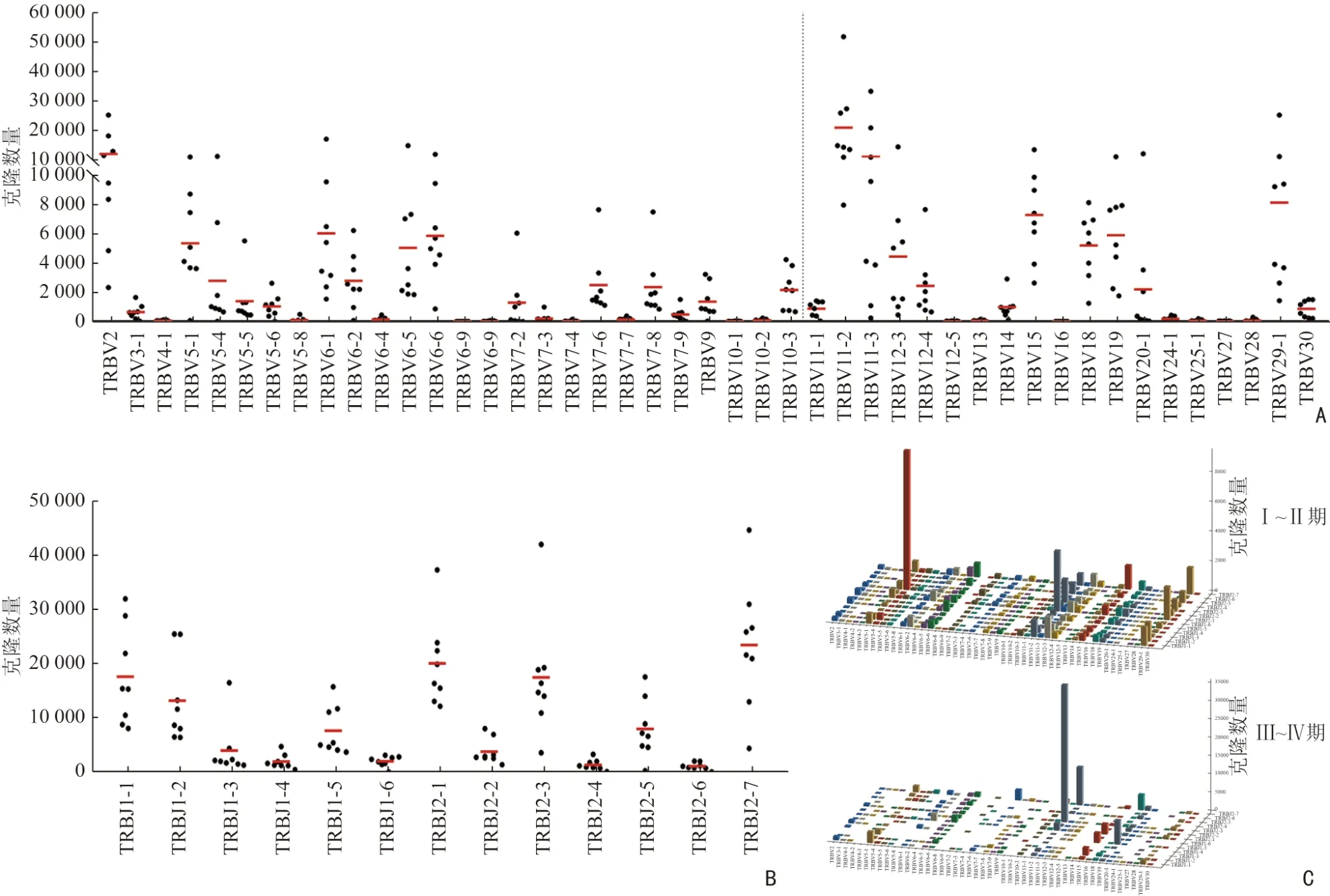
图4 TRBV 和TRBJ 在8 例食管癌患者中的使用频率
2.5 早期、晚期食管癌患者外周血TCR CDR3 克隆特征
对早期、晚期食管癌患者外周血TCR CDR3 AA长度峰值以及克隆性进行差异分析,CDR3 氨基酸序列长度峰值在不同临床分期之间无显著性差异(P=0.725,图5A)。但是,相比于早期食管癌患者,晚期食管癌TCRCDR3 序列单个或多个TCR 克隆占比明显高于早期食管癌(图5B);最大克隆频率在晚期食管癌患者中也较早期有升高趋势[(12.74±8.75)%vs.(7.15±4.69)%,P=0.355],但差异无统计学意义(图5C)。除此之外,晚期食管癌患者外周血TCR CDR3 序列中克隆数大于1 000 的比例(图5D)以及前100 位总克隆频率[(30.07±8.56)%vs.(63.69±23.52)%,P=0.059]均较早期食管癌明显升高,但差异无统计学意义(图5E)。提示随着肿瘤进展,TCR 的均匀性降低、异常克隆增加。
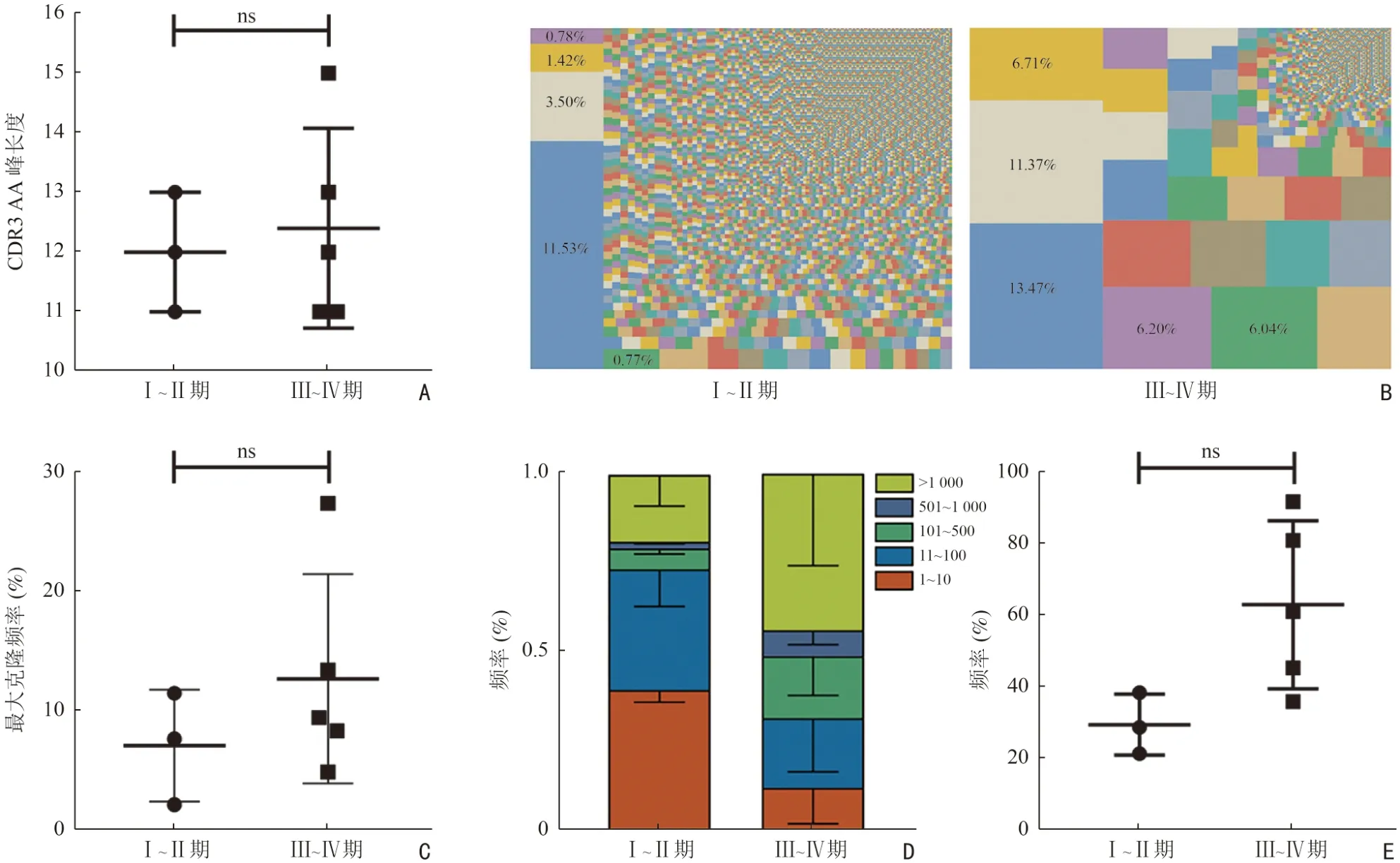
图5 不同临床分期的食管癌患者外周血TCR CDR3 长度分析及克隆性分布
2.6 早期、晚期肺癌患者外周血TCR CDR3 多样性及克隆分析
进一步对8 例肺癌患者外周血TCR 测序结果进行分析。在早期肺癌患者中,TCR 可变区序列的D50值明显高于晚期肺癌患者[(0.106±0.007)vs.(0.059±0.030),P=0.041 7(图6A)];同时,在晚期肺癌患者中TCR CDR3 的TRBV 和TRBJ 基因组合使用频率减少(图6B)。以上结果表明,随着肿瘤进展,肺癌患者TCR 的多样性降低,免疫力下降。除此之外,晚期肺癌患者外周血TCR CDR3 序列中最大克隆比例[(4.753±3.734)%vs.(10.48±5.659)%,P=0.174 9]、前10 位总克隆频率[(13.27±6.775)%vs.(24.44±9.077)%,P=0.117 6]均较早期患者有升高趋势,但差异无统计学意义(图6C,6D);且晚期肺癌患者外周血TCR CDR3序列单个或多个TCR 克隆占比亦明显升高(图6E)。以上结果均与食管癌患者结果一致。
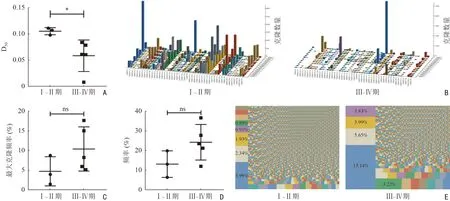
图6 早期、晚期肺癌患者外周血TCR 多样性及CDR3 序列的克隆特征
3 讨论
在T 细胞发育过程中,TCR 的CDR3 经历基因重组和不同基因片段的连接,产生大量的T 细胞克隆,每个克隆均有一个独特的TCR 赋予抗原特异性[12]。TCR 对外来抗原的效应反应中起着重要作用,TCR 的多样性是建立正常免疫功能的基础。
正常个体在无抗原刺激的情况下,TCR 基因重排是随机的,T 细胞呈多家族、多克隆性特点;在肿瘤抗原的刺激下,机体的T 细胞会产生克隆增殖。已有研究报道TCR 多样性指数D50可以作为一种简单的方法评估不同人群免疫水平或者追踪同一人群免疫状态的变化[11]。基于此研究,本研究通过比较健康人与肿瘤患者以及肿瘤患者之间外周血的TCR 谱特点,结果显示:1)在食管癌和肺癌患者中,外周血TCR 多样性降低、克隆性增高;且发现在 TCR 克隆性低的样本中,多样性升高,两者呈负相关关系;2)在食管癌和肺癌患者中,早期肿瘤患者外周血TCR 的多样性明显高于晚期患者,且出现明显异常克隆增生。综上所述,TCR 不仅可以作为一种潜在的免疫监测指标,还为肿瘤的诊断提供了潜在的生物标志物。
本项研究同时比较了同1 例食管癌患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)与肿瘤浸润淋巴细胞(tumor-infiltrated lymphocyte,TIL)的TCR 测序结果,初步探究了肿瘤微环境中T细胞与外周血循环T 细胞之间的TCR 差异。结果表明,TIL 的TCR CDR3 中独特的氨基酸序列数量、D50值明显低于PBMC,及TIL 的CDR3 Vβ 和Jβ 基因使用明显减少;相比于PBMC,TIL 中TCR CDR3序列单个或多个TCR 克隆所占比、最大克隆比例以及前100 位总克隆频率均明显升高。上述结果初步提示,外周血T 细胞的TCR 多样性高于肿瘤微环境中T 细胞,克隆性增殖T 细胞较少,推测肿瘤浸润淋巴细胞经过肿瘤相关抗原刺激呈现明显的优势扩增。在肿瘤微环境中T 细胞接受肿瘤抗原的刺激经历克隆性增殖,TCR 呈现明显的优势扩增、定向趋化;而食管癌患者外周血和肿瘤组织TCR 的差异变化,可能是肿瘤内扩增的T 细胞克隆进入血液循环后被更多样化和丰富的外周血克隆库稀释所致。因仅有1 例患者的结果对比分析,未来还需要进一步扩充样本量说明问题。
除此之外,TCR 谱分析也可以为肿瘤的治疗策略、治疗疗效以及预后提供潜在的指导意义。肿瘤的免疫疗法是利用内源性免疫系统,或将免疫细胞过继转移到宿主体内,以消除肿瘤的治疗方式[3]。Teng 等[13]研究确定了在肿瘤微环境中,同一肿瘤类型存在共享TCR CDR3 克隆型,然而不同肿瘤类型共享克隆型不同。共享TCRs 不仅可以作为肿瘤特异性生物标志物,而且可用于指导开发针对性强且更安全的肿瘤疫苗,提供潜在的治疗策略。具有寡克隆性T 细胞浸润的黑色素瘤对PD-1 单抗治疗疗效更好,可能是因为大部分的T 细胞克隆是肿瘤特异性的,并且易于用PD-1 单抗恢复活力[14]。有研究报道晚期黑色素瘤中,抗CTLA-4 治疗与TCR 谱系多样性增加相关,而抗PD-1/PD-L1 治疗与寡克隆T 细胞增殖相关[15]。Cui 等[16]报道在宫颈癌中,前哨淋巴结TCR 谱系中克隆型与预后不良有关,克隆型越少,预后越差。
综上所述,本研究阐明了食管癌和肺癌肿瘤中TCR 谱多样性以及克隆特点,提供了肿瘤诊断、分期的潜在生物标志物。本研究为小样本量研究,存在一定的局限性,有待进一步以大样本量的研究分析;健康人年龄为50(19~70)岁,肿瘤患者年龄为63.5(50.0~70.0)岁,两组年龄基线差异大;尽管多因素方差分析结果提示肿瘤是影响TCR 多样性主因素,但仍需加大样本量消除基线差异,进一步研究证实肿瘤与健康人TCR 谱差异。
