甲状腺细针穿刺液基薄层细胞学检查联合p21、Cyclin D1检测在甲状腺乳头状癌术前诊断中的意义
2023-02-04王晨晨沈铭红陈汝蕾张智弘吕京澴
王晨晨,张 俊,沈铭红,曹 丹,陈汝蕾,张智弘,吕京澴
甲状腺癌的发病率逐年增加,其中以甲状腺乳头状癌(papillary thyroid carcinoma, PTC)最为常见,发病年龄趋向年轻化[1]。目前超声引导下细针穿刺活检(ultrasound-guided fine needle aspiration biopsy, US-FNAB)联合液基薄层细胞学(thinprep cytologic test, TCT)技术常用于术前评估[2-3]。虽然Bethesda分类报告系统对甲状腺细胞病理学诊断进行了规范,但仍有10.00%~40.00%的结节无法明确诊断[4],其中25.00%~57.14%的甲状腺结节术后病理诊断为PTC[5-6]。因此,术前穿刺诊断的敏感性亟需提高。BRAF V600E是PTC中最常见的突变基因,在西方国家(美国和欧洲)突变率为35.00%~60.00%[7-8],亚洲国家的突变率相对较高,其中中国为71.20%[9]。Fanis等[10]行大样本量Meta分析显示BRAF V600E独立诊断PTC的敏感性并不高(69.00%),US-FNAB和BRAF V600E联合诊断的敏感性更低(52.00%),故将BRAF V600E作为单一诊断指标的可行性尚未确定,且对检测手段有实验室平台要求,并需要项目质量控制以确保检测结果的准确性,降低假阴性率和假阳性率。
Cyclin D1属于周期素(Cyclin)家族,p21属于细胞周期蛋白依赖性激酶的抑制因子(cyclin-dependent kinase inhibitors, CDKI)家族,共同调控细胞周期从G1期进入S期进程。文献报道Cyclin D1表达与PTC分化程度、侵袭性生物学行为有关[11],有望作为PTC的诊断标志物[12]。p21在PTC中的表达尚未见相关报道,亦无两者的联合性研究。本研究旨在探讨p21、Cyclin D1在甲状腺细针穿刺细胞标本中的表达及其临床病理学意义。
1 材料与方法
1.1 材料收集2021年5月~2022年11月南京医科大学附属苏州医院行甲状腺US-FNAB患者118例,其中男性26例,女性92例,患者年龄23~78岁,平均(43.2±12.37)岁,TI-RADS 4类69例,5类49例;结节最大径0.30~4.00 cm,平均最大径(1.19±0.68) cm。
1.2 方法
1.2.1US-FNAB 采用SIEMENS OXANA3彩色超声诊断仪,选择9L4高频线阵探头,频率为4~9 MHz。经高分辨率超声检查评估和定位结节后,设计穿刺路径行US-FNAB,将穿刺物注入液基细胞保存液。
1.2.2TCT制片及结果判读 运用PrepStain全自动液基细胞制片机制备细胞病理学切片,行巴氏染色。采用Bethesda分类标准判读:Ⅰ类,标本无法诊断或不满意;Ⅱ类,良性病变;Ⅲ类,意义不明确的细胞非典型性病变或意义不明确的滤泡性病变;Ⅳ类,滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ类,可疑恶性肿瘤;Ⅵ类,恶性肿瘤。所有病例均由病理科高年资细胞学诊断医师审核阅片。
1.2.3免疫细胞化学及结果判读 使用TCT方法制片,采用罗氏全自动免疫组化仪进行免疫组化染色(EnVision法)。p21(货号GT204307)、Cyclin D1(货号GT205807)一抗购自上海基因科技公司,黄褐色为阳性,定位于细胞核。阳性判读标准:细胞核弥漫强着色或部分强着色;阴性判读标准:细胞核弱着色、无着色及非细胞核着色。所有病例均由病理科高年资细胞学诊断医师审核阅片。
1.2.4BRAF V600E基因检测 采用QIAamp DNA Micro Kit提取试剂盒提取穿刺针洗脱液中的DNA,运用人BRAF V600E基因突变检测试剂盒(厦门艾德生物公司,货号8.0120301X024B)进行荧光PCR。根据CT值判定结果,CT值≥30判定为阴性,CT值<30判定为阳性。
2 结果
2.1 临床特征本组118例甲状腺结节术后病理诊断:PTC 66例,良性结节52例,两者在TI-RADS分类、Bethesda分类及BRAF V600E基因检测结果差异均有统计学意义(P<0.05,表1)。

表1 TI-RADS分类、Bethesda分类和BRAF V600E基因检测结果[n(%)]
2.2 良性结节和PTC中p21、Cyclin D1蛋白的表达差异免疫细胞化学结果显示:PTC组中p21和Cyclin D1呈阳性,良性结节组中呈阴性(图1)。p21、Cyclin D1在PTC中表达上调,阳性率分别为86.36%(57/66)、93.94%(62/66),在良性结节中阳性率分别为1.96%(1/52)、5.77%(3/52)。PTC组p21、Cyclin D1的阳性率高于良性结节组,差异均有统计学意义(P<0.05,图2)。PTC组p21+/Cyclin D1+57例,p21+/Cyclin D1-0例,p21-/Cyclin D1+5例,p21-/Cyclin D1-4例,p21与Cyclin D1表达呈正相关(rs=0.639,P<0.05)。

图1 A.甲状腺乳头状癌液基细胞学巴氏染色,滤泡细胞呈团片状单层排列,轮廓不规则,核染色质毛玻璃样,可见核内包涵体和微小核仁;B、C.甲状腺乳头状癌组p21(B)和Cyclin D1(C)免疫细胞化学染色呈阳性,EnVision法;D.甲状腺乳头状癌组织学HE形态;E.甲状腺良性结节巴氏染色,滤泡细胞平铺排列,轻微核重叠和拥挤,染色质匀细,可见细小核仁;F、G.甲状腺良性结节组p21(F)和Cyclin D1(G)免疫细胞化学染色呈阴性,EnVision法;H.甲状腺滤泡性腺瘤组织学HE形态

图2 甲状腺乳头状癌和良性结节中p21(A)和Cyclin D1(B)的表达差异
2.3 p21、Cyclin D1蛋白表达与PTC临床病理特征的关系本组66例PTC中,p21、Cyclin D1表达与肿瘤大小相关,两者在肿瘤最大径≥1 cm者中表达较高(P<0.05);而与患者性别、年龄、瘤灶数量、淋巴结转移、TNM分期无关(P>0.05,表2)。
2.4 BRAF V600E野生型PTC中p21及Cyclin D1的表达本组66例PTC中,有9例US-FNAB检测BRAF V600E为野生型,其临床病理特征见表3,经组织切片复核显示8例BRAF V600E为野生型(图3),1例为突变型。其中8例p21、Cyclin D1呈阳性(图4),例9呈阴性,阳性率均为88.89%(8/9)。

图3 BRAF V600E野生型甲状腺乳头状癌FISH检测结果:PC.阳性参照,NC.阴性参照

图4 A.BRAF V600E野生型甲状腺乳头状癌液基细胞学巴氏染色;B、C. BRAF V600E野生型甲状腺乳头状癌p21(B)和Cyclin D1(C)免疫细胞化学染色呈阳性,EnVision法;D. BRAF V600E野生型甲状腺乳头状癌组织HE形态

表3 US-FNAB 9例BRAF V600E野生型甲状腺乳头状癌临床病理特征
2.5 US-FNAB、p21、Cyclin D1联合检测的诊断价值US-FNAB、p21和Cyclin D1联合诊断的敏感性、特异性、阳性预测值和阴性预测值均高于US-FNAB独立诊断,联合诊断的敏感性和阴性预测值高于BRAF V600E(表4)。US-FNAB、p21和Cyclin D1联合诊断的AUC大于US-FNAB独立诊断,差异有统计学意义(Z=2.304,P=0.021),并大于BRAF V600E独立检测(Z=0.702 1,P=0.482 6)及US-FNAB和p21(Z=0.417,P=0.677)或Cyclin D1(Z=0.458,P=0.647)联合检测,与US-FNAB联合BRAF V600E(Z=0.068 4,P=0.945)检测接近(图5)。

图5 US-FNAB、p21、Cyclin D1和BRAF V600E独立诊断及联合检测的ROC曲线
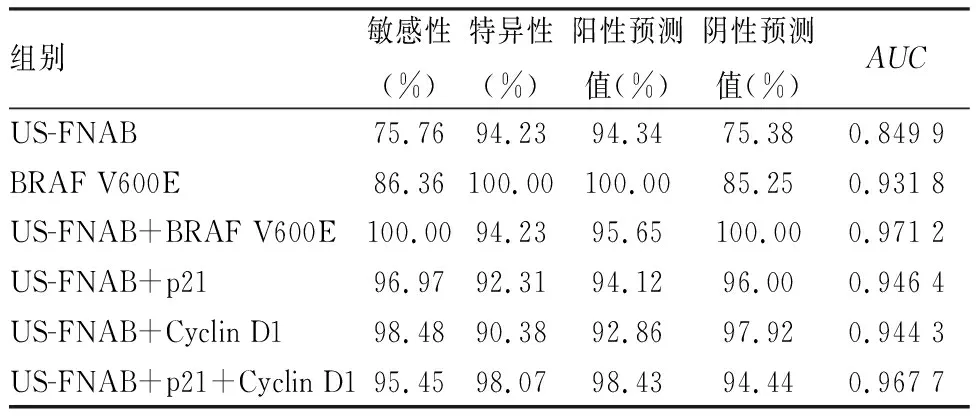
表4 US-FNAB、p21、Cyclin D1及联合检测的诊断效能比较
3 讨论
近年甲状腺癌的发病率急剧上升,其中PTC最为常见且瘤体微小时便已发生转移[1],因此早筛查、早治疗极为重要。甲状腺疾病的无创检查首选彩色多谱勒超声,US-FNAB可在术前判断甲状腺结节的性质,是诊疗决策的关键[2]。TCT具有细胞富集度高、背景清晰等优点。巴氏染色使细胞核细节分辨度提高,制片质量优于传统涂片[3]。本组对118例甲状腺结节进行超声检查,采用ACR-TIRADS报告系统评估风险性,运用US-FNAB联合TCT巴氏染色技术进行诊断。其中32.14%(36/112)的结节无法明确诊断,与以往文献报道(10%~40%)相符[4]。无法明确诊断的36例结节经术后病理诊断为PTC者占44.44%(16/36),亦与文献报道(25.00%~57.14%)一致[5-6]。如何提高诊断精度是亟需解决的重要问题。BRAF V600E基因是PTC最常见的基因突变,但临床研究数据显示其在实际应用中的敏感性偏低[10],且需借助分子病理学技术,对诊断平台要求较高,基层医院尚未开展;而采用免疫组化技术标记特定蛋白相对普及,且价格较低。
传统的PTC免疫标志物CK19、Galectin-3、HBME-1等均存在诊断局限性。CK19诊断PTC的特异性仅为32.86%[13],且因细胞学标本中缺乏正常组织参照,判读难度较组织学更大,诊断可靠性更低。Galectin-3在PTC中的阳性率为45.70%~80.00%[14-15],HBME-1为84.00%,且两者在甲状腺良性结节和乳头状增生病变中也有较高的阳性率,特异性较低[15]。
p21属于细胞周期蛋白依赖性激酶的抑制因子(CDKI)家族,其异常表达会对Cyclin、CDK及其激酶活性产生影响,致使细胞增殖与分化异常,最终导致肿瘤的发生[16]。研究表明p21在多种肿瘤的发生发展中起双重作用[17],在多种生存率较差的肿瘤(神经胶质瘤、前列腺癌、子宫颈癌等)中p21表达升高;而在其他肿瘤(乳腺、胃癌等)中,p21表达缺失与预后不良和总生存率降低有关[18]。p21潜在促进肿瘤发生和进展的功能包括但不限于肿瘤细胞从p21诱导的生长停滞中"逃脱"后,进行核内再复制和异常有丝分裂,再通过多种不同的机制抑制细胞凋亡,并刺激具有促有丝分裂和抗凋亡活性的分泌因子的转录。目前,p21在PTC中的表达及意义尚未见相关研究,而PTC瘤体微小便可发生转移,p21是否参与其中的肿瘤"逃逸"机制,有待进一步研究。Cyclin D1在多种肿瘤中过表达[19],2015年Lamba Saini等[12]首次提出将Cyclin D1作为PTC的候选标志物。本研究显示这两个指标在PTC中的表达显著高于良性结节,且其在PTC中的阳性率也明显高于CK19、Galectin-3和HBME-1等常用指标。同时,由于p21和Cyclin D1均为核蛋白,免疫组化判读也更为便捷、可靠。
本研究中,BRAF V600E基因检测独立诊断和与US-FNAB联合诊断PTC的敏感性高于以往文献报道[10],但仍有9例PTC的BRAF V600E为野生型,经组织切片复核BRAF V600E检测示8例为野生型,1例为突变型。这9例中p21和Cyclin D1的阳性率均为88.89%(8/9),极大地提高了BRAF V600E野生型PTC的检出率,有很好的临床诊断应用价值。由于US-FNAB的BRAF V600E检出率与肿瘤大小和穿刺手法有关,可能会出现假阴性情况,此时辅助应用p21、Cyclin D1检测,可弥补此不足。这提示p21和Cyclin D1有可能参与BRAF V600E野生型PTC的发生,其机制值得进一步探索。
进一步的联合诊断效能分析显示,US-FNAB、p21及Cyclin D1三者联合诊断的敏感性、阴性预测值高于US-FNAB、BRAF V600E、p21及Cyclin D1独立诊断,同时将特异性和阳性预测值控制在较高水平(>90.00%)。三者联合检测的四项诊断评价指标均优于Abu-Sinna等[15]研究的Galectin-3/HBME-1共表达。三者联合诊断的AUC高于US-FNAB和BRAF V600E独立诊断,与US-FNAB和BRAF V600E联合检测接近,但高于以往文献报道的US-FNAB和BRAF V600E联合检测(AUC=0.900)[19]。
综上,US-FNAB、p21、Cyclin D1三者联合检测进一步提高了PTC术前诊断的敏感性,有较高的实用性,尤其适用于无分子病理学平台的机构,且对于诊断BRAF V600E野生型PTC有较高的应用价值。
