环状RNA表达与肺腺癌生物学功能的关联性研究
2023-01-31张日婷赵弘卿王洵严玉兰
张日婷,赵弘卿,王洵,严玉兰
据2021年癌症统计数据,肺癌为40岁以上男性癌症患者和60岁以上女性癌症患者的主要死亡原因,病死人数超过乳腺癌、前列腺癌及大肠癌总和[1]。根据组织学类型和预后分类,非小细胞肺癌(NSCLC)约占所有肺癌类型的85%,进一步可细分为腺癌(44%)、鳞状细胞癌(23%)、大细胞癌(4%)及未分型的肺癌(29%),其中肺腺癌发病率呈逐年上升趋势,在NSCLC中发病率最高[2]。circRNA于1976年首次在RNA病毒中发现,由前体mRNA反向剪接循环产生,其3'和5'端相连形成共价闭环结构,无线性RNA 5'帽结构或3'聚腺苷酸尾巴,比线性RNA更稳定[3],有可能为多种疾病的生物标记物。研究[4]表明,circRNA通过多种机制调节生物学过程,如作为海绵竞争miRNA反应元件,调控相应靶基因表达、调节RNA Pol II转录及指导蛋白质合成。有证据[5]表明,许多物种的标本中存在大量circRNA,在多种疾病的病理生理过程中发挥着重要作用。circRNA的异常表达可能与肺腺癌的发病有关。
既往研究[6-7]表明,来源于RUNX家族转录因子1(RUNX1) 的hsa_circ_0002360在多种肿瘤标本中表达异常,如非小细胞肺癌、胃癌、舌鳞状细胞癌,可通过靶向结合miR-629-3p,抑制抗癌基因PDLIM4表达,进而促进胃癌细胞增殖和侵袭。抑制hsa_circ_0002360可改善NSCLC对紫杉醇的耐药性[8-9]。hsa_circ_0002360在肺腺癌中的生物学功能尚未完全阐明。与微阵列分析相比,高通量测序(RNA-seq)是一种可识别未知核苷酸序列的开放技术,为探究circRNA的细胞类型特异性、组织特异性及其生物学功能提供了新的线索。本研究通过高通量测序方式,筛选肺腺癌组织异常表达的circRNA,并采用qRT-PCR技术放大样本验证测序结果,构建circRNA/miRNA/mRNA(ceRNA)网络互作图分析部分circRNA与miRNA和mRNA的关系图,采用克隆实验、划痕实验及Tranwell侵袭实验分析circRNA对肺腺癌细胞增殖、迁移及侵袭能力的影响,为探索circRNA参与肺腺癌发病的机制提供参考。
1 资料和方法
1.1 一般资料 选取江苏大学附属人民医院胸外科接受部分或根治性手术的肺腺癌患者25例,其中男14例,女11例;平均年龄(67.0±4.1)岁;肿瘤分期:Ⅰ期5例,Ⅱ期6例,Ⅲ期8例,Ⅳ期6例。纳入标准:(1)经病理确诊为原发性肺腺癌;(2)术前未进行化疗、放疗及其他辅助治疗;(3)患者无高血压、糖尿病或心血管疾病等基础性疾病;(4)患者及其家属知晓本试验所有研究方案,并签署知情同意书。排除标准:(1)合并其他肿瘤的患者;(2)意识不清者;(3)临床信息不完善。术中均切取患者肺腺癌组织和癌旁正常组织冷冻备用,其中5对标本作为高通量测序,20对标本作为qRT-PCR试验。本项目经江苏大学附属人民医院医学伦理委员会批准。
1.2 方法
1.2.1 总RNA提取和质量控制(QC) 使用TRIzol试剂(Ambion Life Technologies公司,美国)提取标本总RNA。紫外分光光度仪NanoDrop 2000(Thermo Scientific公司,美国)检测总RNA的浓度及质量。合格标准:OD260值/OD280值为1.8~2.1。储存于-80 ℃冰箱备用。
1.2.2 circRNA高通量测序 选取1.2.1提取的5对总RNA标本,采用Epicenter Ribo-Zero rRNA试剂盒(Illumina公司,美国)和RNase R酶(Epicenter公司,美国)先后处理总RNA,去除核糖体和线性RNA。将处理后的RNA裂解成片段,准备cDNA合成和PCR扩增,并修饰末端和连接前体。采用TruSeq Stranded Total RNA HT/LT试剂盒(Illumina公司,美国)构建高通量测序(RNA-seq)文库,Agilent 2100 Bioanalyzer(Agilent 公司,美国)生物分析仪行质量控制和评估。从Illumina HiSeq X10测序仪中获取配对末端读数,Q30进行质量控制。在3'修剪后,使用Cutadapt软件(版本1.9.3)删除含N3序列的读数小于50 bp或低质量的reads。测序数据通过Bowtie2软件[10]与人类基因组(NCBI xl_ref_ Xenopus_laevis_v2)比对,并使用Find_circ软件(如CIRI)[11]识别circRNA。差异倍数fold change>2或<0.5,t检验P值<0.05表示表达存在差异。采用R软件limma包(R版本3.3.1)处理数据。测序程序和数据分析由OE生物技术公司执行(中国上海)。
1.2.3 qRT-PCR实验 选取1.2.1提取的剩余20对总RNA标本,采用qRT-PCR实验检测测序结果中异常表达倍数排名前10位(5个上调和5个下调)的10个circRNA。circRNA的特异性引物由Generay Biotech公司(捷瑞生物工程有限公司,中国上海)设计,引物序列见表1。采用HiScript II Q RT SuperMix试剂盒合成cDNA(诺唯赞生物科技股份有限公司,中国南京),以cDNA为模板于LightCycle®480 II实时PCR仪器(Roche,瑞士)上行实时PCR实验。PCR反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,40个循环。以GAPDH为内参,采用2-ΔΔCt法计算2组间差异circRNA。所有实验重复三次后分析数据。

表1 qRT-PCR circRNA引物
1.2.4 生物信息学分析 选取高通量测序中肺腺癌组织异常表达倍数排名前5位的5个上调circRNA,构建ceRNA网络。采用miRanda软件预测circRNA的靶向miRNA,TargetScan、RegRNA及miRTarBase软件预测miRNA与circRNA、mRNA间的靶向互作关系。Cytoscape软件绘制circRNA/miRNA/mRNA网络图。
1.2.5 细胞分组和转染 取对数生长期A549细胞(中国科学院上海生科院细胞中心,中国上海),接种于6孔板中,37 ℃细胞培养箱中培养,细胞贴壁生长融合至50%后,分为空白对照组(正常A549细胞,空白对照组)、阴性对照组(siRNA对照组)及实验组(转染si-hsa_circ_0002360的A549细胞,siRNA组),分别以LipoFiter脂质体转染试剂、si-NC试剂及si-circRNA试剂转染稀释、混合后加入人肺腺癌细胞系A549中[12],qRT-PCR检测阴性对照组和实验组细胞中hsa_circ_0002360表达水平。
1.2.6 克隆实验 取各组对数生长期细胞接种至6孔板中,37 ℃细胞培养箱中培养,每2~3 d换液1次,待再次干预,磷酸盐平衡生理盐水(PBS)清洗3次,每孔加入多聚甲醛1 mL,置于4 ℃冰箱内固定细胞30 min,PBS再清洗3次,每孔加入结晶紫1 mL,常温染色10 min,PBS清洗至背景干净,静置干燥。记录细胞克隆数,克隆形成率(%)=(克隆数/接种细胞总数)×100%。每组实验重复3次。
1.2.7 细胞划痕实验 取各组对数生长期细胞接种至6孔板中,37 ℃细胞培养箱中培养,待细胞单层贴壁达90%时,取无菌10 μL枪头沿直线每孔划2条线,PBS清洗3次,去除脱落细胞,加入无血清培养基,细胞培养箱中孵育48 h,分别于划痕后0、24 h用显微镜观察拍照,ImageJ软件分析迁移能力。
1.2.8 Transwell侵袭实验 采用铺有基质胶的Transwell小室测量细胞侵袭能力。小室下层加入含有10% FBS的培养基,将悬浮在不含FBS的RPMI-1640培养基中的各组细胞(5×104细胞/孔)接种到上层小室中,于37 ℃细胞培养箱中孵育24 h,棉签去除上层小室中细胞,4%多聚甲醛固定滤膜另侧细胞30 min, 0.1%结晶紫染色10 min。统计9个视野中计数细胞,并在显微镜下以400×放大倍数拍照。
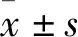
2 结果
2.1 高通量测序肺腺癌患者的一般资料 本研究选取5例肺腺癌患者的癌组织和癌旁正常组织进行高通量RNA测序,5例患者的临一般资料见表2。
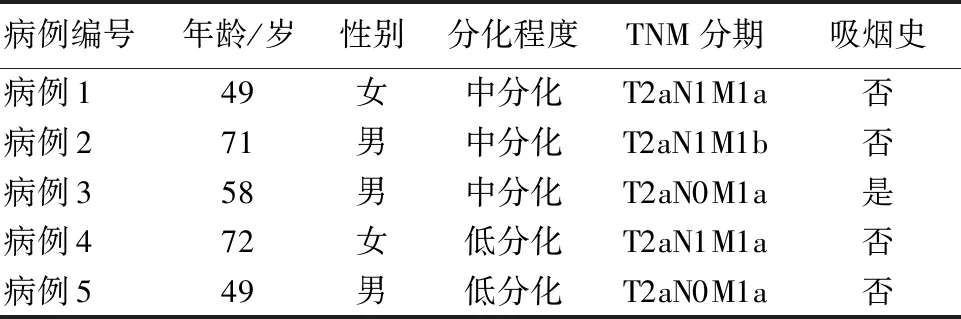
表2 高通量测序肺腺癌患者的一般资料
2.2 circRNA高通量测序结果 测序结果显示,肺腺癌组织中285个circRNA表达异常(差异倍数>2.0或<0.5,P值<0.05),其中102个circRNA表达上调,183个circRNA表达下调(图1A,1B)。

1A 肺腺癌组织(Y轴)与癌旁正常组织(X轴)间cricRNA表达差异的散点图 1B 2组间异常表达circRNA的火山图图1 高通量测序中2组标本异常表达circRNA 分布图
2.3 肺腺癌组织和癌旁正常组织间circRNA表达水平比较 采用qRT-PCR实验检测20对肺腺癌组织和癌旁正常组织中高通量测序结果差异表达倍数前10位的10个circRNA(5个上调和5个下调)表达水平。其中2个circRNA引物设计不成功,在qRT-PCR实验中移除。结果显示,肺腺癌组织中hsa_circ_0000264、hsa_circ_0039-161、hsa_circ_0002360及hsa_circ_000-6276表达高于癌旁正常组织, hsa_circ_0004062、hsa_circ_0004417、hsa_circ_0001320及hsa_circ_0004777表达低于癌旁正常组织,差异均有统计学意义(P<0.05)(图2A),且异常表达方向与高通量测序结果一致(图2B)。hsa_circ_0002360为表达差异倍数最高的circRNA。
2.4 生物信息学分析 选取高通量测序结果中肺腺癌组织表达上调差异倍数前5位的5个circRNA构建circRNA/miRNA/mRNA网络互作图。结果显示, 5个表达上调circRNA对应28个靶向miRNA, 82个相关mRNA。其中与hsa_circ_0002360结合的miRNA有has-mi-6769b-5p、has-mi-3147、has-mi-3620-5p、has-mi-296-3p、has-mi-1268b、has-mi-684、has-mi-6848-5p、has-mi-762及has-mi-4739,同其相关的mRNA有WARS、PHF19、HILPDA、EPB41、MSN、PRELP、PDE4A、PHLDA2、ARHGAP40、TET3、SYNGR2及PODXL。

2A 2组肺组织中circRNA表达水平(*P<0.05, **P<0.01) 2B RNA-Seq和qRT-PCR结果中10个circRNA中的差异倍数变化(FCs)图2 肺腺癌组织和癌旁正常组织间circRNA表达水平比较

5A hsa_circ_0002360沉默后3组A549细胞克隆增殖视野 5B 3组细胞增殖结果比较柱状图(P<0.05) 5C hsa_circ_0002360沉默后3组A549细胞迁移视野 5D 3组细胞迁移结果比较柱状图(P<0.05) 5E hsa_circ_0002360沉默后3组A549细胞侵袭视野 5F 3组细胞侵袭结果比较柱状图(P<0.05)图5 Hsa_circ_000236沉默后肺腺癌细胞增殖、迁移及侵袭能力变化图(*P<0.05)

图3 circRNA/miRNA/mRNA网络互作图
2.5 si-RNA干预对肺腺癌细胞株hsa_circ_0002360表达的影响 在A549细胞中,实验组hsa_circ_0002360表达低于阴性对照组,差异有统计学意义(P<0.05)。见图4。
2.6 hsa_circ_0002360沉默对A549细胞增殖、迁移及侵袭的影响 克隆实验表明,实验组肺腺癌细胞增殖率低于空白对照组和阴性对照组(图5A、5B)。划痕实验结果提示,实验组A549细胞迁移能力低于空白对照组和阴性对照组(图5C、5D)。Transwell侵袭实验表明,实验组细胞侵袭力低于空白对照组和阴性对照组(图5E、5F)。

图4 si-RNA干预后2组细胞株hsa_circ_000236表达水平柱状图(*P<0.05)
3 讨论
肺癌有效治疗方法仍为外科手术治疗,而临床上约65%的NSCLC患者确诊时已处于中晚期,错过最佳手术治疗时机。NSCLC 5年生存率不足15%,关于NSCLC发生和发展的机制仍不清楚[13]。随着新一代测序技术和生物信息学分析技术的发展和应用,circRNA在真核细胞中的调控功能开始受到关注。研究[14]表明,circRNA参与多种疾病发病过程,包括自身免疫性疾病、神经系统疾病及多种肿瘤,可能为新的生物标记物和潜在的治疗靶点。
circRNA可能与肿瘤发病、肿瘤细胞侵袭和转移及患者预后有关。circRNA BIRC6通过海绵吸附作用吸附miRNA-145,影响NSCLC细胞增殖[15];circRNA-CHD2竞争性结合miRNA-30e-3p,上调MDM2靶向癌基因,抑制肿瘤抑癌基因TP53表达,从而调控胰腺癌细胞的侵袭与转移[16];circ0072088通过调节miR-545-3p/STAT3轴,促进NSCLC细胞的增殖和转移[17]。然而,circRNA在肺腺癌发病中的作用机制尚不明确。
本研究通过高通量测序筛选人肺腺癌组织中异常表达circRNA谱。结果显示,肺腺癌组织中共有102个circRNA表达上调,183个表达下调。差异倍数排名前5位上调circRNA为hsa_circ_0000264、hsa_circ_0039161、hsa_circ_0002360、hsa_circ_0006276及hsa_circ_0009128,前5位下调circRNA为hsa_circ_0004062、hsa_circ_0004417、hsa_circ_0003176、hsa_circ_0001320及hsa_circ_0004777。放大样本后qRT-PCR实验结果与测序结果一致。其中hsa_circ_0002360差异倍数最高,猜测hsa_circ_0002360与肺腺癌发病相关。
circRNA可通过海绵吸附作用结合靶向miRNA或蛋白质,影响疾病进展[18]。如circPRKCI包含miR-545和miR-589结合位点,能够通过海绵吸附作用竞争性结合miR-545和miR-589,抑制其活性,从而影响肿瘤的发生和发展[19];circTP63通过ceRNA网络互作关系上调转录因子FoxM1表达,影响肺鳞癌进展[20];hsa_circRNA_104348通过调节miR-187-3p/RTKN2轴和激活Wnt/β-catenin通路促进肝癌进展[21]。本研究中ceRNA网络互作图分析显示,hsa_circ_0002360可与多个miRNA靶向结合,提示hsa_circ_0002360可能通过ceRNA网络互作关系抑制靶向miRNA,从而影响靶基因的表达,最终参与肺腺癌的发病机制。
肿瘤细胞增殖、侵袭及迁移影响肿瘤分化程度,且影响肿瘤患者预后,术后多需辅以放疗或化疗,降低复发风险。circRNA恶性肿瘤中以肿瘤抑制因子或致癌因子方式参与发病,如hsa_circ_0000467参与胃癌发病过程,表达水平与胃癌肿瘤分期存在相关性,沉默hsa_circ_0000467可抑制胃癌细胞的增殖、迁移及侵袭,被认为是潜在的胃癌预后标志物[22]。食道癌患者血浆癌基因SMAD7的circ-SMAD7表达下调,与TNM分期呈负相关,circ-SMAD7过表达可抑制食道癌细胞的迁移和增殖,而circ-SMAD7沉默后作用相反[23]。本研究中三代高通量测序结果和qRT-PCR结果均显示,肺腺癌组织hsa_circ_0002360差异倍数最高;hsa_circ_0002360体外功能实验表明,hsa_circ_0002360影响肺腺癌细胞增殖、迁移和侵袭。推测hsa_circ_0002360可作为致癌因子,增强肺腺癌细胞的恶性程度。
本研究存在不足之处,如qRT-PCR样本量偏少,测序结果验证说服力有限;未能对差异表达的每个circRNA进行大样本验证;网络互作图仅分析了差异倍数前5位的circRNA与miRNA/mRNA的靶向互作关系;基因沉默仅探索了hsa_circ_0002360对肿瘤细胞活性的影响,而其表达是否与肺腺癌的分化程度、预后、其他病理类型肺癌及肺部疾病发生发展的关联性未深入探讨。尽管如此,本研究结果可为circRNA参与肺腺癌发病机制的阐明提供了重要信息。
综上所述,circRNA在肺腺癌组织表达异常,其中hsa_circ_0002360表达差异倍数最高,hsa_circ_0002360参与肺腺癌细胞的增殖、侵袭及迁移过程可能为肺腺癌患者的潜在预后标志物和治疗靶点。
