TBSRTC分级AUS/FLUS的甲状腺癌临床病理分析
2023-01-15费丹丹代娇
费丹丹 代娇
甲状腺结节是由碘、放射线、促甲状腺激素慢性刺激、性激素相关等各种原因导致甲状腺细胞异常增生而引起的单发或多发的局部占位性病变[1],属于内分泌系统疾病。近年来超声体检中发现甲状腺结节检出率逐年上升,女性多见,大多数为良性结节,恶性结节占5%~12%[2],且大多无典型临床症状及体征,因此准确评估甲状腺结节性质[3],对减少过度手术尤为重要。超声引导下细针穿刺细胞学检查(US-FNAC)是术前检测结节性质的金标准。甲状腺细胞病理学Bethesda报告系统(TBSRTC)将甲状腺结节分为6类,其中BethesdaⅢ级是意义不明确的细胞非典型性或滤泡性病变(AUS/FLUS),属于无法明确性质的病变。TBSRTC推荐BethesdaⅢ级甲状腺结节应进行重复US-FNAB、检测分子标记或切除甲状腺腺叶,此类结节恶性风险为6%~18%[4]。但有研究报道其恶性风险变化较大约6%~42.1%[5],因此明确此类结节的恶性风险对后续临床治疗有重要意义。作者收集85例FNAC判读为AUS/FLUS而组织学证实为甲状腺癌的临床病理资料,回顾性分析并结合文献复习,旨在提高甲状腺穿刺结节的诊断、鉴别诊断能力。
1 资料与方法
1.1 临床资料 选取2016年9月至2021年9月中国科学院大学附属肿瘤医院行甲状腺细针穿刺活检的甲状腺结节,其中判读为AUS/FLUS患者1,262例。纳入标准:①所有患者细胞学均判读为AUS/FLUS;②经手术后病理确诊为甲状腺癌。排除标准:①甲状腺超声图像资料不全者;②TBSRTC结果或术后病理资料不全者。共纳入85例甲状腺癌患者(90枚结节)。收集患者一般资料、二维超声及组织学结果对照。
1.2 方法 使用高频彩色多普勒超声仪,探头频率:7~15 MHz。患者取仰卧位,充分暴露甲状腺区域,将探头置于甲状腺区域,行多切面检查。观察甲状腺结节的形态、大小、边界及血流情况。采用甲状腺影像报告和数据系统[6](TI-RADS)对目标结节进行评估,5项可疑恶性超声指标分别为:实性、低回声或极低回声、微小分叶或边缘不规则、微钙化以及纵横比>1。评估结果分为:TI-RADS 3类(无可疑超声表现)、4a类(1个可疑超声表现)、4b类(2个可疑超声表现)、4c类(3个或4个可疑超声表现)和5类(5个可疑超声表现)。于超声实时引导下对靶结节进行穿刺,每个结节穿刺2~3次。常规制作涂片2张涂片,固定后采用苏木素-伊红染色,镜检。根据 2017版TBSRTC 标准[7],将细胞学诊断结果分为6级:Ⅰ级(UD/UNS),标本无法诊断或不满意;Ⅱ级(B),良性病变;Ⅲ级(AUS/FLUS),意义不明确的细胞非典型病变或滤泡性病变;Ⅳ级(FN/SFN),滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ级(SFM),可疑恶性肿瘤;Ⅵ级(M),恶性肿瘤。BRAF基因检测:用艾德的试剂盒,PCR方式检测BRAF基因V600E位点,检测结果分为突变型(有扩增信号)与野生型(无扩增信号)。
2 结果
2.1 临床特点及超声特征 85例患者中女性多于男性。中位年龄47岁,35例患者年龄≤45岁,50例>45岁。90枚恶性结节超声显示6枚提示TI-RADS 3类(其中4/6枚B超描述伴强光点、钙化或界不清),72枚提示TI-RADS 4类,12枚提示TI-RADS 5类。44枚为左叶占位,45枚为右叶。84枚结节(其中包含8枚同时伴有BRAF V600E突变)因超声TI-RADS分级≥4类而行手术,2枚因其他结节确诊恶性,4枚因其他原因手术(超声TI-RADS分级3类但伴结节钙化、界欠清或血流动力学改变)。见表1。
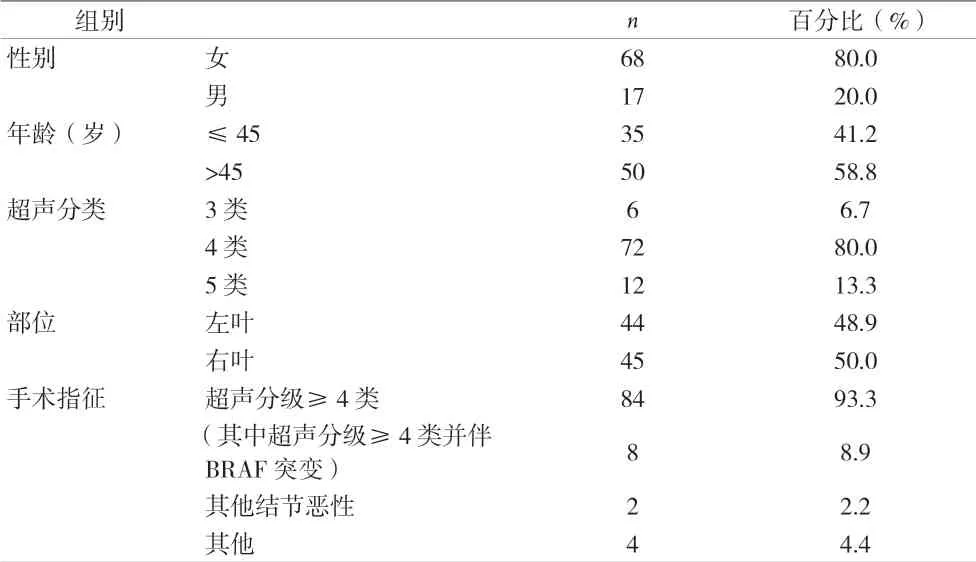
表1 85例(90枚)细胞学AUS/FLUS的恶性结节临床资料分析
2.2 细胞学涂片 90枚恶性结节细胞学判断为AUS/FLUS,细胞学涂片主要依据(见表2),包括细胞核非典型、细胞结构非典型、细胞核及细胞结构非典型、非典型细胞胞质嗜酸、非典型淋巴细胞。其中细胞核非典型主要表现在细胞量少的背景中,局部非典型细胞的细胞核增大、拉长、核染色质淡染。细胞结构非典型表现在细胞量少的背景中,微滤泡结构不成比例增多。见图1~6。
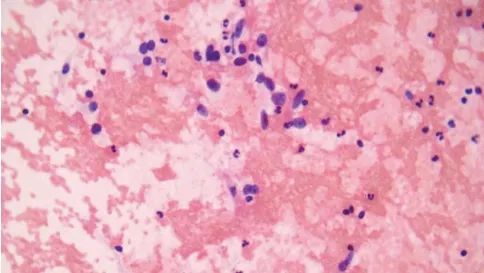
图1 甲状腺右叶结节(HE染色×400),细胞核异型:核拉长、增大、淡染,手术常规病理髓样癌

表2 90枚细胞学AUS/FLUS恶性结节细胞形态学分析
2.3 组织学分类 90枚恶性结节术后常规病理显示,甲状腺乳头状癌占94.4%,尤其以经典型多见。5枚为其他组织学类型,包括1枚甲状腺滤泡癌,1枚甲状腺髓样癌,1枚具有乳头状细胞核特征的非侵袭性滤泡性甲状腺肿瘤(NIFTP),1枚黏膜相关淋巴组织淋巴瘤(MALT),1枚腺样囊性癌。见表3。
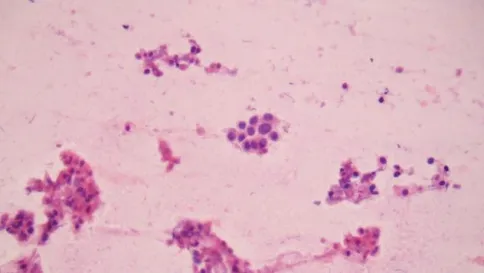
图2 甲状腺左叶上极结节(HE染色×400),细胞核异型:成团细胞核大小不一,手术常规病理经典型乳头状癌
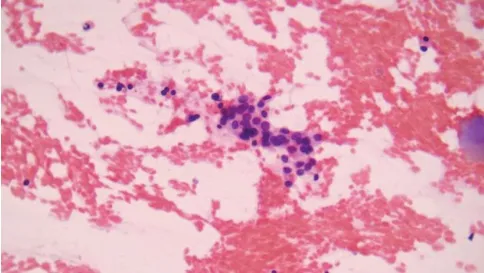
图3 甲状腺左叶结节(HE染色×400),细胞结构异型:微滤泡,手术常规病理滤泡亚型甲状腺乳头状癌
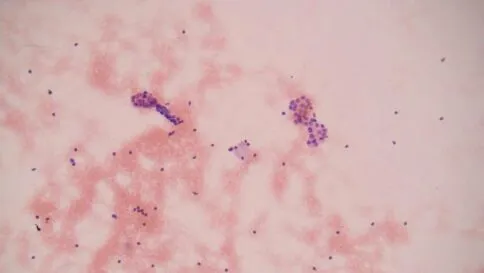
图4 甲状腺左叶下极(HE染色×200),细胞结构异型:微滤泡,手术常规病理经典型甲状腺乳头状癌

图5 左叶中下部结节(HE染色×400),细胞胞质嗜酸,手术常规病理经典型甲状腺乳头状癌
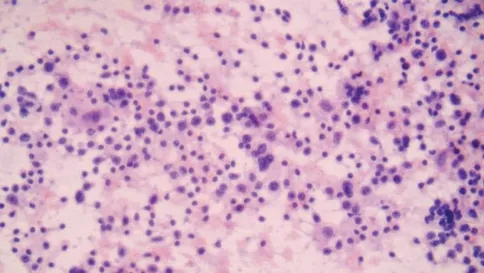
图6 右叶结节(HE染色×400),散在大量淋巴细胞克隆性增生,手术常规病理MALT
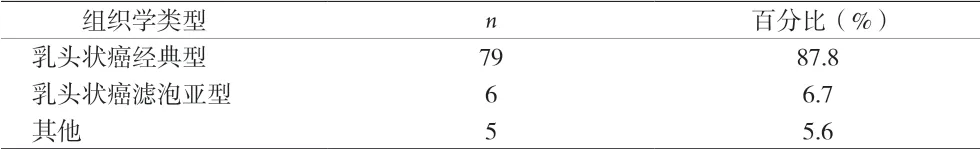
表3 90枚结节细胞学AUS/FLUS的组织学类型
2.4 BRAF基因检测结果分析 90枚结节中,11枚结节有BRAF检测结果,8枚提示BRAF V600E基因发现突变。见表4。
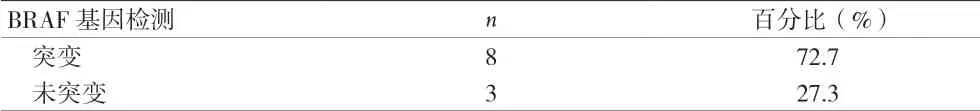
表4 90枚细胞学AUS/FLUS的恶性结节BRAF基因结果
3 讨论
超声引导FNAC检查后行细胞学诊断是手术病理的重要辅助方法[8],本研究对85例细胞学判断为AUS/FLUS,而常规组织病理为甲状腺癌的临床、病理资料分析发现,患者平均年龄37~57岁,大多数为女性患者,与章远江等[9]研究报道结果一致。85例甲状腺癌行细针穿刺的90枚结节中,84枚结节的超声分级4类及以上,77枚结节最大径≤10 mm,提示对超声分级4类及以上的且结节最大径≤10 mm的结节,诊断为AUS/FLUS需更引起重视。
本资料中,90枚结节判断为AUS/FLUS的主要原因是:88枚结节镜下特点具有细胞核和(或)结构的非典型,其中86枚结节具有细胞核非典型,OLSON等[10]对AUS/FLUS结节细分为三类:AUS-N(核异型)、AUS-F(微滤泡结构)和AUS-O(嗜酸细胞)。KIM等[11]将AUS/FLUS分为四亚类:AUS-N(核异型)、AUS-A(结构非典型)、AUS-O(嗜酸细胞)和AUS-N/A(核和非典型异型),研究均提示核异型组的恶性风险更高。CIBAS等[7]在TBSRTC分级中将AUS/FLUS的细胞异型性分为四种情况:局灶细胞异型性、广泛的轻度细胞异型性、囊壁被覆细胞异型性、组织细胞样细胞。本资料中,细胞核异型主要以局灶细胞核异型为主,且多数涂片镜下表现为核增大、淡染。YAPRAK等[12]提出在分化型甲状腺癌中,以甲状腺乳头状癌最常见,这与本资料结果相一致。
90枚结节镜下均提示细胞数量较少,其中11枚有BRAF检测,余结节未行检测的原因与细胞量极少,无法行基因检测有关。导致细胞量较少的原因可能与结节大小相关。刘军等[4]研究认为,当出现部分特殊病变时,如显著纤维化或钙化也会导致FNAC难以获取足量的细胞量。其次18.9%结节涂片质量不佳,主要包含血液覆盖、挤压伤及退变这三个方面,对于核异型的观察与涂片质量明显相关[13],涂片操作中应尽量避免此类因素造成对核异型观察的干扰。
细针穿刺标本细胞量较少时诊断医师主观性较强。吴妍等[14]研究表明,FNAC联合BRAF V600E基因突变鉴别诊断甲状腺结节良恶性与常规组织病理诊断的符合率较高,可提高术前甲状腺乳头状癌的诊断率。美国甲状腺协会管理指南[15]提出,建议对于细胞学检查不确定时的甲状腺结节使用分子标记物(如BRAF、RAS、RET等)进行辅助诊断。本研究11枚FNAC联合BRAF突变的结节中8枚有BRAF V600E突变,且均提示非典型细胞量少,故建议特别是ACR TI-RADS 4类及以上,FNAC提示细胞核和(或)结构非典型,及非典型细胞量少而判断为AUS/FLUS的患者,可行BRAF基因联合检测提高结节良恶性的准确性、敏感性、特异性。
综上所述,甲状腺AUS/FLUS结节是TBSRTC中具有争议的诊断类型,诊断具有一定主观性和经验性[16],当镜下出现核和(或)结构非典型,且非典型细胞量少,TBSRTC分级判断为AUS/FLUS,尤其当超声TIRADS系统分级4类及以上时,建议联合BRAF V600E检测明确结节恶性风险程度,对患者的治疗及预后有重大意义。
