宁夏贺兰山斑子麻黄种群的性比及雌雄空间格局
2023-01-13刘万弟高佳慧李小伟
赵 玲,杨 博,刘万弟,马 龙,高佳慧,李小伟
宁夏大学农学院,银川 750021
性比和空间分布格局对雌雄异株植物种群的生存潜力、遗传多样性维持、个体繁殖以及对环境响应等均具有重要意义[1—2]。性比是指雌雄异株种群中所有个体或某一龄级上的雌雄个体数目的比例,反映了种群产生后代的潜力,在一定程度上影响着种群发展动态。一般来说,雌雄异株植物自然种群的性比为1∶1,但大量研究结果表明,雌雄异株植物种群普遍存在性比偏倚的现象[3—5]。导致种群性比偏离的原因有植物自身的因素和环境因素,比如:雌雄植株受精卵构成比例、花粉粒的存活率、花粉管的存活率[6]、性别表达的遗传决定性[7]、种子发育、萌发率[8]、死亡率、生理生化特性[9]以及雌雄植株寿命差异等均会导致种群性比偏离。此外,环境因子也是造成性比偏离的重要原因[10]。雄株通常比雌株更有抗逆性,环境压力的增大会导致种群中雄株比例明显增加,如土壤养分[3]、海拔高度变化[4]等环境变化都会显著的影响雄树比例[11]。雌雄株对环境需求、性比格局、相邻植株敏感程度的差异[3,12]以及雌树的分布对种子散布的决定作用,都会影响空间分布格局,进而可能会影响种群动态。研究雌雄异株植物的性比结构以及与性别相关的空间格局有助于深化对种群动态的认识[13—14]。
斑子麻黄(Ephedrarhytidosperma)为中国特有种,国家二级保护植物,主要分布于宁夏贺兰山,生于山前洪积扇或砾石质山坡,具有耐贫瘠、抗旱、抗寒等优良特性,在维持荒漠生态系统多样性和生态平衡的方面具有不可代替的作用。近年来,随着贺兰山东麓的不断开发和利用,栖息生境遭到破坏,种群数量锐减,濒临灭绝。有研究表明:未来气候变化的过程中斑子麻黄将从适宜的分布区消失[15—16]。由此可见,对斑子麻黄的保护已迫在眉睫,急需开展试验研究,以便提出有效的保护和管理措施。然而目前国内外相关研究匮乏,本文通过对宁夏贺兰山4个不同海拔斑子麻黄种群调查与数据分析,旨在回答以下问题:(1)沿不同海拔分布的斑子麻黄种群的性别比例是否偏离1∶1?(2)沿海拔梯度的斑子麻黄种群的雌雄比是否有差异?(3)沿海拔梯度的斑子麻黄种群雌雄植株的空间关联性是否相关?本研究结果可为国家二级保护植物斑子麻黄的保育提供基础数据。
1 材料与方法
1.1 研究区域概况
贺兰山位于阿拉善荒漠东南缘,地貌形态呈东仰西倾。本区域属于干旱大陆性气候,全年干旱少雨,寒暑变化强烈,日照强,无霜期短。年均温8.5℃,年均降雨量200—400 mm,年平均蒸发量2000 mm以上,年日照时数3040 h。海拔1900m以下的洪积扇地区为山体灰钙土,生长着耐旱的短花针茅(Stipabreviflora)、酸枣(Ziziphusjujubevar.spinosa)、蒙古扁桃(Amygdalusmongolica)、红砂(Reaumuriasoongarica)、猫头刺(Oxytropisaciphylla)、斑子麻黄(Ephedrarhytidosperma)、旱榆(Ulmusglaucescens)等疏林和灌丛植被。
1.2 调查方法
1.2.1样地调查
2021年5月,在贺兰山东麓选取了4个具有代表性斑子麻黄群落作为样地(表1)。每个样地设置了1个30 m × 30 m的样方,记录每株斑子麻黄的二维坐标、海拔、性别、株高、冠幅等信息,总计2012株,能够确定性别有1770株,占87.97%[17—18]。不能确定性别的242株(S1:4株,S2:1株,S3:23株,S4:214株),且性别未定242株中植株d≤20 cm高达218株(d为植株体积的立方根,单位cm),占90%。(S1:3株,S2:1株,S3:22株,S4:192株)20
生长在干旱环境中的灌木,其冠幅和株高之间的关系与灌木的发育阶段呈显著关系[19—20]。本研究参照宋垚彬等[18, 21—23]采用植株体积(株高×冠幅)的立方根(d表示,单位cm)并结合野外斑子麻黄植株形体大小分布频次及植株是否具有开花能力划分为3个等级:龄级Ⅰ(幼年),d≤20 cm;龄级Ⅱ(成年),20
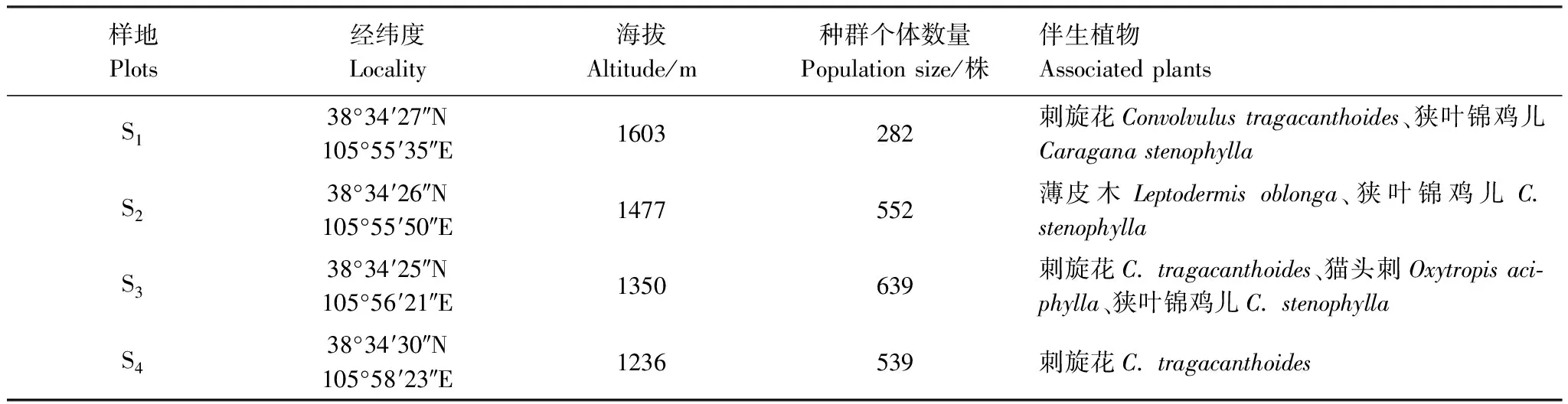
表1 各样地种群概况和伴生植物
1.2.2土壤采集与测定
分别在S1、S2、S3、S4样地内,利用土钻在样方的中心和四角各取0—40 cm土层样品,将土壤充分混合,重复3次,自然风干后进行养分的测定,有机质采用重铬酸钾加热法,全氮用凯氏定氮仪(全自动凯氏定氮仪K- 360,BUCHI Labortechnik AG,Switzerland),全磷用NaOH熔融-钼锑抗比色法,土壤含水量用烘干法,pH采用酸度计测定法(水土比为2.5∶1),土壤容重采用环刀法。
1.3 数据分析
1.3.1形态特征及性比分析
采用SPSS 21.0软件对数据进行处理;χ2检验性比(雄/雌)偏倚1∶1零假设的显著程度,独立样本T检验用于比较各样方中雌雄群体株高、盖度的差异。Origin 2020、Excel 2010进行作图。
1.3.2空间格局、空间关联分析
本研究分别采用点格局分析中Ripley′sK函数与成对相关函数g(r)进行种群整体空间分布与其种内关联性分析[24—26]。分析4个不同海拔种群所有斑子麻黄雌雄个体双变量点格局,采用随机标签零假设(Randomlabeling model),通过计算以对象1的每一个体为圆心、距离r为半径的指定环宽的圆环区域内对象2的个体数量,以此来判定雌雄个体在不同尺度下的空间关联性。没有开花的植物,无法判定植株的性别,在数据统计分析时未包括性别未定植株。
数据分析采用空间点格局分析软件Programita 2014完成。空间尺度大小为各样地最短边长的一半,Monte-Carlo检验模拟循环199次,建立99%的置信区间。对于雌雄双变量统计分析,某一尺度上,当g(r)高于置信区间上限,表示雌雄在该尺度上呈正相关关系,反之低于置信区间下限则为负相关关系。若在置信区间之间,则表示雌雄间的空间关联性不显著,趋于相互独立[27]。
2 结果与分析
2.1斑子麻黄群体分布
从图1可以看出,4个不同海拔种群斑子麻黄性别分布图(30 m ×30 m),S1种群植株最少282株(131∶147∶4,雌株∶雄株∶性别未定,下同);S2种群552株(271∶280∶1);S3种群植株最多639株(269∶347∶23);S4种群539株(134∶191∶214)。空间分布如图1。
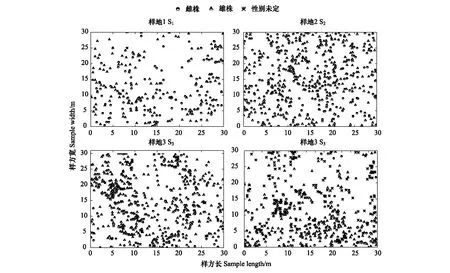
图1 4个斑子麻黄种群空间分布图Fig.1 Spatial distribution map of E. rhytidosperma in four populations
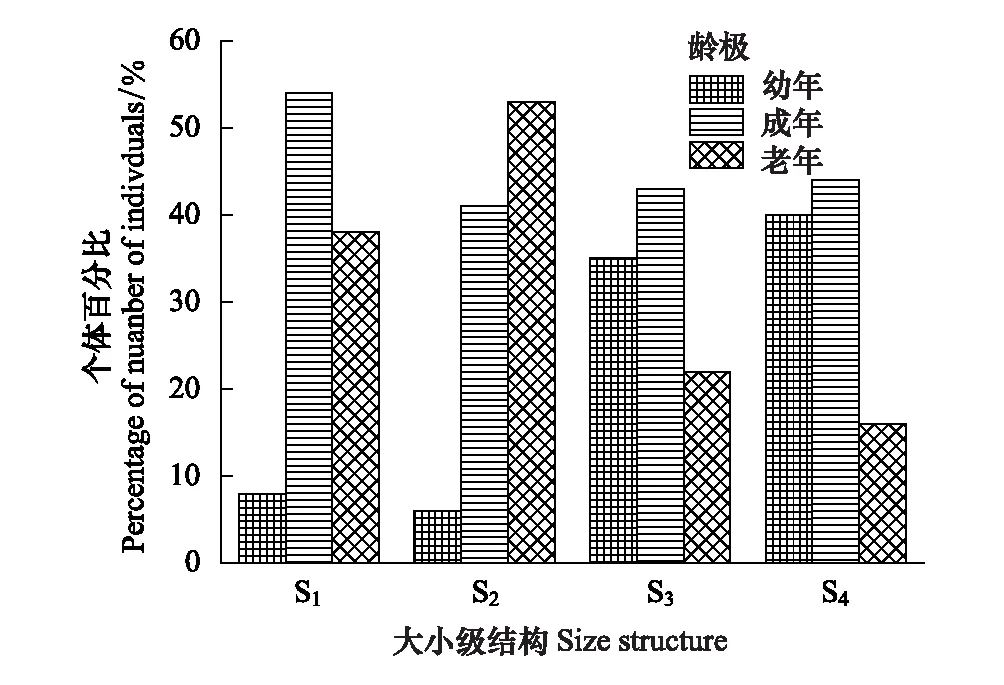
图2 斑子麻黄种群大小级结构 Fig.2 The size structure of four populations of E. rhytidosperma 龄级Ⅰ(d≤20 cm)代表幼年,龄级Ⅱ,(20 cm
2.2 斑子麻黄种群的大小级结构
从(表1)中可以看出,S2、S3、S4的斑子麻黄种群个体数量较多;S1种群个体数量较少。4个种群中(图2),S1、S3、S4种群的个体数量均随d值的增大呈先增后减的“单峰型”, S3、S4种群个体数多度主要集中在幼树和成年树两个等级,两者总和分别占各自种群个体总数的78%、84%,表明幼树和成年树居多。说明这2个种群自然更新良好,在一定时期内表现出增长趋势。S1、S2种群个体主要分布在成树和老年两个等级,其总和分别各自种群个体总数的92%和94%,说明种群缺乏幼体,更新较差,表现出一定的衰退趋势。
2.3 斑子麻黄种群的性比格局及形态特征
4个不同海拔斑子麻黄种群雌雄植株的数量分布如表2所示。4个不同海拔种群中雄株总计965株,雌株805株,整体上偏雄性,且性比极显著偏倚1∶1(P<0.01)。其中,S4种群(雄/雌= 1.43)是4个种群中偏雄性最高的种群,S2种群(雄/雌= 1.03)是4个种群中偏雄性最低的种群。S3(雄/雌= 1.29)、S4(雄/雌=1.43)两个种群有显著的性别偏倚现象(P<0.05)。
4个不同海拔斑子麻黄雌雄植株共1770株,雌雄盖度差异极显著(P<0.01)、株高无显著差异(P>0.05)。S2种群雌雄株间株高、盖度均差异极显著(P<0.01);其次是S1种群雌雄株高(P<0.05)差异显著、盖度(P<0.01)差异极显著,从均值来S1、S2看两个种群中雄株株高、盖度均大于雌株;S1、S2种群中雌雄植株的株高和盖度远远大于S3、S4种群的植株。
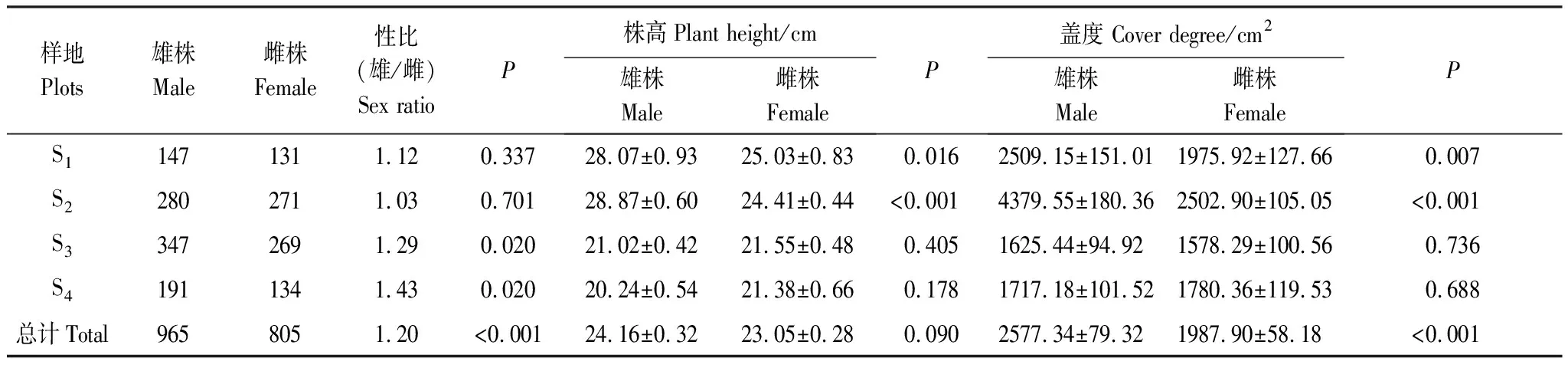
表2 4个种群中雌雄比及雌雄植株的形态特征
2.4 斑子麻黄种群不同径级的性比格局
为了解斑子麻黄种群内具体的性比格局,对不同径级上的雌雄植株数量进行统计并检验性比(雄/雌)偏离1∶1零假设的显著程度(χ2检验)。对S1、S2、S3、S4种群进行统计检验分析,结果如(图3)所示:S1种群在老年阶段偏雄性,性比显著偏倚1∶1;在幼年阶段偏雄性,成年阶段偏雌性,两龄级性比均不显著偏倚1∶1。S2种群在幼年、成年阶段偏雌性;老年阶段偏雄性;三龄级性比均显著偏倚1∶1。S3、S4种群在不同径级上的性比格局相同,三龄级都偏雄性,且在幼龄性比显著偏倚1∶1。
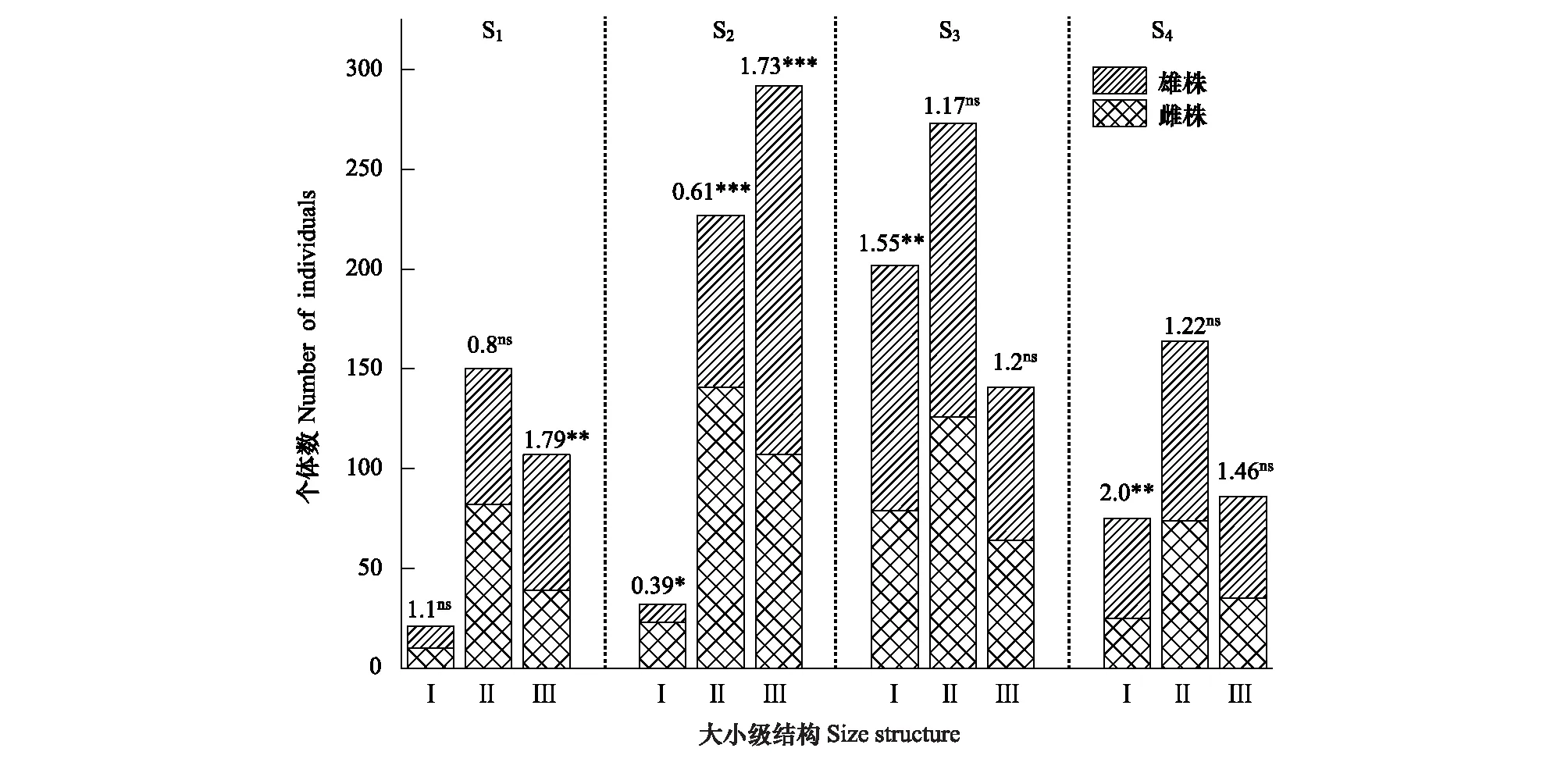
图3 斑子麻黄种群不同径级的性比格局Fig.3 Sex ratios for size structure of basal diameter in E. rhytidosperma populations*和**表示性比(雄/雌)性比显著偏离1∶1(P<0.05和P<0.01),***表示性比(雄/雌)显著偏离1∶1(P<0.001),ns表示性比(雄/雌)不显著偏离1∶1(P≥0.05)(χ2检验)
2.5 斑子麻黄雌雄植株的空间关联性
双变量空间关系分析表明(图4),4个种群雌雄植株间的相关性不完全相同,其中S1种群内,雌雄植株在0—0.45 m尺度上正相关,0.45—1.2 m尺度上彼此相互独立,1.2—1.5 m尺度上彼此轻微正相关,其余尺度上彼此相互独立,整体趋于不相关。整体尺度变化趋势大致为:“正关联→无关联”的特点;S2种群内,雌雄植株在全部尺度内均为独立或相关性极小。整体尺度变化趋势大致为:“无关联”的特点;S3种群内,雌雄植株在0—3 m尺度上为正相关,3—4.5 m尺度上为相互独立或轻微正相关,4.5—6.3 m尺度上为彼此相互独立,6.3—9 m尺度上为相互独立或轻微负相关,9—15 m尺度上雌雄植株为相互独立。整体尺度变化趋势大致为:“正关联→无关联→负关联→无关联”的特点;S4种群内,雌雄植株在0—9m尺度上为正相关,9—10.5 m尺度上为相互独立或轻微正相关,10.5—15 m尺度上彼此相互独立。 整体尺度变化趋势大致为:“正关联→无关联”的特点。
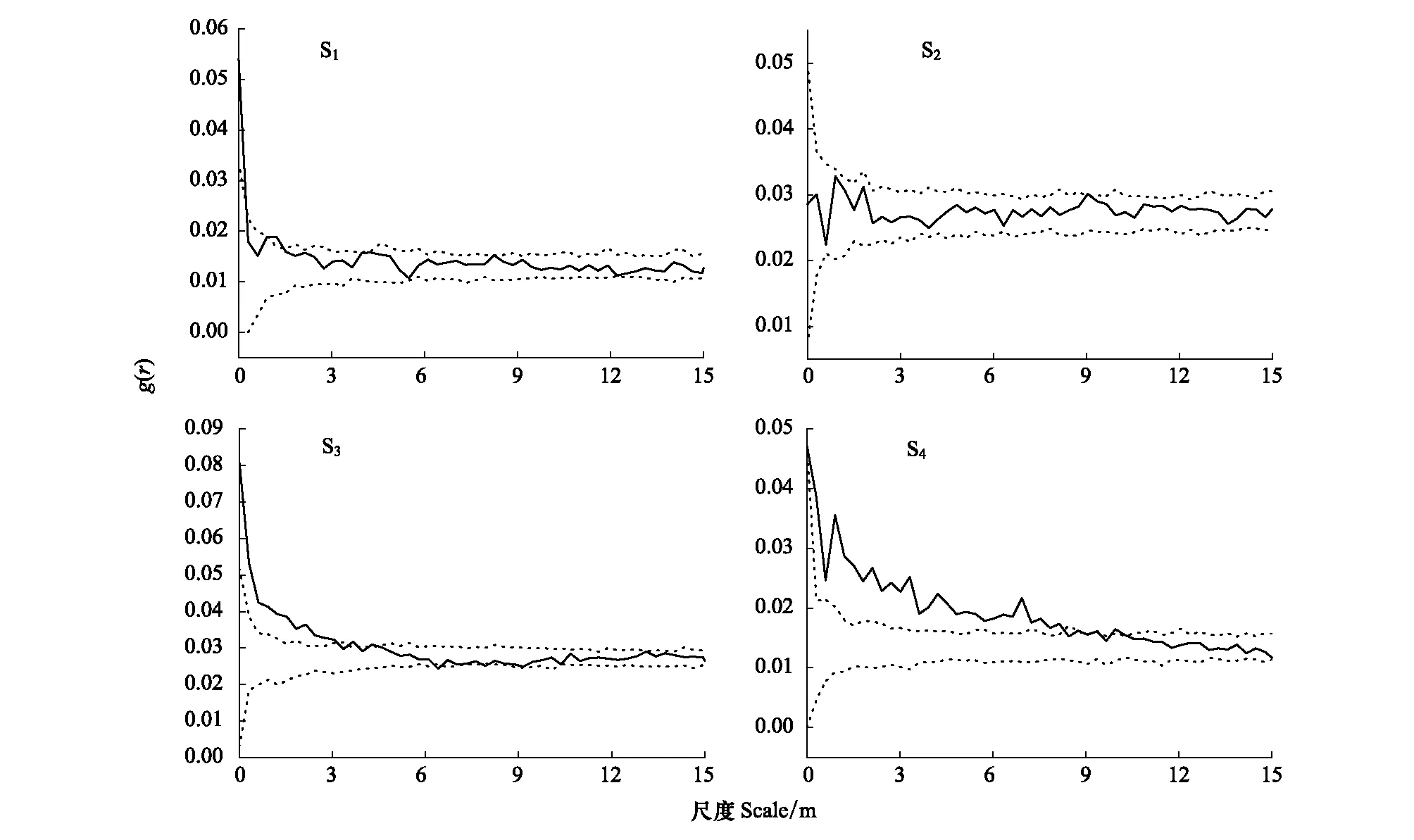
图4 斑子麻黄种群雌雄植株间的空间关联Fig.4 Spatial associations between male and female plants of E. rhytidosperma populations 实线为g(r)值,虚线为99%置信区间
2.6 斑子麻黄不同样地的土壤指标
4个种群的土壤理化性质如表3所示,土壤含水量均值高海拔种群(S1、S2)高于低海拔种群(S3、S4),低海拔S4种群土壤含水量最低,S2与 S4之间差异显著;土壤容重低海拔种群(S3、S4)高于高海拔种群(S1、S2),土壤容重均值S3最大,S3与S1差异显著、S3与S2差异显著;全氮高海拔种群(S1、S2)高于低海拔种群(S3、S4);土壤有机质含量高海拔种群(S1、S2)高于低海拔种群(S3、S4),S1最高。土壤全磷含量高海拔种群(S1、S2)高于低海拔种群(S3、S4),S1、S2、S3、S4之间差异不显著;土壤pH值S3最大,S3与S1之间差异显著。
3 讨论
种群的空间分布、大小结构反映了种群的发展动态及趋势,并在一定程度上揭示了种群的更新策略、地位以及与环境的相互关系[28—29]。4个斑子麻黄种群径级分析显示:S3、S4种群不同径级的发展趋势很相似,在成年阶段呈现明显的“波峰”现象,均有一定数量的幼体和成体植株,两者总和占各自种群个体总数的78%、84%,幼树和成树居多,说明这2个种群自然更新良好,说明S3、S4种群在一定时期内表现出增长趋势。S1、S2种群个体主要分布在成树和老年两个等级,其总和分别各自种群个体总数的92%和94%,说明种群缺乏幼体,导致种群天然更新力较差,表现出一定的衰退趋势。在S1、S2种群中,成年、老年植株比例明显上升,说明成年和老年阶段的斑子麻黄成活率明显提高了,生存能力更强。这与Bin研究的成年、老年植株个体生活史策略可能相对保守、生长相对缓慢,死亡率较低结果一致[30]。
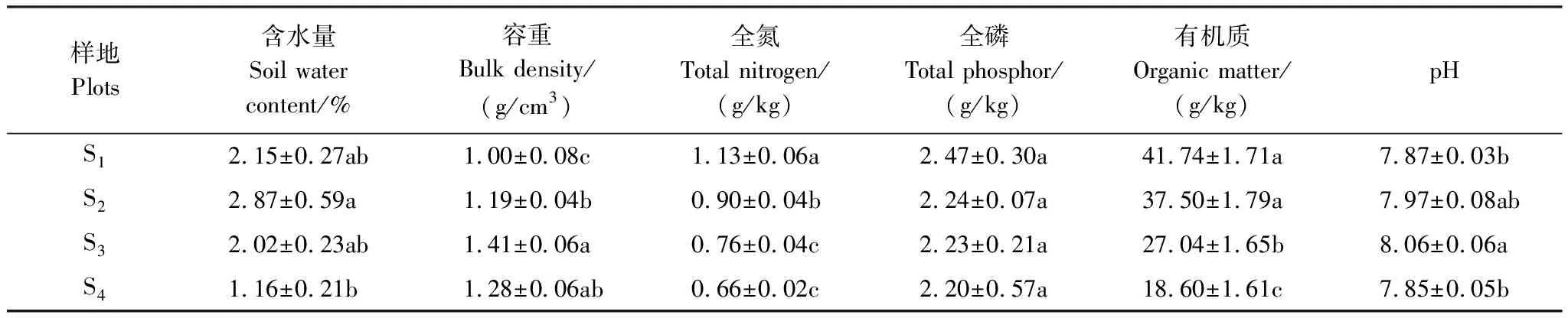
表3 各样地土壤指标
雌雄异株植物普遍存在性别依赖的繁殖差异,雌株付出的繁殖代价通常比雄株要高。雌株较高的繁殖投资将导致雌株产生高死亡率,以致种群性比偏雄性[31—32]。本次调查的4个不同海拔的种群性比格局相似。S1、S2、S3、S44个种群分别都偏雄性。4个种群的总植株数雄株多于雌株,且性比极显著偏离1∶1(P<0.01)这与很多雌雄异株植物的性比格局结果一致[33—35]。很多研究表明,环境因子能够影响雌雄异株植物的性比,一般干旱或少养分环境条件下,雄株占优势;而在湿润或高养分环境条件下,雌株占优势[34]。本研究中S1、S2样地土壤全磷、全氮、有机质及土壤含水量明显高于S3、S4样地,S1、S2两个种群性比格局不显著偏倚1∶1(P>0.05);S3、S4整体性比格局显著偏倚1∶1(P<0.05);这与Dawson等研究雌雄异株植物性比格局与环境因子异质性的研究结果一致[34]。
除去性别未定植株外,不同径级之间种群的雌雄分布,S1和S2种群土壤水分、养分条件优于S3和S4种群。调查结果发现S2种群在幼年、成年阶段均偏雌性,性比均显著偏倚1∶1(P<0.05,P<0.001)。S1种群在成年阶段也偏雌性,虽然S1种群在幼年阶段没有明显偏雌性,但是雌雄植株数间仅差一株;结果表明S1、S2在幼年成年偏雌性。这与Dawson等、Freeman等研究的在湿润或高养分环境条件下雌株占优势结果一致[34,36]。随着年龄的增加,在老年阶段,S1、S2种群均明显偏雄性,且两个种群性比均极显著偏倚1∶1(P<0.01、P<0.001)这可能由于雌株较高的繁殖投资造成死亡率高于雄株,雌株的生命周期明显短于雄株,性比由原来的偏雌性逐渐过渡到偏雄性,这与Rocheleau等研究雌雄植株不同的繁殖投资成本将导致其生命周期的差异结果一致[37]。土壤环境较差的S3、S4种群幼年、成年、老年阶段均偏雄性,且在幼年阶段性比极显著偏倚1∶1(P<0.01、P<0.01)。说明在干旱少雨的环境幼小的雄株比雌株具备更强的生命力。由于雌树需要具有足够的资源储备才能开始有性繁殖,而雄树只需相对较少的资源储备,这导致雄树在相对雌树较小年龄就开始有性繁殖。小径级范围内性比的极显著偏倚也导致了整体水平上性比偏雄性[13]。这与赵亚洲等的雌雄异株植物黄连木种群性比和空间分布结论一致[38]。
对于斑子麻黄雌雄植株间的空间关联研究发现,4个不同海拔分布种群的空间关联性不一致:S1、S3、S4大致表现为不同尺度的“正关联→无关联”,但S1种群雌雄之间的正关联(0—0.45 m)远远小于S3、S4种群雌雄之间的正关联(0—3 m)、(0—9 m),以致S3、S4种群为增长型种群,S1种群为衰退型种群;由此可见,较大尺度上的雌雄正关联有利于雌雄异株植物完成传粉,有利于繁殖。而S2种群在整个尺度上都表现为“无关联”,即为衰退种群。说明雌雄之间空间隔离不利于雌雄异株植物繁殖。S2种群雌雄株间可能为了能更好地适应微环境,产生雌雄植株在空间占有和资源利用上的差异性,一定程度上导致空间分离[38]。这种空间分离虽然有利于斑子麻黄雌雄植株对资源和空间的充分利用,但形成性别间的空间隔离。且不利于种群繁殖,表现为S2种群出现衰退现象。S1、S2种群这种衰退现象足以说明雌雄之间的空间关联性不够或雌雄之间无关联不利于种群繁殖。
本研究结果揭示了斑子麻黄种群的发展动态与环境因子以及与植株的年龄结构、性比、雌雄空间分布格局的关联性,将为斑子麻黄种群保护和恢复提供理论依据。
