基于NLRP3介导的焦亡通路探讨针刺在中枢神经系统疾病中的作用
2023-01-11郭智超吕晓琳曹馨元尹洪娜
罗 铮,郭智超,吕晓琳,梁 吉,曹馨元,王 兴,尹洪娜△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150006)
中枢神经系统(Central nervous system,CNS)疾病可见脑或脊髓发生神经元不可逆损伤,是中枢神经组织病变的总称。针灸作为中医学治疗疾病的传统方法之一,有调理气血、疏通经脉的作用,现代研究表明针刺对机体进行调节可通过多个信号通路来实现,其中就包括炎症体介导细胞焦亡的信号通路[1]。近年来,随着人们对CNS疾病损伤机制的不断深入研究,发现其致病原因虽然有很多,但炎症小体介导的细胞焦亡却一直是研究的重难点课题。本研究通过NLRP3炎症小体的组成、结构功能、激活机制及其介导的细胞焦亡信号通路对其在CNS中的作用方式进行了系统的归纳总结。这为探寻针刺治疗CNS疾病做出了理论铺垫,有利于促成针刺在炎症方面治疗CNS疾病的新进展。
1 NLRP3炎症小体
1.1 炎症小体概述
炎症小体(Inflammasome)由Tschopp研究组于2002年首次提出[2],是由接头蛋白(ASC)、效应蛋白(Caspase-1)和受体蛋白(PRR)共同组成的高蛋白复合体[3],其作为机体的第一道保护屏障[4],发挥着识别危险信号和抵抗外来病原体的作用,病原及损伤相关分子模式(PAMPs、DAMPs)经过PRR识别后,随即参与免疫应答,激活相关通路,最终诱发炎症反应[5]。PRRs家族体十分庞大,由NOD样受体(NLR)、Toll样受体(TLR)等多名成员共同组成。NLRP3炎症小体则作为先天免疫传感器参与炎症反应,在NLRs家族中处于核心地位,其释放众多炎性相关因子从而介导细胞焦亡,在CNS疾病中发挥着重要作用,未来将是课题组持续研究的焦点话题。
1.2 NLRP3炎症小体的结构功能
现代医学对于NLRP-家族成员中研究最为深入的是NLRP3炎症小体[6],其作为先天免疫传感器,能快速识别外源性病原体和内源性细胞内容物,参与许多疾病的免疫代谢过程,最终诱发炎症反应[7]。深入了解NLRP3炎症小体的结构功能便于探究其在CNS疾病炎症通路中的作用机制,这也有助于为针刺治疗CNS疾病提供新的治疗靶点。NLRP3炎症小体是由C-末端识别配体结构域(LRRs)、中间端分管自身寡聚化结构域(NOD domin,NACHT)和N-末端起募集作用的结构域(PYD)[8]3部分共同组成。ASC由补充结构域(Caspase recruitment domain,CARD)和PYD构成,在感受到外界的危险信号后,NLRP3炎症小体通过ASC的PYD与其N端的PYD结合,形成PYD-PYD作用模式,再由ASC形成CARD-CARD作用形式,通过募集并激活pro-Caspase-1,使之成为Caspase-1,负责将pro-IL-1β和pro-IL-18剪切为IL-1β和IL-18,并迅速分泌释放出来,实现激活感染部位的免疫细胞且发挥对病原体的清除作用,参与炎症反应[9]。若Caspase-1的过度活化,不断剪切出成熟IL-18及IL-1β,则会出现过度炎症反应,最终诱发一系列的炎症疾病,为此,对NLRP3炎症小体激活机制深入研究,可更好地探究与之相关的CNS疾病发病机制,以完善相应的防治策略。
1.3 NLRP3炎症小体的激活机制
NLRP3炎症小体实现激活有两个预警信号,其一是启动信号:Toll样受体(TLR)或别的识别受体遇到炎症刺激之后,开启NF-κB通路,引起NLRP3、pro-IL-1β的表达和转录[10];第二个是激活信号:受不同PAMPs或者DAMPs转导,促进NLRP3、ASC和pro-Caspase-1的活化,实现致炎因子的成熟分泌[11]。另外,NLRP3炎症小体可被不同刺激激活,但一些激活机制尚未十分明确,现已被广泛研究并被普遍认同的几种机制主要包括离子通道的作用[12-14]、线粒体功能损伤引起ROS产生[15]和溶酶体损伤[16-17]。见图1[18]。
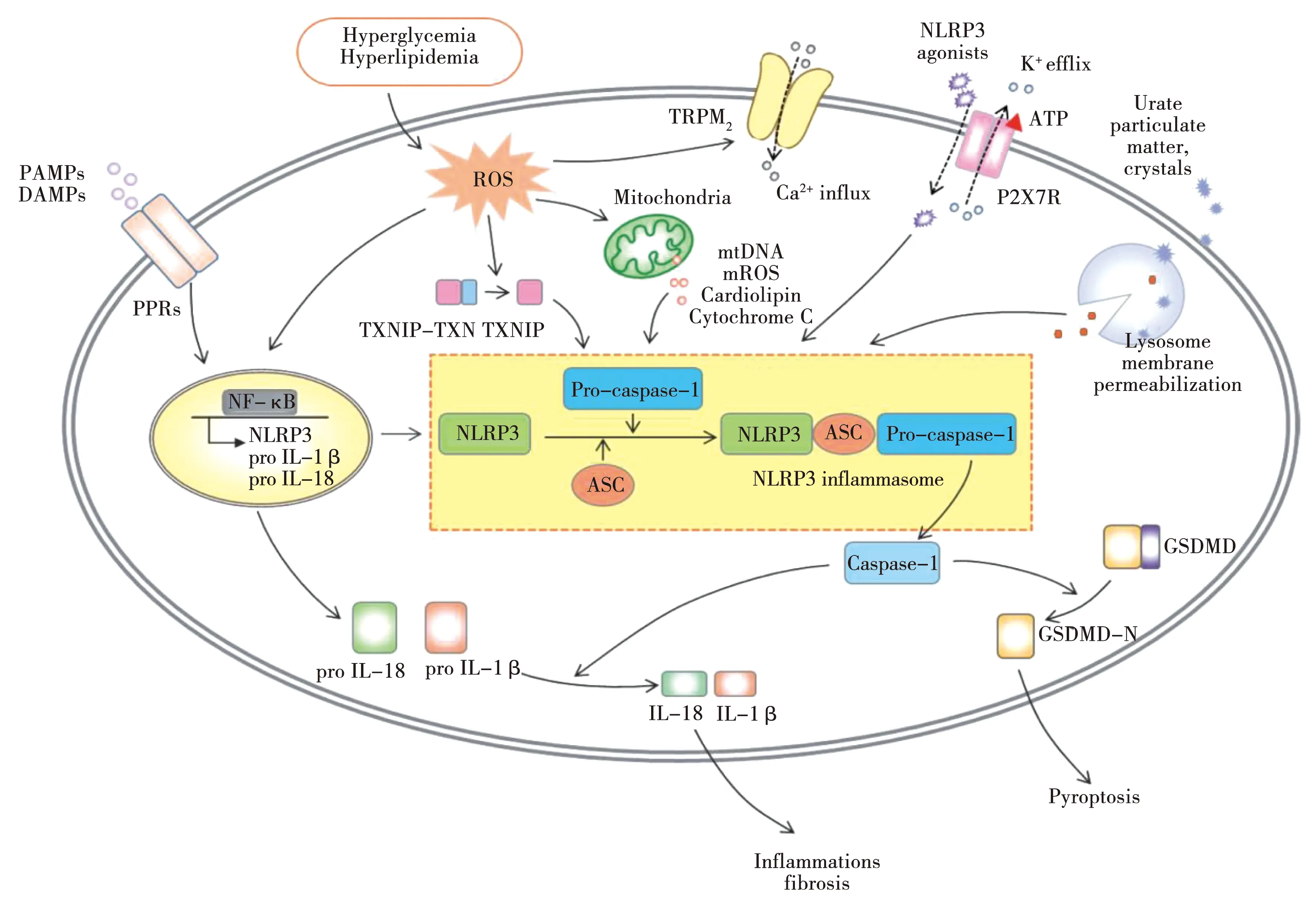
图1 NLRP3炎症小体的起始步骤与激活步骤
2 细胞焦亡
2.1 细胞焦亡的概述
细胞焦亡是一种新发现的促炎程序性死亡方式,1992年首次被发现在志贺菌感染的巨噬细胞中[19],直到2001年才由Cookson等正式提出[20]。焦亡的标志性特征是细胞质膜完整性丧失,膜上孔道形成,细胞出现胀大破裂最终释放出炎性物质诱发炎症反应[21]。
2.2 细胞焦亡的途径
细胞焦亡主要有经典和非经典焦亡两种途径。前者是由细胞内的PRR识别PAMPs或DAMPs样刺激信号,在其感知危险后激活,经ASC和pro-Caspase-1结合成炎症小体,释放Caspase-1后切割pro-IL-18、pro-IL-1β成IL-18、IL-1β,最终促发炎症反应。同时,Caspase-1会切割消化道皮肤素D(Gasdermin D,GSDMD),使其N末端整合到细胞膜上出现穿孔,导致细胞肿胀破裂、内容物流出从而引发焦亡[22];非经典途径是由革兰阴性菌的脂多糖(LPS)激活来自人的Caspase-4、5或来自鼠的Caspase-11,直接切割GSDMD成含有N端的肽段造成膜穿孔引起焦亡[23]。另一方面Caspase-4、5和11会使pannexin-1通道开放,释放K+,实现激活NLRP3炎症小体,加大炎症反应[24],此外,开放的通道致使胞膜出现孔道也可导致焦亡发生[18]。
3 NLRP3介导的细胞焦亡
细胞焦亡的激活主要是由NLRP3炎症小体所介导的,体现在焦亡的发生主要依赖于多蛋白复合炎症体介导的Caspase-1的活化,而Caspase-1的成活是在NLRP3炎症小体识别各种内外界危险信号后,由Caspase-1前体切割导致而成的,这个过程中,NLRP3炎症小体发挥了至关重要的调节作用。然而,用不同方法激活Caspase-1的作用形式与细胞焦亡的发生也密切相关,由此可知,焦亡是炎症小体活化的结果,而活化炎症小体是焦亡发生的关键所在,同时NLRP3炎症小体又是介导焦亡发生的重中之重。
4 NLRP3炎症小体介导的细胞焦亡与CNS疾病的关系
4.1 阿尔兹海默症
阿尔兹海默症(Alzheimer’s disease,AD)是以精神症状为表现的慢性神经系统疾病,其典型特征为β淀粉样蛋白(β-amyloid,Aβ)沉积。Aβ可激活NLRP3炎症小体,诱导Caspase-1活化,从而加大Aβ炎症反应[25]。研究证明[26]NLRP3炎症小体在AD发病机制中发挥着重要作用,如在抑制NLRP3炎症小体的AD小鼠模型中发现其Aβ沉积降低,这就说明,NLRP3介导的焦亡反应和AD相关的退行性疾病密切相关。
4.2 帕金森病
帕金森病(Parkinson disease,PD)是常见于中老年人的CNS疾病。PD有黑质多巴胺神经元死亡和α-突触蛋白累积的表现[27]。α-突触蛋白可使NLRP3炎症小体活化,促使Caspase-1分泌IL-18引起焦亡[28]。NLRP3炎症小体为神经炎症的关键调控位点,在PD病理过程中发挥主要调节作用,二者发生发展关系密切,但仍需进一步研究证实以明确其作用机制。
4.3 脊髓损伤疾病
脊髓损伤(Spinal cord injury,SCI)是神经外科常见疾患。在无干预的损伤早期,神经保护性免疫细胞不如损伤性免疫细胞发挥作用时间长,初步弄清了SCI后局部免疫微环境的规律,但更深一步的机制仍需继续挖掘。其中损害细胞包括:辅助性T淋巴细胞1型、17型(Th1型、Th17型)和M1型小胶质细胞以及巨噬细胞[29],有研究表明NLRP3炎症小体活化诱导的IL-1β和IL-18在SCI中发挥作用[30],而IL-1β和IL-18联合IL-3会致使Th17和γδT细胞IL-17的生成,还能促进Th1、Th7极化产生自身免疫炎症反应[31-32]。根据现有研究认为:活化的炎症小体NLRP3是导致SCI局部免疫微环境不易恢复的重要原因。
4.4 脑卒中
脑卒中分缺血性(Ischmic stroke)和出血性脑卒中(Intracerebral hemorrhage,ICH)。缺血性脑卒中是由大脑供血障碍所致,并且细胞内许多炎性因子如IL-1β的释放也会导致脑组织受损,而炎症小体在收到危险信号后激活Caspase-1和IL-18诱导出现细胞焦亡,会加快缺血性脑损伤的进程[33]。ICH是由于高血压或动脉粥样硬化导致的脑出血,ICH后脑组织遭到破坏会继发性出现脑损伤。ICH中NLRP3炎症小体会促进炎症反应,而抑制其表达能减少ICH后炎症反应的发生,起到神经保护作用。
5 针刺的作用
5.1 针刺调节NLRP3炎症小体介导的焦亡通路对AD的影响
众多研究证实,以NLRP3炎症小体为代表的神经炎症被认为是促进AD神经退行性病变的重要机制之一。同时电针或针刺干预作为一种补充和替代疗法,已被广泛应用于治疗AD、痴呆等具有认知障碍特点的神经退行性疾病。AD动物实验和临床实践结果均可证明针刺能够起到修复机体认知障碍的作用,同时表明针刺在改善AD患者日常生活能力方面比药物更有效。在中医理论中,以经络腧穴为基础的针刺疗法在AD的临床治疗中发挥了积极作用,特别是许多临床和实验研究表明,针刺具有安全、方便与副作用小的优点,在AD防治中发挥着十分重要的作用。
何川等[34]为观察针刺调节AD海马体中NLRP3炎症小体介导的炎症反应相关蛋白表达情况,选取36只SD大鼠分为空白组、模型组和电针组建立AD大鼠模型。造模成功后,对电针组给予足三里穴和百会穴针刺治疗,通过对比观察发现AD大鼠模型的海马组织中NLRP3、IL-1β与Caspase-1蛋白表达相应增加,但通过针刺干预可以使其表达下降,差异具有统计学意义(P<0.01)。实验证实了模型组增强了神经炎性反应,而针刺则可通过降低NLRP3炎症小体相关蛋白含量来实现降低神经炎性反应,说明针刺防治AD的机制可能与抑制NLRP3小体相关蛋白有关。
蒋靖等[35]将实验分为AD组、电针组和对照组,每组随机选取4只7.5月龄加速衰老且易感的小鼠作为AD模型,其中电针组选取水沟、百会与印堂穴进行周期15 d电针治疗,观察AD小鼠海马体中NLRP3、ASC、Caspase-1和IL-1β的含量变化。结果表明电针组较模型组相应蛋白含量明显降低,且具有统计学意义(P<0.01)。丁宁等[36]也通过选取水沟、百会和印堂穴证实针刺可以有效减少AD小鼠海马体中Caspase-1、IL-1β等焦亡相关因子的表达。Xie L等[37]选取20只SD大鼠随机分为电针组、生理盐水组、AD组和对照组。电针组给予百会穴针灸治疗6 d,持续时间共3周,为揭示电针治疗AD抗神经炎症作用的机制。使用水迷宫法评估大鼠学习记忆能力,免疫荧光法检测促炎因子表达量。实验结果显示电针组较其他组促炎因子降低显著,AD大鼠识别记忆能力较强。这提示电针降低了AD大鼠神经胶质促炎因子表达,增加了抗炎因子的表达。结合以上研究得出,电针治疗会影响炎症因子介导的细胞焦亡通路,以控制AD中小胶质细胞的极化和神经胶质细胞的炎症过程。
李坤等[38]为观察电针能否治疗AD因神经炎症引起的认知功能损害,将实验小鼠分为对照组、模型组、电针组与抑制剂组4组,电针组选取神庭穴、百会穴进行针刺治疗。实现结果显示:电针治疗显著降低了NLRP3炎症小体介导的焦亡通路相关因子表达。研究还发现电针组与抑制剂组相比,对NLRP3炎症小体和神经炎症反应的影响相似。这进一步证实了电针可以抑制NLRP3炎症小体,并改善AD小鼠认知功能障碍,这可能与电针阻断海马NLRP3炎症小体信号通路的抗神经炎症作用有关,同时提示电针干预神庭穴和百会穴是神经炎症介导所致的神经退行性疾病中的一种有效治疗策略。
5.2 针刺调节NLRP3炎症小体介导的焦亡通路对SCI的影响
SCI后,导致其出现一系列并发症的主要因素为局部炎症反应,研究证实NLRP3炎症小体在SCI炎症反应中发挥着重要作用,而针刺具有抑制炎症相关因子表达量的作用。由此得知,针刺对SCI的神经保护作用可能是抑制炎症因子的激活而介导的。通常临床治疗及科研实验中多选用电针或针灸的方法对SCI实施干预,针灸施术部位常选取夹脊穴及督脉循行的穴位,并结合调整针刺角度、电针强度和实施不同的进针手法等多种方式配合治疗,但不同的操作手法及针灸干预的持续时间对信号转导是否有影响还需为此深入探究,这也对改善SCI后针灸治疗方案有很大的临床意义。
吴磊[39]为明确电针是否可通过抑制NLRP3炎症小体活化,实现降低SCI后的炎症反应,将实验对象分为假手术组、模型组和夹脊电针组,夹脊电针组选取T9和T11节段夹脊穴进行干预治疗,结果为夹脊电针能明显抑制NLRP3炎症小体活化,降低IL-1β、IL-18表达,实现抑制炎症发生,减少神经元死亡,起到恢复运动功能的作用。李晓宁等[40]同样选取电针干预T9和T11节段夹脊穴,证实夹脊电针治疗SCI大鼠,会显著提高BBB评分且降低NLRP3炎性表达,减缓细胞焦亡程度,改善SCI炎症损伤,增强大鼠肢体活动能力。还有研究[41]通过实验观察SCI大鼠,发现NLRP3炎症小体在小胶质细胞中表达升高,得出电针可抑制P2X7R激活和降低NLRP3含量,可下调NLRP3 mRNA表达,改善SCI大鼠炎性损伤,减少炎症反应。这些研究为夹脊电针治疗SCI提供了新的实验依据。
郭蜜等[42]观察电针督脉对SCI大鼠损伤区NLRP3炎症小体介导的焦亡通路中相关因子表达的变化,将实验随机分为电针组、模型组和假手术组,其中针灸选穴为至阳穴、脊中穴,观察两个不同时间亚组7 d和14 d大鼠模型中NLRP3、ASC和Caspase-1因子水平。结果表明与模型组相比,电针组可抑制NLRP3、ASC和Caspase-1蛋白表达,针刺至阳穴、脊中穴配合电针治疗可降低SCI炎症小体的活性,差异具有显著意义(P<0.01)。
Choi DC等[43]为研究针刺是否可以通过抑制神经生长因子、促炎症因子Caspase-1及IL-1β等的激活实现对SCI的神经保护作用,将实验大鼠按照针刺的不同穴位分为三阴交、委中、悬钟、水沟、阳陵泉、昆仑、足三里和对照组共8组,每个亚组各5只SD大鼠,观察体内炎症因子的表达情况。结果针刺水沟和阳陵泉两个特定穴可明显抑制Caspase-1、IL-1β的激活,减少SCI空洞面积,减轻神经元的焦亡,SCI功能恢复较好。
5.3 针刺调节NLRP3炎症小体介导的焦亡通路对脑卒中的影响
NLRP3炎症小体介导的焦亡通路中的炎性细胞因子与脑卒中大鼠的神经损伤表现密切相关,而在实验中则印证了这一说法,即针刺干预可以抑制脑卒中大鼠脑组织中炎性蛋白表达量,达到实现神经恢复的作用。针刺的抗炎作用在其他中枢神经系统相关实验中也同样得到证实。这说明针刺的抗炎作用在CNS疾病治疗过程中十分重要,可有效地改善CNS疾病的临床表现,作用实质可能是通过对神经炎症因子的抑制而发挥良性调整作用。
刘昊等[44]研究ICH大鼠中NLRP3、IL-1β和IL-18通过针灸治疗后含量的变化,实验大鼠分为假手术组、模型组与针灸组各10只,针灸组大鼠通过曲鬓穴及百会穴进行干预。结果发现不仅Bederson评分下降,且缺血侧皮层小胶质细胞含量、NLRP3的mRNA表达、IL-1β和IL-18的相对蛋白表达水平均有所降低(P<0.01),说明针灸在减少小胶质细胞活化、抑制NLRP3炎症反应中起到神经保护作用。王磊[45]研究针刺干预ICH对不同再灌注时间炎症因子的抑制作用,将实验大鼠分为假手术组、模型组和电针组,电针组采用电针百会穴、人中穴的干预方法,分别观察再灌注0 min、6 h、24 h各时间节点血清IL-18和IL-1β的含量变化。结果显示:ICH大鼠经再灌注6 h后IL-18和IL-1β含量显著降低,且电针治疗后其在血清中的含量均同样减少,差异具有统计学意义(P<0.05)。
Sha R等[46]为探究电针对脑卒中的神经保护作用是否与抗炎机制相关,将实验大鼠随机分为5组,其中电针组选取大鼠左肢上的外关穴与足三里穴进行电针治疗30 min,于1 d、3 d、5 d与7 d观察大鼠炎症相关因子的表达情况。根据Nissl染色评估焦亡神经元死亡情况,采用蛋白印迹分析和PCR方法检测NLRP3炎症小体和Caspase-1表达水平,ELISA法评估梗死周围皮层中的IL-18和IL-1β水平。实验结果:电针组较其他组别而言,大大降低了NLRP3、Caspase-1、IL-18和IL-1β水平,抑制了相关因子在大鼠皮层中的表达。这些结果表明,电针抑制炎症相关因子的能力至关重要,能够增加大鼠存活率,减轻神经功能障碍,实现神经保护的目的。
邓寒冰等[47]将48只大鼠分为申脉+照海组、阳陵泉+配穴组、关元组与模型组,并予以相应的穴位进行电针刺激,应用尼氏染色法检测脑卒中大鼠脑损伤组织中NLRP3、Caspase-1及pro-Caspase-1表达情况,结果显示电针刺激后申脉+照海组、阳陵泉+配穴组、关元组较模型组NLRP3与Caspase-1蛋白水平降低(P<0.05)。江涛等[48]研究NLRP3炎症小体的抑制作用是否与电针刺激的神经保护有关,选取局灶性脑缺血损伤SD大鼠,采用蛋白质免疫印迹法和免疫荧光染色法,评估再灌注后脑组织中NLRP3炎症小体的表达含量。得出NLRP3炎症小体的含量经脑缺血再灌注后逐渐增加,而炎症小体介导的炎性反应通过电针刺激后程度减弱,并调节了抗炎与促炎因子之间的平衡。NLRP3炎症小体则被证明在脑缺血以及再灌注损伤的神经元死亡和行为缺陷中具有重要作用。
6 总结
综上所述,本研究通过对NLRP3炎症小体介导的细胞焦亡机制进行总结,分析并论述了针刺干预该信号通路对中枢神经系统疾病的重要影响,可以肯定的是针刺通过调节炎症信号通路对治疗中枢神经系统疾病方面发挥着卓著的疗效,能够起到一定的神经修复作用。但中枢神经系统疾病发病机制较为复杂,笔者仅从针刺干预NLRP3炎症小体介导的焦亡通路这一方面进行了探讨,尚未对其他作用机制展开研究。为此,今后将以NLRP3炎症小体为重心,进一步深化其介导的细胞焦亡内在机理,结合其他影响机制,将探究的方向侧重于各机制彼此之间的联系,同时为明确其作用方式,需进行大量实验证实,为临床治疗提供更充分的实验依据,这有助于为针刺防治中枢神经系统疾病寻求新的干预靶点。
