IGFBP-2预测局部晚期口腔鳞状细胞癌预后和化疗反应的临床价值
2023-01-07余周庆童国勇徐佳王曦戈春城
余周庆,童国勇,徐佳,王曦,戈春城
(恩施土家族苗族自治州中心医院 口腔科,湖北 恩施 445000)
头颈部鳞状细胞癌是世界上最致命的癌症之一,以口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)亚型最为常见[1],其特点是转移和复发率高,对传统化疗耐药[2]。手术切除是早期OSCC患者的首选治疗方法。但对于晚期OSCC患者,主流治疗方案是综合治疗,术前诱导缓解、手术及术后放疗的效果已得到广泛认可[3-5]。然而术前诱导化疗耐药问题一直是研究热点,评估晚期OSCC患者的化疗效果和生存率将有助于优化治疗策略。目前已有多项文献报道了OSCC化疗和预后的生物标志物,但只有少数生物标志物得到了充分数据的验证和支持[6-8],例如白细胞介素24高表达与头颈部鳞状细胞癌总生存时间较长显著相关,但是其在早期诊断或监测疾病方面效果并不令人满意[7]。事实上,通过常规测试(如血液生化)预测化疗反应以及识别有效的标志物,将有相当大的临床益处。胰岛素样生长因子结合蛋白-2(insulin-like growth factor binding protein-2,IGFBP-2)最初被认为是一种结合并调节胰岛素样生长因子(insulin-like growth factor,IGF)-Ⅰ和IGF-Ⅱ生长激素活性的蛋白[9]。最近有研究证实,IGFBP-2通过与整合素结合可激活多条信号通路,导致多种肿瘤细胞的增殖、侵袭和耐药[10-12]。然而到目前为止,还没有研究关注IGFBP-2在OSCC进展和预后中的作用。在本研究中,我们旨在探索IGFBP-2作为潜在的预后和化疗生物标志物的作用。
1 对象与方法
1.1 研究对象
2012年1月至2017年5月,作者从我院耳鼻咽喉科和口腔颌面外科的143例局部晚期OSCC患者(晚期OSCC组,临床分期为Ⅲ~Ⅳa期,男81例,女62例,年龄25~86岁)、129例临床分期为Ⅰ~Ⅱ期的OSCC患者(男75例,女54例,年龄24~91岁)和152例健康对照者(男75例,女77例,年龄25~90岁)在获得机构伦理(伦理批号:201208)批准和患者知情书面同意后获取血清样本,此外所有OSCC患者进行了组织活检。健康对照组包含20例健康口腔组织,取自接受整容手术的志愿者(男6例,女14例,年龄25~57岁),这些患者没有任何感染性或炎症性口腔病变。纳入标准:经病理组织学证实为OSCC的患者,其临床资料完整,东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分,既往未接受过手术或放化疗。排除标准:合并其他恶性肿瘤、肺转移、自身免疫性疾病、内分泌系统疾病、严重心脑血管疾病、治疗禁忌证、无法配合精神障碍治疗、退出实验或失去随访的患者。
1.2 治疗方案
所有晚期OSCC患者接受诱导化疗方案如下:d1:静脉滴注多西他赛(中国齐鲁药业股份有限公司,H20041129),剂量为75 mg·m-2;d1~3:静脉滴注75 mg·m-2顺铂(中国齐鲁制药股份有限公司,H20023461);d1~5:静脉滴注5-氟尿嘧啶(中国上海旭东海浦制药有限公司,H31020593),剂量为750 mg·m-2。每3周给药1次,共2个周期。诱导完成至少2周后进行手术。随访治疗:对原发病灶进行根治性手术和全颈淋巴结清扫,然后进行适当的重建。术后5周 开始放射治疗,标准适形或调强放射治疗剂量为1.8或2 Gy·d-1,每周5 d,共6周,总剂量为54~60 Gy。
1.3 治疗反应判断
在诱导化疗结束2周后(手术前),根据世界卫生组织的实体瘤疗效评估标准(Response Evaluation Criteria in Solid Tumors Version 1.1,RECIST 1.1)[13]评估治疗反应。疗效评估和相应症状如下:完全缓解(completed response,CR)为病变完全消失,部分缓解(partial response,PR)为诱导化疗后体积减少30%,疾病进展(progressive disease,PD)为基线病变最长直径增加至少20%或产生新病变,稳定疾病(stable disease,SD)为基线病变的最长直径减少至小于PR或增加至小于PD。根据常见不良反应事件评价标准4.0版(Common Terminology Criteria for Adverse Events Version 4.0,CTCAE 4.0版)[14]评估毒性。根据疗效,我们将CR/PR定义为治疗有反应,SD/PD定义为治疗无反应。
1.4 随访
第1年每2个月随访1次,第2年每3个月随访1次,在接下来的3~5年中,每6个月进行1次随访。总生存(overall survival,OS)时间定义为从确诊日期到死亡的时间。
1.5 检测指标
1.5.1 资料收集 详细的临床病史,包括年龄、性别、症状、病程、不良的口腔习惯(如吸烟、咀嚼槟榔)、饮酒、病变的临床细节、组织学分级、临床分期、疗程、结果和复发。肿瘤(T)分期、淋巴结(N)状态和临床分期根据1997年美国癌症联合委员会系统TNM标准[15]进行分类。
1.5.2 免疫组织化学染色 随机选取20例晚期OSCC组织、20例Ⅰ~Ⅱ期OSCC组织,年龄、性别构成与20例健康对照组织的来源患者相匹配(P>0.05)。将组织固定在10%中性缓冲福尔马林中,并按照标准程序进行组织病理学检查。切下5 μm厚的切片,在二甲苯中脱蜡,然后在梯度递减的乙醇溶液中水合。使用EZ抗原修复系统(美国BioGenex)在95 ℃的柠檬酸盐缓冲液(pH 6.0)中加热样本15 min进行抗原热修复,然后用过氧化物酶阻断剂中和内源性过氧化物酶5 min,之后用标准亲和素-生物素过氧化物酶对鼠抗人IGFBP-2(1∶400稀释度,英国Biorbyt公司)进行免疫染色。通过H评分评估IGFBP-2表达。面积百分比阳性率分级:<10%=0,10%~25%=1,26%~50%=2,51%~75%=3,>75%=4。强度评估分级:0=无,1=轻度,2=中度,3=强染色。面积百分比分数(0~4)乘以强度分数(0~3)计算H评分,0~4分为阴性染色,5~12为阳性染色[16]。取5个最佳视野用于解释免疫组织化学结果。
1.5.3 酶联免疫吸附测定 所有确诊的OSCC患者术前和健康对照组入组时均采集血样,另外对于晚期OSCC组患者在评估诱导化疗反应时采集血样。将血样在室温下放置60 min,并经3 500 r·min-1离心15 min。将上清液等分,然后储存在-80 ℃,直到使用。使用人IGFBP-2酶联免疫吸附测定试剂盒测量血清IGFBP-2水平,对每个采集的样本进行3次重复检测。
1.6 统计学处理
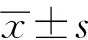
2 结 果
2.1 免疫组织化学结果比较
健康对照组织(n=20)、临床分期Ⅰ~Ⅱ期OSCC组织(n=20)和晚期OSCC组织(n=20)中IGFBP-2蛋白阳性表达率分别为0(0/20)、20.0%(4/20)、80.0%(16/20),其中晚期OSCC组织中IGFBP-2蛋白阳性表达率最高,与其他2组比较差异有统计学意义(χ2=31.198,P<0.001),见图1。
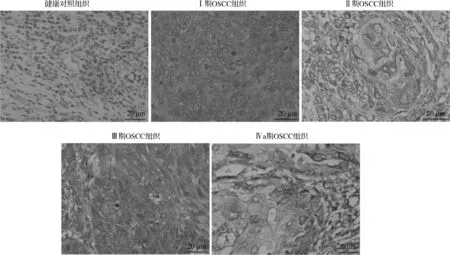
图1 免疫组织化学染色典型图片(×400)Fig 1 Typical picture of immunohistochemical staining(×400)
2.2 3组受试者血清IGFBP-2水平比较
晚期OSCC组患者血清IGFBP-2水平显著高于152例健康对照者[423.28(338.52,534.36)ng·ml-1vs. 71.80(51.30,80.70)ng·ml-1,P<0.001]和129例Ⅰ~Ⅱ期OSCC患者[423.28(338.52,534.36)ng·ml-1vs. 154.33(138.23,186.71)ng·ml-1,P<0.001]。经ROC曲线分析血清IGFBP-2用于诊断OSCC以及区分局部晚期OSCC的AUC分别为0.844(95%CI0.807~0.880,灵敏度为100.0%,特异度为52.3%)、0.954(95%CI0.932~0.975,灵敏度为84.3%,特异度为91.0%)。然而血清IGFBP-2用于早期OSCC诊断的AUC仅为0.678(95%CI0.627~0.749,灵敏度为72.6%,特异度为47.3%)。见图2。
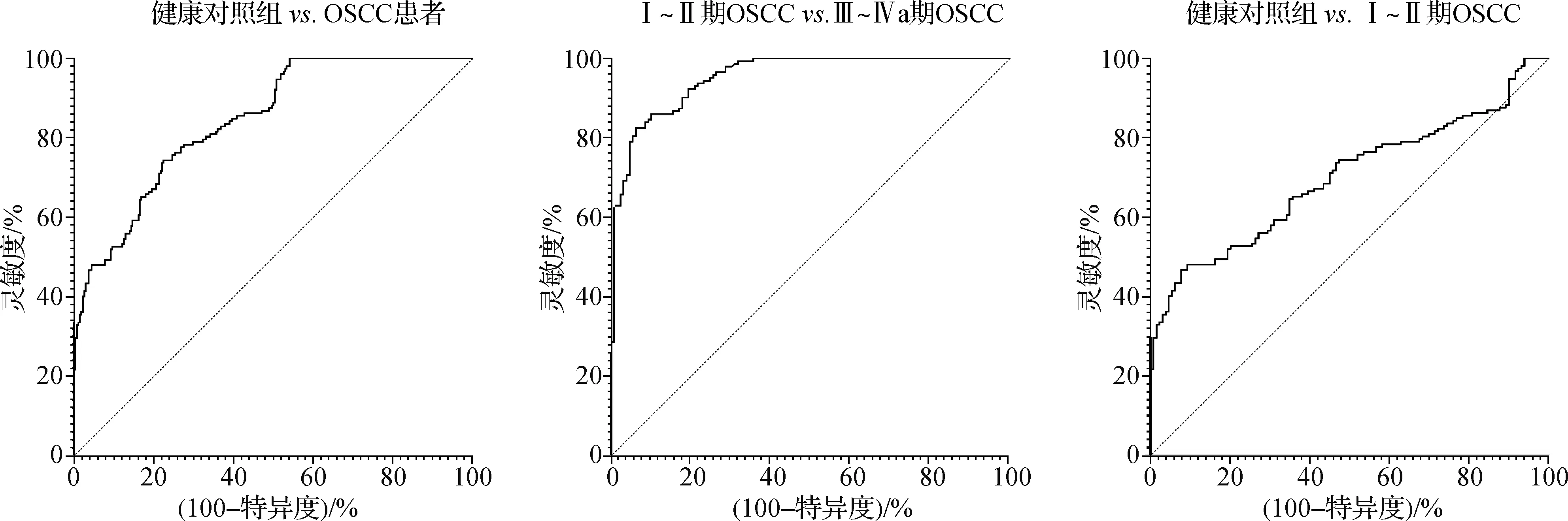
图2 ROC曲线分析治疗前血清IGFBP-2的诊断价值Fig 2 ROC curve analysis of the diagnostic value of serum IGFBP-2 before treatment
2.3 局部晚期OSCC患者血清IGFBP-2水平与诱导化疗反应的关系
治疗后,143例局部晚期OSCC患者中CR 29例,PR 68例,SD 31例,PD 15例。治疗期间主要不良反应为恶心、呕吐、脱发、白细胞减少等轻微不良反应。在积极对症治疗后观察到97例患者病情缓解(有反应亚组)。与治疗前相比,治疗后血清IGFBP-2水平显著降低[293.62(216.85,394.77)ng·ml-1vs. 423.28(338.52,534.36)ng·ml-1,Z=-7.374,P<0.001]。此外无反应亚组患者治疗前血清IGFBP-2水平显著高于有反应亚组[508.64(426.92,650.0)ng·ml-1vs. 347.36(253.08,460.20)ng·ml-1,Z=-5.324,P<0.001]。进一步构建ROC曲线,治疗前血清IGFBP-2在预测疗效方面的AUC值为0.776(95%CI:0.699~0.853),最佳临界值为397.54 ng·ml-1,敏感度为89.1%,特异度为59.8%(图3)。
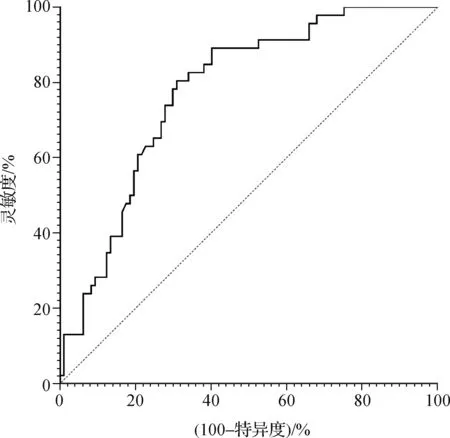
图3 ROC曲线分析治疗前血清IGFBP-2在预测诱导化疗反应方面的价值Fig 3 ROC curve analysis of the value of serum IGFBP-2 in predicting induced chemotherapy response before treatment
2.4 局部晚期OSCC患者血清IGFBP-2水平与生存预后的关系
中位随访时间为59.0个月(范围为1~78个月),OS率为57.34%(82/143)。以治疗前血清IGFBP-2的中位值(423.28 ng·ml-1)为截点,将其分为高表达亚组(≥423.28 ng·ml-1)和低表达亚组(<423.28 ng·ml-1)。生存分析显示,与低表达亚组患者相比,高表达亚组患者的OS较短(χ2=39.474,P<0.001)(图4)。单变量COX回归分析表明BMI、诱导化疗反应和血清IGFBP-2表达是晚期OSCC患者的重要预后因素(P<0.05),另外在多变量COX分析中纳入了P<0.01的因素,结果表明血清IGFBP-2水平升高是晚期OSCC患者OS的独立危险因素(表1)。

表1 单因素和多因素COX回归分析Tab 1 Single factor and multi factor COX regression analysis

图4 Kaplan-Meier生存曲线分析局部晚期OSCC患者血清IGFBP-2水平与OS的关系Fig 4 Kaplan-Meier survival curve analysis of the relationship between serum IGFBP-2 level and OS in patients with advanced OSCC
3 讨 论
TPF(多西紫杉醇、顺铂和5-氟尿嘧啶)诱导化疗方案已被证明对晚期OSCC患者有益[3,5]。然而,一些研究表明,OSCC对这种治疗的反应有限;这些报道强调了识别与治疗反应相关的生物标志物的重要性[6-8]。在我们的研究中,IGFBP-2在局部晚期OSCC患者血清中表达水平普遍升高,对局部晚期OSCC具有良好的诊断价值。此外,治疗后血清IGFBP-2水平显著降低,且IGFBP-2高表达的OSCC患者化疗不敏感的风险增加,这反过来又预示着较差的OS预后。我们的研究首次强调了IGFBP-2作为OSCC辅助化疗和预后评估的生物标志物的作用,这对未来的医学应用具有重要意义。
IGF是一种具有多种生物学功能的调节肽,如细胞增殖、分化和抗凋亡[9-10]。IGF系统由两个肽配体(IGF-Ⅰ和IGF-Ⅱ)、6个高亲和力IGF结合蛋白(IGFBP-1~IGFBP-6)和两个IGF受体(IGF-ⅠR和IGF-ⅡR)组成[9]。IGFs的作用由IGFBPs以积极或消极的方式调节,这具体取决于组织类型和生理状态[10-11]。IGFBP家族的蛋白质可同时调节IGF和整合素信号,并且是其他肿瘤类型中细胞生长、侵袭和抵抗的介质[12,14]。在人体中,IGFBP-3、IGFBP-2是血清中含量最高的2种IGFBP[17]。目前IGFBP-3与OSCC高度相关的结论已基本被证实,但是IGFBP-2是否可作为OSCC诊断和预后生物标志物尚缺乏明确证据。与IGFBP-3抗肿瘤活性[18]不同,IGFBP-2可促进肿瘤发生,癌细胞侵袭、转移和肿瘤干细胞增殖[10-11]。由于IGFBP-2是一种分泌蛋白[10],之前的研究观察到,血清IGFBP-2在各种类型癌症中的表达水平增加,包括胶质瘤[16,18]、肝细胞癌[11]、肾透明细胞癌[12],本研究结论与之基本相符,在本研究中我们检测了健康对照组、早中期和局部晚期OSCC患者的血清IGFBP-2水平,其中局部晚期OSCC患者血清IGFBP-2水平显著升高。这表明IGFBP-2可能参与了OSCC的疾病进展。此外高血清IGFBP-2水平与肿瘤组织IGFBP-2阳性表达有关,而且与治疗前相比,治疗后血清IGFBP-2水平显著降低,因此我们推断血清IGFBP2可能部分来源于肿瘤细胞。但是我们无法测量联合治疗后残余肿瘤组织中IGFBP-2的表达水平,因此,需要进一步探讨血清IGFBP-2的主要来源。
在已发表的报道中,IGFBP-2可调节许多细胞信号通路。例如通过IGFBP-2沉默,口腔癌细胞OC3和OC3-I5的迁移和侵袭能力以及包括转录因子Twist和Snail在内的上皮-间充质转化相关蛋白均降低[19]。在本研究中,我们首次评估了血清IGFBP-2在局部晚期OSCC患者中的预后作用,并证明血清IGFBP-2高水平是局部晚期OSCC患者的一个独立不良预后因素。此外,我们的临床研究小组和其他研究小组的研究结果都已经表明,绝大多数OSCC对现有的化疗方案有耐药风险[3-5]。IGFBP-2已被证明在许多器官系统的肿瘤发生、进展和化疗耐药中起着关键作用,并且是OSCC中多个关键激活信号通路的已知调节剂,例如Tsai等[20]利用干扰RNA和重组蛋白技术确认了IGFBP-2在口腔癌转移中的积极促进作用,尿激酶型纤溶酶原激活剂被证实是IGFBP-2的下游靶点,可促进口腔癌的中期转移。此外上调IGFBP-2表达可促进细胞增殖、迁移和侵袭,这些都与IGFBP-2促转移潜能有关[19]。Hur等[21]在一部分原发性食管腺癌中观察到IGFBP-2高表达,而且敲除IGFBP-2会以血清依赖性方式增加肿瘤细胞对顺铂的敏感性,这种化学增敏作用机制可能与IGFBP-2沉默可激活IGF1诱导的蛋白激酶B通路,并失活顺铂诱导的胞外信号调节的激酶通路有关。基于这些临床前分子机制,我们也研究了其在预测局部晚期OSCC诱导化疗耐药中的效用。虽然IGFBP-2的表达在从健康对照组织到OSCC的进展所代表的疾病谱中有所不同,但本研究纳入的局部晚期OSCC组织和血清样本均有非常高的IGFBP-2表达水平。与获得治疗CR/PR的患者相比,未获得有效治疗反应的患者基线血清样本中IGFBP-2水平更高,这表明一些肿瘤的化疗耐药机制可能与IGFBP-2高表达有关。
综上所述,目前的研究表明,血清IGFBP-2在局部晚期OSCC患者中上调,可作为局部晚期OSCC诊断、治疗和预后的生物标志物。然而,本研究仍存在一些不足之处,例如IGFBP-2在口腔鳞状细胞癌细胞耐药中的作用机制尚不清楚。此外,该研究的样本规模较小,需要进一步扩大样本以验证我们的结果。
