浅表食管鳞状细胞癌组织中FGF-2、VASH1的表达情况及其与患者内镜下黏膜剥离术后复发转移的相关性▲
2022-12-30王军岐申骏龙付小伟
王军岐 骆 晴 申骏龙 付小伟
(宝鸡市中心医院胸外科,陕西省宝鸡市 721008)
食管癌是我国高发癌症之一,目前其发病机制尚不明确,普遍认为可能与生活方式、饮食习惯、人乳头状瘤病毒感染等有关[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)患者数量占食管癌患者数量的90%以上[1]。随着内镜检查技术的进步,早期ESCC和浅表ESCC的检出率越来越高。内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)是治疗早期和浅表ESCC的标准方法[2]。成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)是一种促细胞生长因子,可诱导内皮细胞增殖,促进新生血管形成,其在肿瘤细胞的增殖和侵袭过程中发挥重要作用[3]。血管生成抑制蛋白1(vasohibin 1,VASH1)是近年来新发现的一种血管生成负反馈调节因子,主要表达于血管内皮细胞,具有抑制肿瘤血管生成的作用[4]。关于FGF-2、VASH1表达与浅表ESCC关系的研究已有报告,但关于两者与浅表ESCC患者ESD后复发转移之间关系的研究少见。基于此,本研究探讨FGF-2、VASH1表达与浅表ESCC患者ESD后复发转移的相关性,旨在为患者的预后评估提供新方法。
1 资料与方法
1.1 数据库分析 从TCGA数据分析和可视化网站GEPIA数据库(http://gepia.cancer-pku.cn/index.html)中下载浅表ESCC组织及正常食管组织中FGF-2、VASH1的mRNA表达情况,分析FGF-2、VASH1 mRNA在浅表ESCC组织及正常食管组织中的表达差异。
1.2 临床研究
1.2.1 临床资料:选择2014年1月至2015年6月在本院行ESD治疗的92例浅表ESCC患者的临床资料及病理组织。其中男性53例、女性39例,年龄29~73(51.24±8.47)岁。纳入标准:(1)手术标本经病理诊断为原位癌(Tis)或T1期ESCC;(2)均为首次治疗,术前未接受任何治疗;(3)临床资料和随访记录完整,癌组织标本均保存完好。排除标准:(1)合并其他恶性肿瘤病史;(2)合并高血压、糖尿病或传染性疾病患者。从上述92例患者中选取50例患者,收集其癌旁正常食管组织(距离癌组织边缘≥5 cm)标本作为对照。本研究获得本院医学伦理委员会批准。
1.2.2 资料收集:通过查阅住院病历和复诊记录收集患者的相关资料,包括年龄、性别、分化程度、有无管腔狭窄、浸润深度、脉管癌栓、淋巴结转移情况。
1.2.3 免疫组织化学法检测:检测浅表ESCC组织及正常食管组织中FGF-2、VASH1蛋白的表达情况。试剂包括免疫组织化学链霉亲和素-过氧化物酶(streptavidin-perosidase,SP)试剂盒(批号:20140802)、兔抗人试剂盒(一抗,批号:20150314)、羊抗兔试剂盒(二抗,批号:20141126),均购自Abcam公司。从-80 ℃环境中取出冻存的组织标本,用10%的福尔马林溶液固定,常规石蜡包埋,制作成4 mm切片后进行脱蜡处理。脱蜡后用3%过氧化氢溶液孵育10 min,使用PBS洗涤3次(3 min/次),使用柠檬酸盐缓冲溶液高温抗原修复后,再用PBS洗涤3次(3 min/次),滴加一抗(稀释比例1 ∶200)1滴,4 ℃孵育过夜,滴加二抗(稀释比例1 ∶1 000)1滴,37 ℃孵育60 min,滴加二氨基联苯胺染色,苏木素复染,梯度酒精脱水、二甲苯透明、中性树胶封片。用PBS代替一抗重复上述试验作为阴性对照。在电子显微镜(济南泰医生物技术有限公司,型号:CX23)下观察染色情况,随机选取5个有代表意义的视野(×100),每个视野计数200个细胞进行评价,最终结果取5个视野的平均值。结果判定标准:按染色强度评分,其中无染色为0分,浅黄色为1分,黄色或黄棕色2分,棕褐色为3分;按阳性细胞百分比评分,其中阴性记0分,<25%记1分,25%~<50%记2分,50%~75%记3分,>75%记4分。取两种评分的乘积作为评估结果,≤1分为表达阴性,>1分为表达阳性;≥3分为高表达,<3分为低表达。
1.2.4 随访:患者ESD后随访5年,观察患者复发转移情况。复发转移判断标准[5]为,患者门诊复查时进行CT或超声等影像学检查,检查结果提示原食管瘤复发、吻合口复发,腹腔和纵隔淋巴结转移,或骨、肺、胸膜等转移。本研究中,术后复发患者均经食管镜检查证实吻合口复发,并有病理依据;92例患者中,发生复发转移54例。
1.3 统计学分析 采用SPSS 25.0软件进行数据录入与统计分析。计量资料以(x±s)表示,组间比较采用两独立样本t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher确切概率法。采用Pearson检验进行相关性;采用Logistic回归模型进行影响因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 浅表ESCC组织及正常食管组织中FGF-2和VASH1 mRNA的表达水平 从GEPIA数据库中共下载到182例浅表ESCC组织和286例正常食管组织的数据,对两种组织的FGF-2和VASH1 mRNA表达水平进行分析,结果显示浅表ESCC组织与正常食管组织的FGF-2和VASH1 mRNA表达水平比较,差异均无统计学意义(均P>0.05),见表1。 浅表ESCC组织中FGF-2与VASH1 mRNA的表达水平呈正相关(r=0.460,P<0.001),见图1。
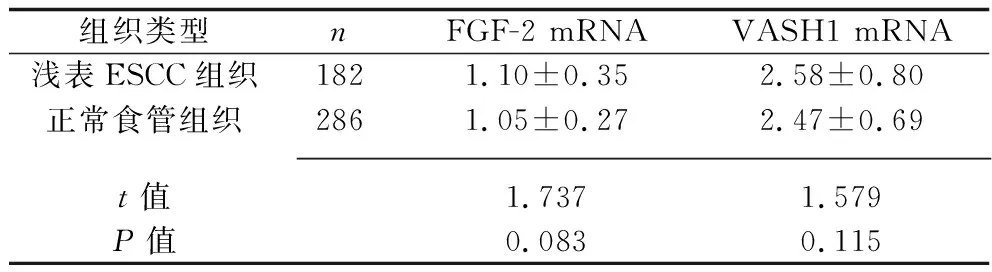
表1 浅表ESCC组织及正常食管组织中FGF-2和VASH1 mRNA相对表达水平的比较(x±s)
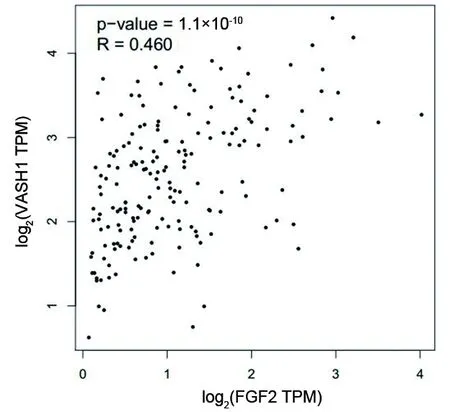
图1 GEPIA数据库中浅表ESCC组织FGF-2与VASH1 mRNA表达相关性的分析结果
2.2 浅表ESCC组织及正常食管组织中FGF-2、VASH1蛋白的表达情况 免疫组织化学法检测结果显示,FGF-2蛋白主要表达于细胞质(见图2-A、图2-B),VASH1蛋白主要表达于细胞质和细胞膜(见图2-C、图2-D)。浅表ESCC组织中FGF-2蛋白、VASH1蛋白的阳性表达率均高于正常食管组织(均P<0.05),见表2。浅表ESCC组织中FGF-2与VASH1蛋白阳性表达率呈正相关(r=0.388,P<0.001)。

图2 FGF-2、VASH1蛋白在正常食管组织及浅表ESCC组织中的表达(SP染色,×100)注:A、C为分别FGF-2蛋白、VASH1在正常食管组织中的表达情况;B、D分别为FGF-2蛋白、VASH1蛋白在浅表ESCC组织中的表达情况。
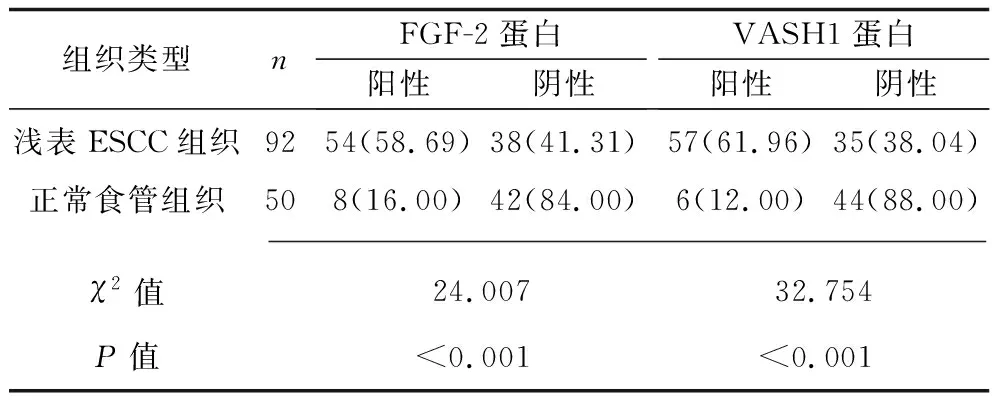
表2 浅表ESCC及正常食管组织中FGF-2、VASH1蛋白表达情况的比较[n(%)]
2.3 FGF-2和VASH1蛋白表达与浅表ESCC患者临床病理特征之间的关系 不同年龄段、性别、管腔狭窄情况、浸润深度的患者之间,FGF-2、VASH1蛋白的阳性表达率差异均无统计学意义(均P>0.05)。低+中低分化程度、存在脉管癌栓、发生淋巴结转移的患者FGF-2、VASH1蛋白的阳性表达率更高(均P<0.05),见表3。
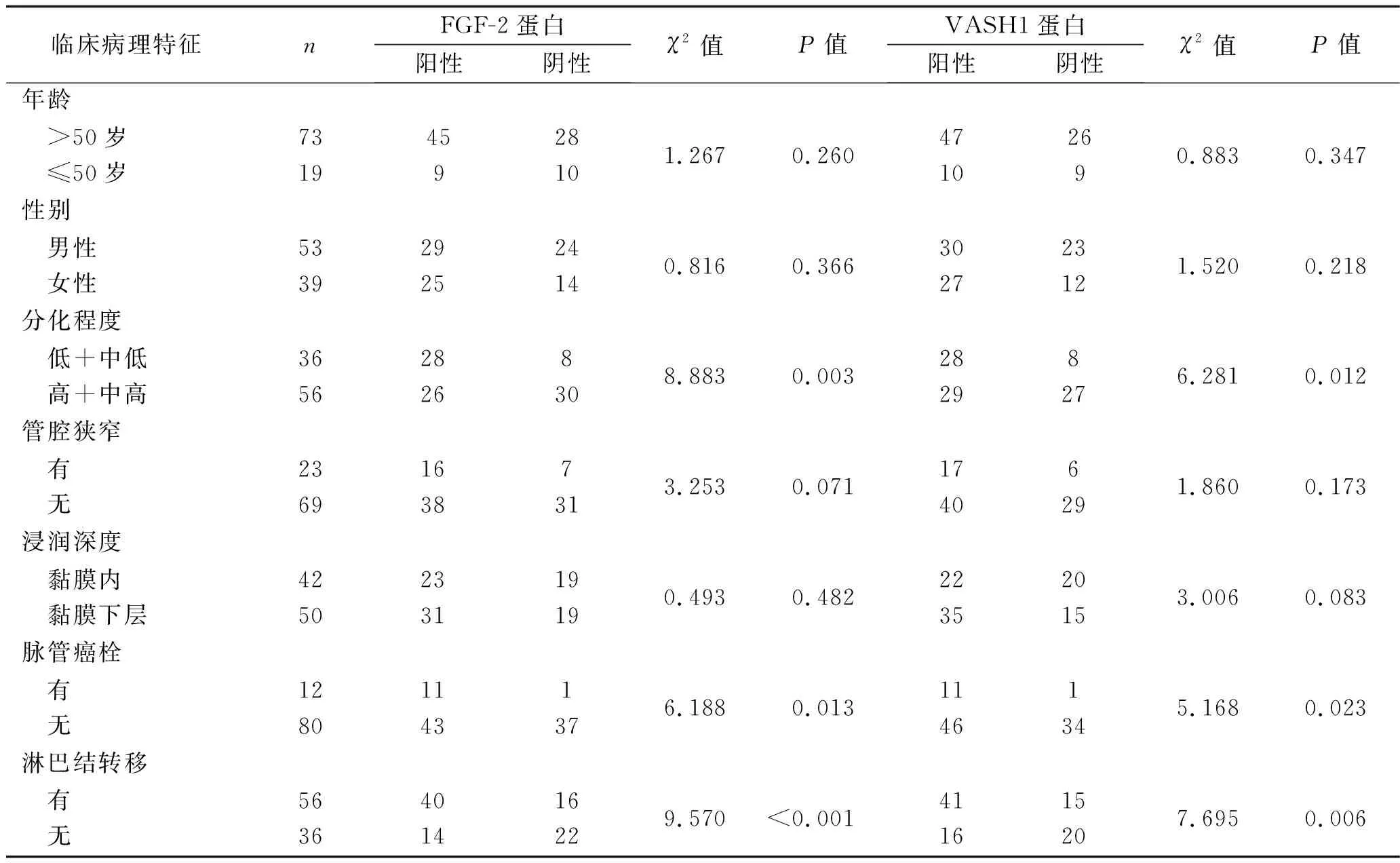
表3 FGF-2、VASH1蛋白表达与浅表ESCC患者临床病理特征之间的关系(n)
2.4 不同FGF-2、VASH1蛋白表达水平浅表ESCC患者ESD后复发转移率的比较 FGF-2低表达组49例,FGF-2高表达组43例,FGF-2低表达组患者术后复发转移率为40.82%(20/49),低于FGF-2高表达组的74.42%(32/43)(χ2=10.523,P=0.001);VASH1低表达组45例,VASH1高表达组47例,VASH1低表达组患者ESD后复发转移率为42.22%(19/45),低于VASH1高表达组的70.21%(33/47)(χ2=7.329,P=0.007)。
2.5 浅表ESCC患者ESD后复发转移的影响因素 以浅表ESCC患者ESD后是否发生复发转移为因变量,以可能影响复发转移的因素即年龄、性别、分化程度、管腔狭窄、浸润深度、脉管癌栓、淋巴结转移、FGF-2及VASH1蛋白的表达水平为自变量,纳入Logistic回归模型中进行单因素分析(变量赋值情况见表4)。结果显示,FGF-2蛋白的表达水平、VASH1蛋白的表达水平、脉管癌栓、分化程度、淋巴结转移是影响浅表ESCC患者ESD后复发转移的因素(均P<0.05),见表5。进一步以单因素分析中具有统计学意义的变量作为自变量(赋值同单因素分析),纳入多因素Logistic回归模型中进行分析。结果显示,FGF-2高表达、VASH1高表达、发生脉管癌栓、分化程度低和中低、发生淋巴结转移是浅表ESCC患者ESD后复发转移的独立危险因素(均P<0.05),见表6。

表4 变量赋值情况

表5 影响浅表ESCC患者术后复发转移危险因素的单因素分析

表6 影响浅表ESCC患者术后复发转移危险因素的多因素分析
3 讨 论
食管癌是一种常见的消化道肿瘤,全球每年约有30万人死于食管癌[6]。各国食管癌的发病率和死亡率各异,我国是高发地区之一,每年死于食管癌的患者约15万人[7]。食管癌的病因尚不明确,多认为可能与遗传、亚硝胺类摄入过量、真菌感染、微量元素缺乏、食管慢性炎症等有关[8-9]。浅表ESCC是指来源于食管黏膜及黏膜下层的肿瘤,包括Tis、黏膜肿瘤(T1a)和黏膜下层肿瘤(T1b)[10],因此本研究纳入的病例均为Tis或T1期患者。研究表明,FGF-2是一种促血管生成因子,能够通过激活多种信号通路发挥生物活性,其可促进内皮细胞生长、迁移,同时也能促进肿瘤血管生成,在肿瘤的发生和发展过程中起重要作用[11]。何岩等[12]研究发现,FGF-2在肾癌组织及肾癌细胞中高表达,敲除FGF-2表达后,肾癌细胞ACHN和786-O的增殖被抑制,而肾癌细胞中的磷酸化蛋白激酶B蛋白和磷酸化细胞外信号调节激酶蛋白表达下降,推测FGF-2可能通过磷脂酰肌醇-3-激酶/蛋白激酶B信号通路调控肾癌细胞增殖。另有研究显示,FGF-2可通过调节金属蛋白酶及血管内皮生长因子参与肿瘤的发生[13]。研究发现,肿瘤细胞和间质细胞等分泌的促血管生成因子和抑制血管生成因子相互作用、共同调节,促使血管生成参与肿瘤的发生和发展过程[14]。本研究结果显示,FGF-2蛋白主要表达于细胞质,浅表ESCC组织中FGF-2蛋白的阳性表达率高于正常食管组织,低+中低分化程度、存在脉管癌栓、发生淋巴结转移的患者FGF-2蛋白的阳性表达率更高,且FGF-2低表达组ESCC患者术后复发转移率低于FGF-2高表达组(均P<0.05)。这提示FGF-2可能参与浅表ESCC的发生和发展,与ESCC术后复发转移有关,高表达FGF-2可能提示预后不良。结合上述FGF-2的作用,分析原因可能为FGF-2参与了浅表ESCC的新生血管生成,对肿瘤细胞的迁移、侵袭起促进作用,但其具体的作用机制有待深入研究。
VASH1是一种内源性血管生成抑制剂,主要表达于内皮细胞终止区[15]。本研究结果显示,浅表ESCC组织中VASH1蛋白的阳性表达率高于正常食管组织(P<0.05),与时军利等[16]的研究结果相似。进一步研究显示,低+中低分化程度、存在脉管癌栓、发生淋巴结转移的患者VASH1蛋白的阳性表达率更高,且VASH1低表达组ESCC患者ESD后复发转移率低于VASH1高表达组(P<0.05),提示VASH1可能与ESCC的发生和发展有关。最近的研究结果表明,肿瘤血管生成能力增强时可反馈性使VASH1生成增多,即血浆VASH1水平升高可反映肿瘤血管的生成能力,因此VASH1水平升高时提示存在缺氧微环境,而缺氧是上皮-间充质转化的触发因素之一,可诱导上皮-间充质转化的发生,促进肿瘤细胞的侵袭、转移[17]。这可能是VASH1水平升高与浅表ESCC的发生、发展及不良预后有关的原因。此外,本研究结果还显示浅表ESCC组织中FGF-2与VASH1的mRNA表达及蛋白表达水平均呈正相关(P<0.05),提示FGF-2、VASH1可能相互作用,从而共同参与ESCC的发生和发展。
本研究结果还表明,在校正其他临床病理特征等混杂因素后,FGF-2高表达、VASH1高表达是浅表ESCC患者ESD后复发转移的独立危险因素(均P<0.05),FGF-2高表达、VASH1高表达的ESCC患者ESD后发生复发转移的风险分别为FGF-2低表达、VASH1低表达患者的2.461倍、2.426倍,进一步说明了这两个指标与ESCC患者的预后密切相关。因此,检测FGF-2、VASH1的表达可能对评估ESCC患者ESD后复发转移情况具有重要作用,有助于早期加强干预,从而改善患者预后。
综上所述,FGF-2、VASH1在浅表ESCC组织中均呈高表达,两者均与浅表ESCC患者的病情程度有关,且是影响患者ESD后复发转移的独立危险因素。后续将进行细胞或动物研究,深入探讨两者的作用机制,以期为改善浅表ESCC患者预后提供理论指导。
