文冠果果壳提取物对植物病原菌的抑菌活性
2022-12-22詹雪娇
詹雪娇
(张掖市甘州区林业技术中心推广站,甘肃 张掖 734000)
1 引言
植物病原菌属于主要的果蔬致病菌种,一旦患病,便会降低种植果蔬的生产数量和质量,严重情况下可能会导致植株的死亡,给种植主体造成较大经济损失[1]。化学农药尽管能够获得显著植物病原菌治疗效果,但是容易导致食用果蔬农药含量超标及自然环境污染问题。而文冠果果壳提取物中的化学成分对于植物病原菌有一定治疗效果,有必要强化对于文冠果果壳的应用,从而实现有效抑菌及杀菌。同时,文冠果的含油量较为丰富,如果不加以良好应用,必然会造成一定程度的资源浪费,可见在植物病原菌预防及治疗中应用文冠果果壳提取物,还能够解决文冠果果壳利用率较低导致的资源浪费问题,从而实现对于文冠果果壳的灵活应用。
2 文冠果化学成分及生物活性
2.1 文冠果化学成分
文冠果化学成分繁琐复杂,主要包括三萜类化合物、黄酮类成分、苯丙素类化合物、甾类成分、酚酸类成分、脂肪酸类成分等[2]。
其中,三萜类化合物的骨架及类型较多,主要呈现成苷、成酯或游离状态,属于文冠果果壳、果叶中活性最强的化学成分之一,具体结构有羽扇豆烷型、甘遂烷型、玉蕊醇型等,通过这些结构还能够得到其他结构的三萜类化合物。
文冠果中的黄酮类成分主要源自果壳、枝、叶、茎,具体成分包括黄铜、黄烷酮、二氢黄酮、双黄酮等。
苯丙素类化学物在文冠果中多为香豆素类化合物,主要包括七叶内酯、秦皮苷、秦皮亭、异秦皮亭、东莨菪素、异东莨菪素等。还有少量木脂素类化合物。
文冠果中的甾类成分主要包括菜油甾醇乙酸酯、α-菠菜甾醇、豆甾醇、胡萝卜苷、麦角甾-6、β-谷甾醇、豆甾-7等[3]。
文冠果中的酚酸类成分主要包括原儿茶酸、香草酸、酪醇、对羟基苯甲醛、原儿茶酸乙酯等。
文冠果中的脂肪酸类成分主要包括二十碳烯酸、山嵛酸、软脂酸、亚麻酸、芥酸、花生酸、豆蔻酸、油酸、亚油酸、硬脂酸、月桂酸、二十碳二烯酸、木焦油酸、二十四烯酸14种,这是通过分离分析技术得到的目前最准确的结果[4]。但有研究学者通过GC-MS方法检测到了21种脂肪酸类成分,其中有8种脂肪酸类成分是首次在文冠果化学成分检测被报道和发现的。
不同研究学者在文冠果化学成分研究实验中,获得的研究成果有一定区别,由此出现了文冠果其他化学成分。例如,有研究学者发现了1个生物碱,有研究学者发现了1个单萜类衍生物。
2.2 文冠果生物活性
文冠果具有丰富的化学物质,秦皮苷、杨梅苷、花萼片等活性活跃,经检验叶、木提取液,在人类抗炎、抗病毒、抗肿瘤等方面显著[5]。其中,提取秦皮苷成分,能改善睡眠、缓解痉挛、清热解毒;杨梅苷可减少人体胆固醇;木提取液成分还可以辅助降低小儿遗尿疾病概率,可见文冠果对于人体有着显著生物活性,对于植物同样具备良好活性。
3 文冠果果壳提取物植物病原菌抑菌活性研究实验
3.1 实验样品
3.1.1 实验植物
本次实验文冠果为自甘肃省野生文冠果,含水量小于5%。
3.1.2 实验植物病原菌
实验植物病原菌主要包括苹果轮纹病菌、葡萄原斑根腐病菌、番茄灰霉病菌和梨黑斑病菌,上述实验植物病原菌均来源于某大学植物病理实验室。为了确保植物病原菌抑菌活性研究实验顺利进行,使用人参皂苷(HPLC超出98%)[6]。
3.2 实验试剂及仪器
(1)试剂:检测试剂盒为单宁、总酚、炎黄酮类,还配比乙醇/水(75%±5%)(提取物),而乙酸乙酯、甲醇、高氯酸中,前两个作为分析纯使用,最后一个作为优级纯使用[7]。供试培养基的制作,具体操作为取马铃薯(200 g),清洁(剥皮)后放入蒸锅中,锅内添加水800~1000 mL,蒸煮25~30 min后,取出使用纱布(4层)进行过滤,放置仪器内,先后添加葡萄糖和琼脂粉分别为20 g,持续摇晃均匀,待冷却后再次放入锅中,将锅内水补加到80~1000 mL,采用三角瓶加以分装,为包裹瓶口增强严密性,可选用棉塞、报纸类等物品,实施高温灭菌操作,后续放凉冷却妥善保存以备实验使用[8]。
(2)仪器设备:粉碎机、电子天平(BSA224S-CW)、循环冷却器(DL-400)、旋转蒸发器(RE-52)、循环水真空泵(SHZ-Ⅲ型)、超声波清洗剂、光度计(712G型)、生物光谱计、水浴锅、超净工作台、灭菌锅、恒温培养箱。
3.3 实验流程
3.3.1 制备文冠果果壳提取物
本实验选取200目粉碎机对文冠果果壳进行粉碎处理,而后取约65 g粉末置于1000 mL三角瓶中,缓慢加入400 mL乙醇(本试验所用为75%乙醇-水溶液)[9]。将盛有混合液的三角瓶进行封膜处理,而后置于超声波清洗仪中萃取15~30 min,除去萃取液后在残渣中重复加入400 mL乙醇,而后重新萃取15~30 min。混合两次萃取液利用旋转蒸发仪进行蒸发浓缩,而后将浓缩液储存备用,储存温度以4 ℃为宜。
依照上述方法,取65 g粉末与600 mL乙酸乙酯溶液亦或是石油醚,置于1000 mL三角瓶中,重复萃取3次,每次萃取均按照上述方法进行。第3次萃取之后便能够得到混合浓缩液,将混合浓缩液蒸干得到乙酸乙酯提取物以及石油醚提取物,储存备用,储存温度以4 ℃为宜[10]。
3.3.2 测定提取物总酚含量
取0.25 g文冠果果壳提取物置于10 mL离心管中,而后冲入甲醇-盐酸溶液冲液至8 mL[11]。将溶液置于4 ℃左右的避光环境中,静置20 min,平均每7~10 min进行一次摇动,整体进行约2~3次摇动,过滤后置于离心管中,得到总分粗提取液。取2 mL粗液进行测验。
具体检测方法如下:取适宜没食子酸标准溶液与试管中,依照试验需求分别制备0.1、0.3、0.5、1.0 mL对照组,于每组溶液中加入蒸馏水冲液至1 mL,制备0.1、0.3、0.5、1.0 mL总酚标准溶液,同时配置甲醇-盐酸缓冲液为空白对照组,置于280 nm的环境下确定不同溶液的吸光值,结合标准曲线计算总酚含量[12]。
根据试验标准条件推导回归方程式:y=1.7393x-0.0402。式中,y代表的是吸光值,x代表的是标准品没食子酸的标准浓度(g/L)。
总酚含量/(g/L)=(C×V)/W。式中,C代表的是基于标准曲线测得的测定管没食子酸含量/(g/L);V代表的是总酚粗提取液总含量,即8 mL,W为提取物总质量,即0.25 g[13]。
3.3.3 测定提取物单宁含量
称取0.1 g文冠果果壳提取物,混合蒸馏水(1 mL),搅匀后将溶液置于2 mL离心管中,在80 ℃的水浴环境中进行处理,处理时间在25~30 min左右,而后置于25 ℃离心环境中进行10 min的离心处理,处理后取上清液备用[14]。
具体检测方法如下:在37 ℃的环境中预热磷钼酸溶液以及氢氧化钠溶液以待后续试验使用。取两支规格为2 mL的试管,标定为测定管以及对照管[15]。在测定管中加入待测试样本溶液以及蒸馏水;在对照管中加入蒸馏水以及磷钼酸溶液。两组溶液进行5 min静置处理后,分别加入的氢氧化钠溶液。单宁这一物质在碱性环境中能够与磷钼酸溶液产生化学反应,从而得到蓝色化合物,此时通过用可见分光光度法,便能够测量得到单宁的吸光值,随后计算得到单宁的含量值[16]。
根据试验标准条件推导回归方程式:y=0.008x-0.0021,式中,y代表的是吸光值,x代表的是标准单宁酸溶液浓度(mg/L)。此时,单宁酸溶液含量(mg/L)的计算公式为:(C×V)/(W×1000),式中C代表的是单宁酸的含量;V代表的是单宁酸粗提取液的总体积(2 mL);W代表的是文冠果果壳提取物质量,即0.10 g。
3.3.4 测定提取物类黄酮含量
类黄酮的含量测定,参照总酚测定方式,制作甲醇(盐酸缓冲液)作为对照,并及时实施调零,确立在325 nm处测定;根据计算公式y=0.004x+0.035(x代表的是芦丁浓度,y代表的是吸光值),进一步推理出类黄酮含量(mg/g)计算为(C×V)/(W×1000),C代表的是芦丁含量,V代表的是总酚提液(总体积),W代表的是文冠果果壳提取物质量,即0.25 g[17]。
3.3.5 测定提取物皂苷含量
对于皂苷含量的测定,选用人参皂苷为标准品,添加适量甲醇作为溶剂使用,将其配置为标准溶液(0.312 g/L),取试管(6只),分别进行编号(1~6号),1号管吸取0.6 mL的标准溶液,2号管吸取0.8 mL的标准溶液,3号管吸取1.0 mL的标准溶液,以此类推,标准溶液吸取完毕后,另取一支试管(7号),配置甲醇溶液(1 mL),进行空白对照,之后加入高氯酸溶液(10 mL),水浴加热10~15 mim(65 ℃),观察化学反应,反应结束后及时放入冰水放凉冷却,最后将1~7号管溶液装置到比色皿内,对照管则实施调零,确立在321 nm出检测吸光值,并根据y=2.437x-0.0914绘制标准曲线(x代表的是皂苷浓度,y代表的是吸光值)。
此时,再提取乙醇(10 mg)、乙酸乙酯(10 mg)、石油醚提取物(10 mg),掺加适量甲醇放入烧杯内,待溶解后装置到容量瓶(规格100 mL),采取洗涤烧杯的方式(2~3次),将其转移到容量瓶中,滴加溶液一直到刻度线位置处,随后对配制好的溶液进行摇匀处理,进行测定并计算[18]。
3.3.6 测定抑菌活性
根据二倍稀释法,将所有实验物质进行配置,其中乙醇、乙酸乙酯以及石油醚配置为加药培养基,其含量为2 g/L。依照1∶10的配比混合培养基后倒平板[19]。依照标准生长速率测定法对培养基进行抑菌活性检测试验。
具体试验流程如下:采用打孔器(规格为6mm孔径)在菌丝生长较为旺盛的区域进行打孔,制备6种菌饼,将取得的6块菌饼接种至制备好的PAD平板中,而后置于25 ℃的环境进行恒温培养,每种文冠果果壳提取物都重复进行3次提取,同时制备无菌水对照组[20]。在试验进行中的1 d、2 d、3 d、4 d后测量菌落的直径,同时利用标准公式推算其抑菌率:
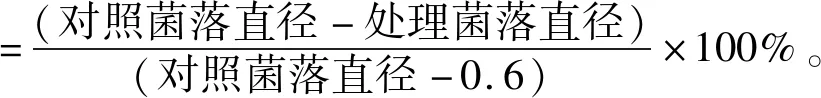
3.4 实验结果分析及讨论
3.4.1 文冠果果壳提取物化学成分分析
如表1所示,不同溶剂文冠果果壳提取物中的总酚、单宁、皂苷、类黄酮含量有所区别。其中,乙醇/水提取物、乙酸乙酯提取物中的类黄酮含量没有明显差异,乙醇/水提取物中的总酚、单宁、皂苷含量最高,其次是石油醚提取物,含量差异成倍数关系。

表1 文冠果果壳提取物化学成分实验结果统计 mg/g
3.4.2 文冠果果壳提取物植物病原菌抑菌活性分析
如图1所示,不同溶剂文冠果果壳提取物的植物病原菌抑菌活性有所区别,其中,乙醇/水提取物>乙酸乙酯提取物>石油醚提取物。在不同处理时间段内,乙醇/水提取物的植物病原菌抑菌活性比较稳定,乙酸乙酯提取物、石油醚提取物抑菌活性在48h之后比较稳定。
在24 h处理时间节点时,乙酸乙酯提取物的苹果轮纹病菌抑制率为100%,时间不断延后,抑制率不断降低,到96 h为50%;石油醚提取物的苹果轮纹病菌抑制率约为100%,时间不断延后,抑制率大幅度降低;乙酸乙酯提取物的葡萄根腐病菌抑制率为87%,时间不断延后,抑制率不断降低,到96 h为46%;石油醚提取物的葡萄根腐病菌抑制率为63%,时间不断延后,抑制率不断降低,到96 h为27%;乙酸乙酯提取物的山核桃根腐病菌抑制率为75%,时间不断延后,抑制率不断降低,到96 h为38%;石油醚提取物的山核桃根腐病菌抑制率为75%,时间不断延后,抑制率不断降低,到96 h为46%;乙酸乙酯提取物的番茄灰霉病菌抑制率为62%,时间不断延后,抑制率不断降低,到96 h为29%;石油醚提取物的番茄灰霉病菌抑制率为56%,时间不断延后,抑制率不断降低,到48 h为9%;乙酸乙酯提取物的番茄枯萎病菌抑制率为50%,时间不断延后,抑制率不断降低,到96 h为29%;石油醚提取物的番茄枯萎病菌抑制率为0%,时间不断延后,抑制率缓慢提高,随后出现不同程度的降低和提高,到96 h为5%;乙酸乙酯提取物的梨黑斑病菌抑制率为76%,时间不断延后,抑制率不断降低,到96 h为28%;石油醚提取物的梨黑斑病菌抑制率一直处于相对较低的水平。

图1 文冠果果壳提取物植物病原菌抑菌活性统计
4 结论
文冠果化学成分繁琐复杂,包括三萜类化合物、黄酮类成分、苯丙素类化合物、甾类成分、酚酸类成分、脂肪酸类成分及其他等。文冠果具有丰富的化学物质,秦皮苷、杨梅苷、花萼片等活性活跃,经检验叶、木提取液,在人类抗炎、抗病毒及抗肿瘤等方面显著。此次实验结果表明乙醇/水提取物对文冠果果壳化学成分的提取率最高,且对于几种植物病原菌的抑菌活性最高、最稳定,这与其他研究文献得到的最终结论一致。目前,关于文冠果果壳提取物植物病原菌抑菌活性的研究大部分停留在实验层面,很少结合具体的化学成分及生物活性,后续研究还需要向此方向发展及完善,实现对于文冠果的进一步研究及应用。
