谷氨酸棒杆菌表达大肠杆菌来源海藻糖酶
2022-12-20满在伟崔慧慧李锦张迎阳张建波张建涛
满在伟,崔慧慧,李锦,张迎阳,张建波,张建涛*
(1.常州大学 生物与食品工程学院,江苏 常州 213164;2.山东恒仁工贸有限公司,山东 枣庄 277533)
海藻糖是由葡萄糖以α-1,1糖苷键连接而成的二糖,无还原性、化学性质稳定,能够保护细胞的生物大分子,是生物体的一种应激合成产物[1-2]。海藻糖酶可以水解海藻糖的α-1,1糖苷键,将海藻糖分解为两分子葡萄糖[3-5]。近年来,海藻糖酶逐渐应用于发酵工业。玉米乙醇发酵中,海藻糖是发酵残糖的重要成分。在玉米乙醇发酵工业中,利用含有海藻糖酶活性的葡糖淀粉酶套件可水解发酵残糖中的海藻糖,进而提高乙醇产率和利润率[6]。谷氨酸棒杆菌发酵生产谷氨酸过程中,菌体会合成海藻糖并积累于发酵液中,导致发酵液中残糖浓度偏高。在谷氨酸发酵过程中添加海藻糖酶,可大幅降低发酵液中海藻糖浓度并提高谷氨酸得率,还可减小海藻糖对下游谷氨酸提取的影响[7-10]。另外,海藻糖酶也可用于海藻糖的快速检测。利用海藻糖酶将样品中海藻糖特异性分解成葡萄糖,对分解而来的葡萄糖进行检测即可得出样品中海藻糖的含量[11]。
随着海藻糖酶的应用逐渐增加,微生物生产海藻糖酶相关研究逐渐受到重视。通过菌株筛选可得产海藻糖酶微生物,如大黄欧文氏菌(Erwinia rhapontici)[12]、路德维希肠杆菌(Enterobacter ludwigii)[13]、分散泛菌(Pantoea dispersa)[14]、 玫瑰色微球菌(Micrococcus roseus)[15]等。通过将海藻糖酶基因在特定微生物中过量表达,也可获得高效合成海藻糖酶重组菌株。利用大肠杆菌(Escherichia coli,E.coli)BL21 可过量表达 E.coli str.K-12 substr.MG1655的海藻糖酶编码基因,获得的海藻糖酶可高效水解海藻糖[16]。利用黑曲霉HL-1表达来源于嗜热毁丝霉(Myceliophthora thermophila)和瘤胞毁丝霉(Myceliophthora sepedonium)的高活力海藻糖酶编码基因,采用增加基因拷贝数和发酵培养基优化方法提高产酶水平,纯化后的海藻糖酶用于酵母乙醇发酵可提高葡萄糖乙醇转化率[17-20]。利用毕赤酵母表达来源于嗜热真菌的海藻糖酶编码基因,获得的海藻糖酶也可用于酵母乙醇发酵过程并提高乙醇转化率[21]。
E.coli BL21中同样存在海藻糖酶编码基因trl,该基因与E.coli str.K-12 substr.MG1655的海藻糖酶编码基因相似度为98.42%,基因中存在26个核苷酸差异,编码蛋白中507位氨基酸残基存在差异。目前,鲜有关于E.coli BL21中海藻糖酶Trl的相关研究和报道。谷氨酸棒杆菌(Corynebacterium glutamicum,C.glutamicum)是一种一般认为安全的(generally recognized as safe,GRAS)菌株,营养要求低,蛋白合成能力强,蛋白水解酶活性低。C.glutamicum广泛应用于氨基酸、有机酸、生物燃料等发酵生产[22]。近年来,将C.glutamicum作为蛋白表达宿主用于表达目标蛋白逐渐受到重视[23-24]。
本研究将E.coli BL21来源的海藻糖酶在C.glutamicum ATCC13032中表达,对表达条件和重组海藻糖酶性质进行研究,为海藻糖酶相关研究和应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
E.coli BL21菌株、C.glutamicum ATCC13032菌株、C.glutamicum表达质粒pXMJ19:常州大学食品生物技术实验室保藏。
1.1.2 试剂与培养基
基因组提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、基因胶回收纯化试剂盒、基因连接试剂盒、质粒提取试剂盒、核酸电泳试剂盒、蛋白电泳试剂盒、改良型Bradford蛋白浓度测定试剂盒:生工生物工程(上海)股份有限公司;限制性内切酶EcoR I和 Hind III、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、氯霉素:生工生物工程(上海)股份有限公司;酵母粉、蛋白胨:安琪酵母股份有限公司。
卢里亚-贝尔塔尼(Luria-Bertani,LB)培养基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,固体培养基加入琼脂20 g/L,根据需要加入氯霉素10 mg/L。
LB加葡萄糖(LBG)培养基:LB培养基添加葡萄糖5 g/L。
1.2 仪器与设备
恒温培养箱(StabS2型):上海润度生物科技有限公司;离心机(1-14型):德国 Sigma公司;电转仪(MicroPulser):美国Bio-Rad公司;生物传感分析仪(S-10):深圳市西尔曼科技有限公司。
1.3 方法
1.3.1 海藻糖酶表达质粒构建
利用基因组提取试剂盒提取E.coli BL21基因组并冷冻保存。利用引物19-trl-Hind III F(5′-CCCAAGCTTAAAGGAGGGAAATCATGCTCAATCAGAAAATTCAAAACC-3′)和 19-trl-EcoR I R(5′-CCGGAATTCTTATGGTTCGCCGTACAAACC-3′)和PCR试剂盒以E.coli BL21基因组为模板PCR扩增E.coli BL21海藻糖酶编码基因trl,并利用基因胶回收纯化试剂盒进行trl基因纯化。利用EcoR I和Hind III限制性内切酶酶切pXMJ19质粒和trl基因,酶切后产物利用基因胶回收纯化试剂盒进行纯化。然后,利用基因连接试剂盒将酶切纯化后的pXMJ19质粒片段和trl基因片段进行连接。连接产物转化E.coli DH5α感受态,涂布LB氯霉素平板并于37℃培养12 h。挑取转化子利用液体LB氯霉素培养基37℃振荡培养12 h,利用质粒提取试剂盒提取质粒,并利用EcoR I和Hind III限制性内切酶酶切验证。将验证正确连接的质粒命名为pXMJ19-trl质粒。
1.3.2 表达海藻糖酶重组C.glutamicum Cgtrl构建
利用电转化方法将pXMJ19-trl质粒转入C.glutamicum ATCC13032菌株,构建表达海藻糖酶重组菌株 Cgtrl。取 2 μL pXMJ19-trl质粒加入 100 μL C.glutamicum ATCC13032感受态,1 800 V、5 ms电击。电击后涂布于LBG氯霉素平板,30℃培养。长出的转化子菌落即为含有pXMJ19-trl质粒的重组菌株Cgtrl。将重组菌株Cgtrl菌落划线至LBG氯霉素平板,30℃培养36 h,培养好的平板可直接用于后续试验或者置于冰箱冷藏保存。
1.3.3 重组菌株Cgtrl海藻糖酶诱导表达和诱导表达条件优化
重组菌株Cgtrl冷藏保存的平板重新划线至LBG氯霉素平板进行30℃培养36 h。利用接种环在培养好的平板上划取满环菌苔接种至10 mL LBG氯霉素液体培养基中,30℃、180 r/min培养12 h,获得种子液。然后,取1 mL种子液接入50 mL LBG氯霉素液体培养基中,30℃、180 r/min培养3 h后加入0.5 mmol/L IPTG,继续25℃、180 r/min培养7 h,诱导海藻糖酶表达。然后收集菌体,进行细胞破碎及蛋白电泳分析。
采用改变单因子的方法对诱导条件进行优化。添加不同浓度 IPTG(0.3、0.4、0.5、0.6 mmol/L),25 ℃、180 r/min诱导培养7 h,优化诱导剂添加量。添加0.5 mmol/L IPTG 后,在不同温度(16、19、22、25、28 ℃)下180 r/min诱导培养7 h,优化诱导温度。添加0.5 mmol/L IPTG后,在22℃、180 r/min诱导培养不同时间(7、12、17、22 h),优化诱导时间。海藻糖酶酶活力为单位体积发酵液中的酶活力(U/mL),根据相应体积发酵液菌体稀释或浓缩倍数折算得出。
1.3.4 海藻糖酶酶液制备
重组菌株Cgtrl海藻糖酶诱导表达结束后,离心(8 000×g,5 min,4℃)收集菌体。利用原培养液体积一半的50 mmol/L pH7.0磷酸钾缓冲液悬浮菌体,冰浴条件下超声破碎细胞。细胞破碎液离心(8 000×g,5 min,4℃),所得上清即为海藻糖酶酶液。
1.3.5 海藻糖酶酶活力测定
利用50 mmol/L的pH7.0磷酸钾缓冲液配制10 g/L海藻糖溶液,30℃预热10 min的5 mL海藻糖溶液中加入50 L海藻糖酶酶液,30℃反应10 min后沸水浴5 min。利用生物传感分析仪检测反应液中生成的葡萄糖浓度。
海藻糖酶酶活定义:每分钟水解1 μmol海藻糖生成2 μmol的葡萄糖所需的酶量定义为一个酶活力单位(1U)。海藻糖酶比酶活为每毫克蛋白中所含的酶活力。
1.3.6 重组海藻糖酶酶学性质
1)底物特异性
利用50 mmol/L的pH7.0磷酸钾缓冲液配制10 g/L海藻糖、麦芽糖、蔗糖、乳糖、纤维二糖溶液,按照1.3.5方法测定海藻糖酶酶活力。
2)温度对重组海藻糖酶活力的影响
海藻糖溶液分别在 30、35、40、45、50、55、60、65、70℃水浴中预热30 min,然后每5 mL预热好的海藻糖溶液加入25 L海藻糖酶酶液,继续在各温度下反应10 min。将最高酶活设置为100%。
3)重组海藻糖酶温度稳定性
重组海藻糖酶酶液加入10%体积的甘油,然后分别放置于-20、5、20、30、40、45 ℃温度下,取样按照1.3.5方法测定海藻糖酶酶活力。将初始酶活设置为100%。
4)pH值对重组海藻糖酶活力的影响
利用pH5.8~7.8的50 mmol/L磷酸钾缓冲液溶解海藻糖,配制不同pH值的10 g/L海藻糖溶液。每5 mL不同pH值的海藻糖溶液加入25 L海藻糖酶酶液,45℃反应10 min。将最高酶活力设置为100%。
5)海藻糖水解率
利用50 mmol/L pH6.6磷酸钾缓冲液将重组海藻糖酶酶液稀释至8 000 U/L(45℃、pH6.6条件下酶活力)。利用50 mmol/L pH6.6磷酸钾缓冲液配制0.25、0.5、1、2、4 g/L海藻糖溶液。取0.5 mL海藻糖溶液加入0.5 mL8000U/L的重组海藻糖酶酶液,45℃反应5min。根据产生的葡萄糖浓度计算海藻糖水解率。

式中:342为海藻糖相对分子质量,360为两分子葡萄糖的相对分子质量。
2 结果与分析
2.1 重组菌株Cgtrl构建及海藻糖酶表达
图1为pXMJ19-trl质粒单双酶切验证图。
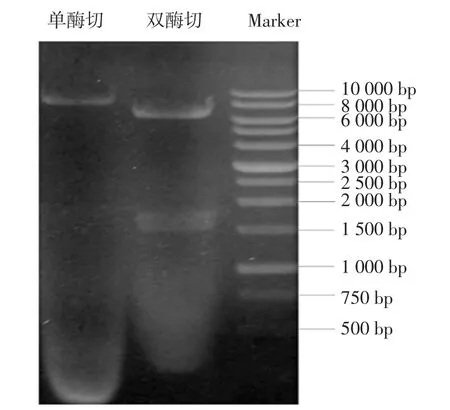
图1 pXMJ19-trl质粒酶切Fig.1 Restriction enzyme digestion of pXMJ19-trl plasmid
E.coliBL21海藻糖酶编码基因trl长度为1650bp。由图1可以看出,双酶切出现大小正确的条带,因此pXMJ19-trl质粒构建成功。海藻糖酶蛋白分子量为63.7 kD,由图2蛋白可知,在66 kD位置附近出现明显加粗的蛋白条带。酶活分析表明C.glutamicum ATCC13032细胞破碎液中无海藻糖酶活力,重组菌株Cgtrl细胞破碎液中海藻糖酶活力为10.2 U/mg蛋白。结果表明,过表达海藻糖酶重组菌株Cgtrl构建成功。
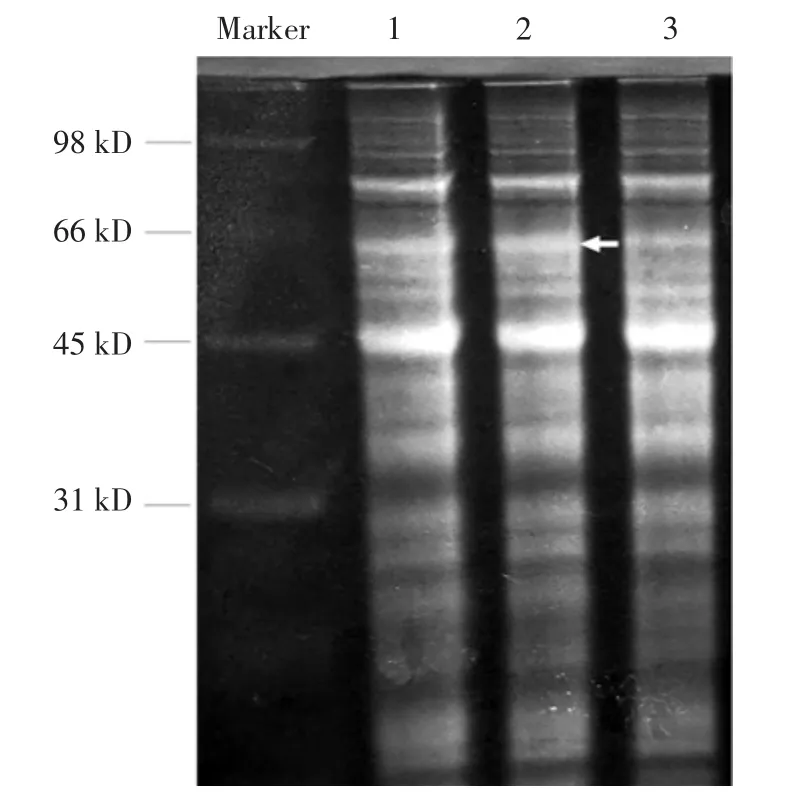
图2 重组菌株Cgtrl蛋白电泳分析Fig.2 Protein electrophoresis of recombinant strain Cgtrl
2.2 重组菌株Cgtrl海藻糖酶诱导表达条件优化
2.2.1 IPTG添加量对海藻糖酶表达的影响
IPTG添加量对海藻糖酶表达的影响如图3所示。
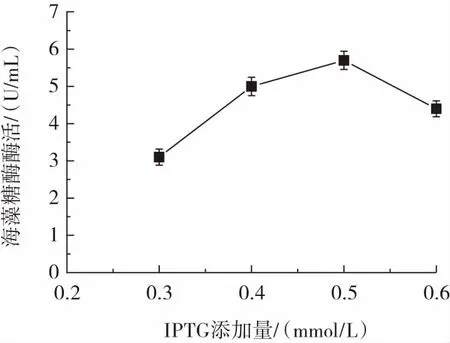
图3 IPTG添加量对海藻糖酶表达的影响Fig.3 The effect of IPTG additive amount on trehalase expression
由图3可知,当IPTG添加量为0.5 mmol/L时,重组菌株Cgtrl细胞破碎液中海藻糖酶酶活力最高,达到5.7 U/mL。IPTG添加量过低则诱导效率低,不利于酶的表达。同时,IPTG对微生物细胞具有一定毒性,过量添加同样不利于海藻糖酶的表达[25]。因此,最适IPTG添加量为0.5 mmol/L。
2.2.2 诱导温度对海藻糖酶表达的影响
诱导温度对海藻糖酶表达的影响如图4所示。
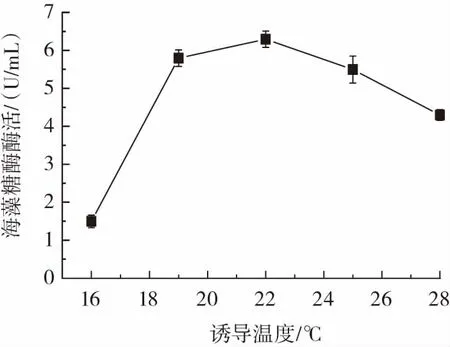
图4 诱导温度对海藻糖酶表达的影响Fig.4 The effect of induction temperature on trehalase expression
由图4可知,当诱导温度为22℃时,海藻糖酶酶活力最高,达到6.3 U/mL。温度过低,细胞代谢减慢,不利于酶的合成。而温度偏高,则有可能形成包涵体或者加快酶的变性失活,导致酶活力降低[16]。因此,诱导温度选择22℃。
2.2.3 诱导时间对海藻糖酶表达的影响
诱导时间对海藻糖酶表达的影响如图5所示。

图5 诱导时间对海藻糖酶表达的影响Fig.5 The effect of induction time on trehalase expression
由图5可知,当诱导时间为12 h时,海藻糖酶酶活最高,达到9.1 U/mL。诱导时间过长,海藻糖酶酶活力基本不再增加。这是由于重组菌株诱导培养时间过长时,培养基中的营养物质耗尽,菌株合成代谢和酶的表达停止。因此,诱导时间选择12 h。
2.3 重组海藻糖酶酶学性质研究
2.3.1 重组海藻糖酶底物特异性
重组海藻糖酶催化不同底物水解产生葡萄糖的研究结果如图6所示。
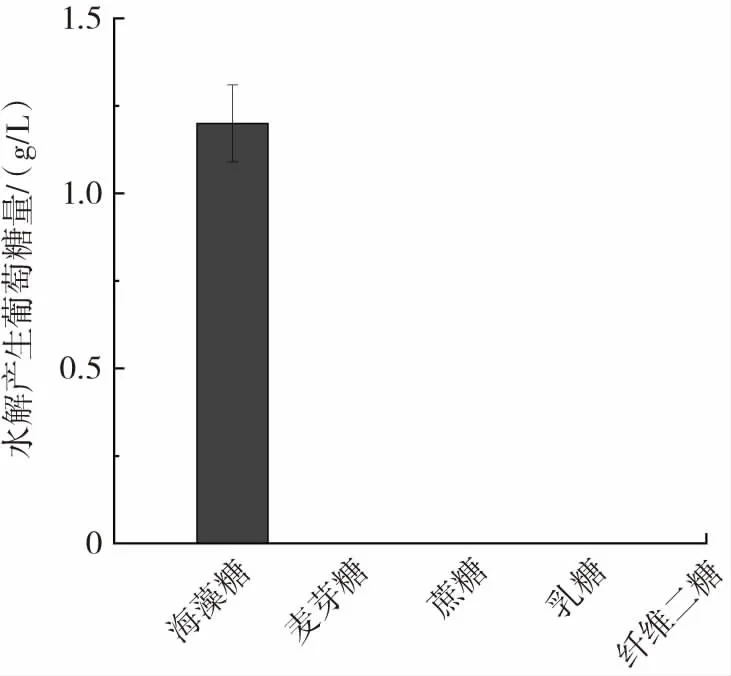
图6 重组海藻糖酶底物特异性Fig.6 The substrate specificity of recombinant trehalase
由图6可知,相同条件下,重组海藻糖酶不能催化麦芽糖、蔗糖、乳糖、纤维二糖水解产生葡萄糖。因此,重组海藻糖酶具有较好的底物特异性。较好的底物特异性能够为重组海藻糖酶的特殊应用奠定基础,如应用于海藻糖的检测[11],可避免受到其他糖类的干扰。
2.3.2 反应温度对重组海藻糖酶活力的影响
反应温度对重组海藻糖酶活力的影响如图7所示。
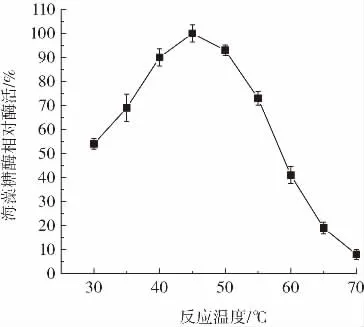
图7 反应温度对重组海藻糖酶活力的影响Fig.7 The effect of temperature on recombinant trehalase activity
由图7可知,45℃重组海藻糖酶活力最高,海藻糖酶活力随温度降低而逐渐降低,30℃条件下海藻糖酶活力降低约50%。反应温度高于45℃时,随温度升高海藻糖酶活力逐渐降低,70℃下海藻糖酶基本失去活力。
2.3.3 重组海藻糖酶温度稳定性
重组海藻糖酶温度稳定性如图8和图9所示。
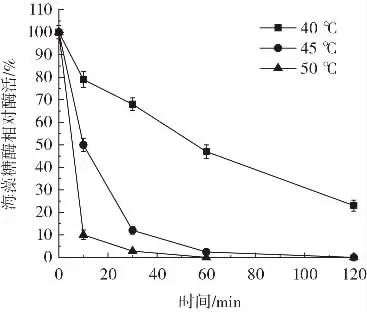
图8 高温条件下重组海藻糖酶温度稳定性Fig.8 The temperature stability of recombinant trehalase under high temperature conditions
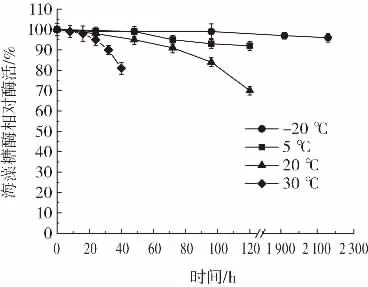
图9 低温条件下重组海藻糖酶温度稳定性Fig.9 The temperature stability of recombinant trehalase under low temperature conditions
由图8和图9可知,重组海藻糖酶在40℃下半衰期为1 h,在45℃下半衰期为10 min,在50℃下保存10 min后酶活降低90%。结果表明,高温(40℃~50℃)条件下重组海藻糖酶稳定性较差容易变性失活,这与E.coli str.K-12 substr.MG1655来源的海藻糖酶性质相近[16]。酶液中加入10%体积的甘油后,-20℃冷冻保存90 d酶活无明显降低,5℃冷藏保存5 d、20℃存放3 d、30℃存放32 h酶活均维持在90%以上。该结果表明,未经纯化的重组海藻糖酶低温(-20℃~30℃)条件下稳定性较好,可长时间保存。这应该是由于C.glutamicum蛋白水解酶活性低,有利于重组海藻糖酶长时间保存[23]。
2.3.4 pH值对重组海藻糖酶活力的影响
反应体系pH值对重组海藻糖酶活力的影响如图10所示。
由图10可知,重组海藻糖酶最适作用pH值为6.6。pH值小于6.6时,海藻糖酶活力随pH值降低而逐渐降低。pH值高于6.6时,海藻糖酶活力随pH值升高而逐渐降低。说明偏酸性条件有利于海藻糖酶催化反应。
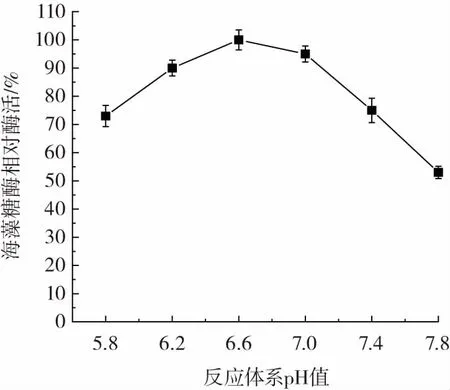
图10 pH对重组海藻糖酶活力的影响Fig.10 The effect of pH on recombinant trehalase activity
2.3.5 重组海藻糖酶海藻糖水解率
重组海藻糖酶海藻糖水解率如图11所示。

图11 重组海藻糖酶海藻糖水解率Fig.11 The trehalose hydrolysis ratio of recombinant trehalase
由图11可知,重组海藻糖酶催化海藻糖水解反应5 min后海藻糖水解率均达到96%以上。在分析重组海藻糖酶海藻糖水解率过程中,反应体系中海藻糖浓度分别为 0.125、0.25、0.5、1、2 g/L,反应体系中海藻糖酶活力为4 000 U/L。反应体系中的海藻糖酶理论上每分钟可水解 4000 μmol/L(1.37 g/L)海藻糖产生8 000 μmol/L(1.44 g/L)葡萄糖。该结果表明,当海藻糖浓度在0.125 g/L~2 g/L时,重组海藻糖酶能够在较短时间较彻底地分解反应体系中的海藻糖。该催化特性能够为利用重组海藻糖酶快速检测较低浓度海藻糖奠定基础[11]。对于较高浓度海藻糖的检测,可以将样品适当稀释后再利用该重组海藻糖酶进行分析测定。同时,针对乙醇和谷氨酸等发酵生产过程中海藻糖积累和残留问题[6,10],该重组海藻糖酶较高的海藻糖水解率有利于彻底水解生产过程中剩余海藻糖,在提高底物利用率和目标产品产率方面具有很大应用潜力。
3 结论
本文利用GRAS菌株C.glutamicum ATCC13032表达E.coli BL21来源海藻糖酶,对海藻糖酶表达条件和重组海藻糖酶酶学性质进行了研究。重组海藻糖酶最适表达条件:诱导剂IPTG添加量为0.5 mmol/L,诱导温度为22℃,诱导时间为12 h。在最适表达条件下重组海藻糖酶酶活为9.1 U/mL。后期工作中,可对重组菌株培养基进行优化并采用补料发酵模式以进一步提高重组海藻糖酶酶活。未经纯化的重组海藻糖酶具有较好的底物特异性,能专一性水解海藻糖,海藻糖水解率在96%以上,低温条件下稳定性较好能够长时间低温保存,最适作用温度为45℃,最适作用pH值为6.6。该重组海藻糖酶在海藻糖快速检测和海藻糖降解利用方面具有良好的应用前景。由于C.glutamicum是GRAS生物安全菌株,利用C.glutamicum ATCC13032表达获得的重组海藻糖酶具有良好的安全性,可用于食品行业。同时,重组海藻糖酶不用经过纯化即可应用,有利于降低酶的生产和应用成本。