KIT外显子9突变胃肠间质瘤患者术后使用伊马替尼对预后的影响研究*
2022-11-30吴星烨
冉 攀,张 军△,李 娟,吴星烨,阳 昊
(重庆医科大学附属第一医院:1.胃肠外科;2.药学部;3.呼吸内科 400016)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是消化道最常见的间质源性肿瘤[1-2]。多数GIST患者细胞中的酪氨酸蛋白激酶生长因子受体(tyrosine protein kinase growth factor receptor,KIT)原癌基因存在获得性功能突变,这种突变被广泛认为是GIST发病的关键因素[3]。KIT外显子9突变是GIST的第二大基因分型,约占每年新诊断病例的10%,肿瘤原发部位常见于小肠[4]。
术后NIH复发危险度为中高危的GIST,需每天口服伊马替尼(imatinib,IM)行辅助治疗,其标准剂量和有效血药浓度分别为400 mg/d与1 100 ng/mL,但并未强调GIST之间的基因分型差异[5]。有研究报道,在晚期治疗时,KIT外显子9突变GIST是唯一从加量IM治疗中获益的基因型[4,6]。但辅助治疗时,有关中高危KIT外显子9突变GIST患者的术后研究仍较为缺乏[7],基于此,本研究对本院7年间诊治的中高危原发局限性KIT外显子9突变GIST行回顾性分析,分析这类型患者的临床病历特征,旨在探讨其采用IM辅助治疗的有效性和必要性,以及是否应增加IM剂量来改善预后,同时探讨其预后、IM血药浓度和每天IM服用剂量三者间的相关性。
1 资料与方法
1.1 一般资料
采用回顾性研究方法,收集2015年1月至2021年10月本院收治的54例中高危原发局限性KIT外显子9突变GIST患者的临床病历资料。分为服药组和未服药组,服药组再分为高剂量组(600 mg/d)和标准剂量组(400 mg/d)。患者纳入标准:(1)病理及基因检测证实为KIT外显子9突变的GIST,并具有完整临床病理及预后信息;(2)经过手术完整切除(R0切除),依据2008年改良版NIH危险度分级[8]为中高危的GIST;(3)年龄大于或等于18周岁;(4)接受IM辅助治疗的患者需至少服药3个月,保证血药浓度基本达到稳态[9],且采血前1个月内,未服用其他影响IM药代动力学的药物[10],随访阶段未停药。排除标准:(1)初次就诊为不可切除/转移GIST患者;(2)随访期间行其他靶向药物治疗者(如舒尼替尼、瑞戈非尼等);(3)合并其他恶性肿瘤者。本研究经本院伦理委员会批准,审批号2021-754。
1.2 方法
1.2.1观察指标
IM辅助治疗定义为患者术后(R0切除)1周至1个月,开始接受IM治疗至其遵医嘱停药、肿瘤复发转移或患者死亡的阶段;无复发生存期(recurrence-free survival,RFS)定义为患者接受完整切除手术后至肿瘤复发转移、死亡或末次随访的时间;IM血药浓度数值取自患者在术后接受IM辅助治疗时间内,行IM血药浓度监测的平均数值;未服药组指手术后(R0切除)未服用IM的患者,服药组指手术后(R0切除)服用IM的患者,标准剂量组指手术后服用IM的剂量为400 mg/d的患者(在辅助治疗中,GIST患者口服IM的标准剂量为400 mg/d,且一般耐受性良好)[11],高剂量组指手术后服用IM的剂量为600 mg/d的患者(在进展期KIT外显子9突变的GIST患者中,中国患者的每天推荐剂量是600 mg/d,而不是美国国立综合癌症网络(NCNA)指南中推荐的800 mg/d,因为中国患者对800 mg/d的IM的耐受性明显低于欧美患者)[12]。
1.2.2IM血药浓度测定
监测的血浆标本均于GIST专科门诊抽取。患者均于午餐时间服用IM,并在服用IM的1 d后[服用IM后(24±3)h]抽取患者3 mL静脉血于肝素化小瓶中,血液样本在室温下以3 000×g离心5 min。测量患者的术后IM血药浓度。血浆样本经蛋白质沉淀预处理。取0.5 mL血浆样品于1.5 mL 离心管中,依次加入100 μL的乙腈和50 μL的50 %高氯酸,立即涡旋5 s,待所有样品预处理完毕后,集中涡旋15 s,并以10 800 r/min转速离心15 min,取400 μL上清液,加入50 μL中和液(1.40 g碳酸钾和0.65 g氯化钾溶解于5 mL纯水中),旋涡混匀,放入4 ℃冰箱中静置30 min后,取上清液30 μL放入高效液相色谱系统。定量下限为 50 ng/mL。IM血药浓度数据均由本院的岛津HPLC LC-20A仪器所测得。
1.2.3随访
通过门诊、胃你肠在APP或电话等方式获取随访信息。随访信息包括患者手术后是否接受IM辅助治疗、术后生存及复发状况、每天服用的IM剂量和IM血药浓度监测等,随访频率为每3个月1次,且需复查腹部CT或腹部B超,以此判定肿瘤是否复发。随访截至2021年12月1日,研究终点定义为患者出现肿瘤复发或成立。
1.2.4数据采集
以患者住院病历与门诊随访信息建立患者信息数据库(胃你肠在APP),录入每个GIST患者的信息,包括性别、疾病确诊年龄、肿瘤原发部位、治疗信息(手术记录及用药史)、基因检测(突变位点)和肿瘤病理信息(核分裂数、Ki-67标记指数、CD117和CD34阳性率)、血药浓度、术后生存及复发状况、改良版NIH危险度分级等。
1.3 统计学处理
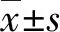
2 结 果
2.1 基线资料比较
54例中高危原发局限性KIT外显子9突变GIST患者中,男26例(48.15%),女28例(51.85%),确诊年龄(53.30±11.63)岁,肿瘤直径(7.64±3.01)cm,小肠部位原发42例(77.78%),其他部位原发12例(22.22%),A502-Y503重复43例突变(79.63%)。术后未接受IM辅助治疗者(未用药组)18例(33.33%),术后接受IM辅助治疗者(用药组)36例(66.67%)。2组患者临床资料比较,差异均无统计学意义,见表1。对36例用药组患者行进一步亚组分析,其中28例(77.78%)为标准剂量(400 mg/d),8例(22.22%)为高剂量(600 mg/d);2组患者临床资料的比较,差异均无统计学意义(P>0.05),见表2。

表1 未用药组与用药组临床病理特征的比较

表2 标准剂量组与高剂量组临床病理特征的比较

续表2 标准剂量组与高剂量组临床病理特征的比较
2.2 预后分析
54例患者中有21例在随访期间出现肿瘤的复发转移,全组患者中位随访时间为47(7~82)个月,其中,用药组9例,未用药组12例。用药组患者1年和3年无复发生存率分别为88.89%和77.78%,未用药组患者1年和3年无复发生存率分别为88.89%和38.89%,2组同时间无复发生存率比较差异有统计学意义(Log-rank,P=0.005)。见图1。
对用药组患者行进一步亚组分析,全组中位随访时间为40(7~79)月。其中,有9例在随访期间出现肿瘤的复发转移,高剂量组4例,标准剂量组5例,高剂量组1年和3年无复发生存率分别为87.50%和62.50%,标准剂量组1年和3年无复发生存率分别为85.71%和82.14%,2组同时间无复发生存率比较差异无统计学意义(Log-rank,P=0.189)。见图2。
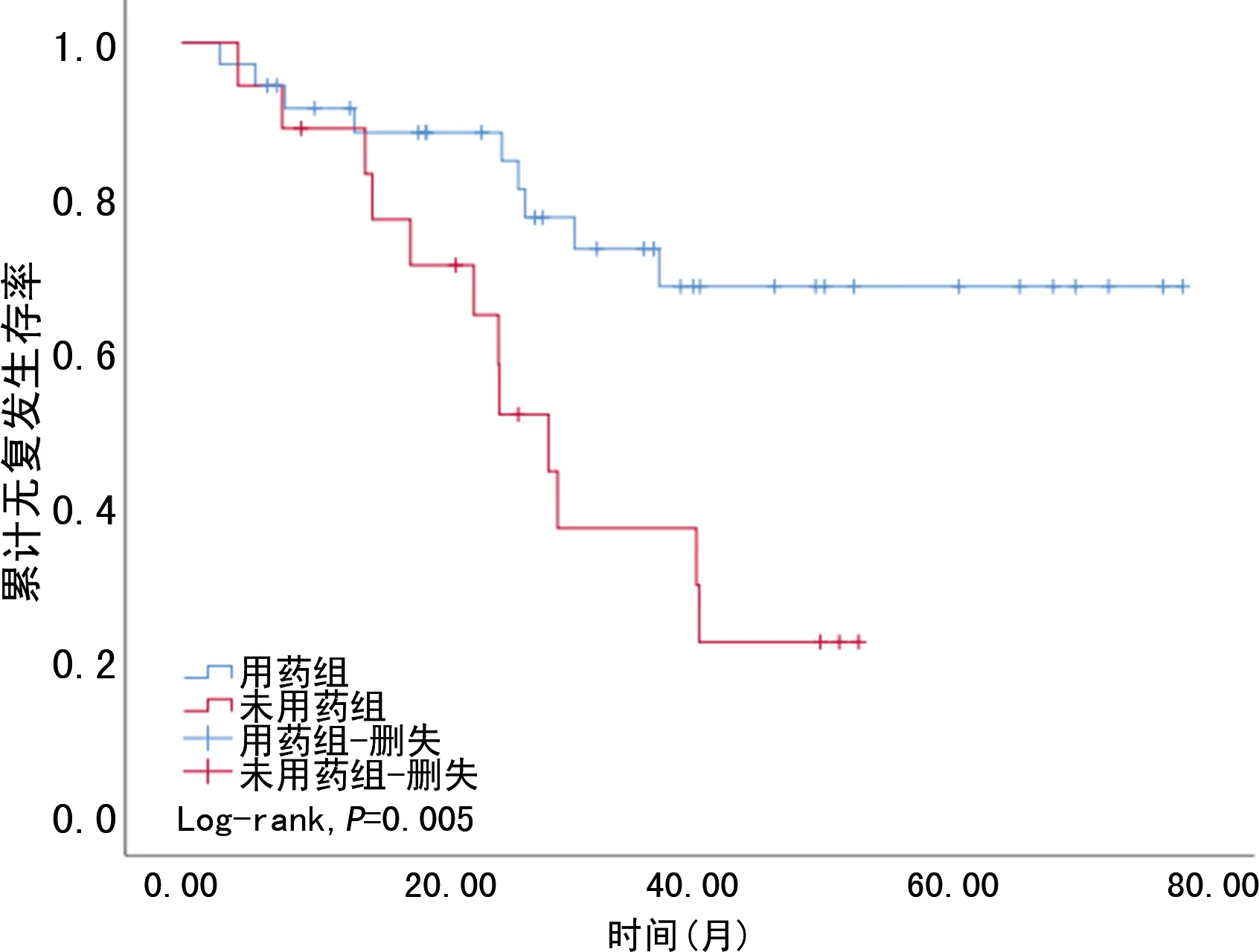
图2 用药组与未用药组GIST患者无复发生存曲线比较

图3 标准剂量组与高剂量组GIST患者无复发生存曲线比较
2.3 独立因素分析
将可能影响KIT外显子9突变GIST患者预后的因素纳入单因素Cox分析,结果显示:确诊年龄、肿瘤直径、性别、肿瘤原发部位、核分裂数、改良NIH危险度分级和突变位点差异均无统计学意义(P>0.05),Ki-67标记指数和IM辅助治疗在单因素Cox分析中差异有统计学意义(P<0.05)。将单因素分析中P<0.2的5个变量(年龄、肿瘤直径、Ki-67标记指数、肿瘤原发部位和IM辅助治疗)纳入多因素Cox分析,结果显示:Ki-67标记指数、IM辅助治疗是KIT外显子9突变GIST患者预后的独立影响因素,差异有统计学意义(P<0.05)。风险比(hazard ratio,HR)提示,选择IM辅助治疗可明显降低肿瘤复发风险(HR=0.29)。见表3。

表3 影响KIT外显子9突变GIST患者无复发生存率的单因素及多因素Cox分析

续表3 影响KIT外显子9突变GIST患者无复发生存率的单因素及多因素Cox分析
2.4 血药浓度分布
用药组患者IM血药浓度为(1 328.23±400.60)ng/mL,血药浓度分布见图3。采用t检验评估高剂量组与标准剂量组的IM血药浓度分布,差异有统计学意义(P=0.042),高剂量组的IM血药浓度明显高于标准剂量组,见图4。

图3 36例中高危原发局限性KIT外显子9突变GIST患者IM血药浓度分布
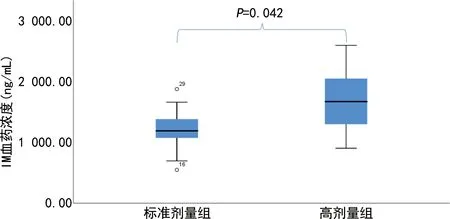
图4 标准剂量组与高剂量组IM血药浓度分布
3 讨 论
酪氨酸蛋白激酶生长因子受体原癌基因和血小板源性生长因子受体α(platelet derived growth factor alpha,PDGFRα)基因存在获得性功能突变,导致酪氨酸激酶活性增强,这种突变被广泛认为是GIST发病的关键因素[3,13]。作为酪氨酸激酶抑制剂的IM具有阻断KIT活性的特性,这一特性被用来治疗GIST,使酪氨酸激酶不能与下游的效应分子结合,从而导致GIST细胞增殖受抑制,诱导GIST细胞的凋亡[14]。由此,IM被应用于GIST患者术后的辅助治疗,降低肿瘤复发率[15]。本研究纳入54例中高危原发局限性KIT外显子9突变GIST患者,按术后是否行IM辅助治疗分为2组进行生存分析,结果显示用药组与未用药组患者的预后差异有统计学意义(Log-rank,P=0.005),且经多因素Cox分析排除混杂因素后,IM辅助治疗是影响KIT外显子9突变GIST患者预后的独立因素。综上,接受IM辅助治疗对原发局限性KIT外显子9突变GIST患者的预后改善值得肯定。
既往研究报道,治疗进展期KIT外显子9突变GIST接受标准剂量(400 mg/d)IM疗效不佳,增加该类患者服用的IM剂量,可改善患者的预后[4-5]。本研究纳入36例中高危原发局限性KIT外显子9突变GIST患者,按术后服用的IM剂量分为2组进行生存分析,结果显示标准剂量组与高剂量组患者预后差异无统计学意义(Log-rank,P=0.189)。有研究报道,对于IM耐药的不可切除/复发转移GIST患者,经姑息性手术切除,减小肿瘤负荷后再次服用IM,可达到控制肿瘤进展的目的[16]。辅助治疗患者均已接受完整的肿瘤切除手术,与进展期GIST较高的肿瘤负荷相比,可能标准剂量的IM即可有效降低患者复发风险。与接受标准剂量比较,行高剂量IM治疗的GIST患者药物支出较高。有研究报道,患者的经济状况等社会因素,是影响GIST患者用药依从性的因素之一,进而可影响其预后[17]。
患者体表面积、性别、每天用药量与其IM血药浓度有很高的相关性[18],本研究发现,高剂量组与标准剂量组的IM血药浓度分布差异有统计学意义(P=0.042)。高剂量IM治疗与高水平血药浓度的出现存在正相关性,高水平的IM血药浓度会导致药物不良反应程度加重和频率增加[18-19]。GIST患者术后口服IM治疗是一个长期过程,1项SSGXVⅢ/AIO的前瞻性试验中,计划服药1年组和3年组患者的总停药率分别为13%和26%,其中8%和14%患者停药原因可归因于药物不良反应[20],无效药量的增加,对患者预后的负面连锁效应值得深思。
本研究发现,达到有效血药浓度(1 100 ng/mL)水平以上后,肿瘤复发患者的IM血药浓度呈均匀分散分布,无集中趋势,这一点与相关报道一致[9],对已接受完R0切除的患者,可能达到有效血药浓度后,即可有效降低GIST复发风险[9]。综上,经手术R0切除后,中高危原发局限性KIT外显子9 突变GIST患者接受IM辅助治疗,可有效降低肿瘤复发率。与接受标准剂量IM(400 mg/d)比较,行高剂量(600 mg/d)IM治疗的GIST患者的预后并未得到改善。每天服用的IM剂量与血药浓度呈正相关。
