Twist1和血管生成拟态在结直肠癌中的表达和临床意义*
2022-11-30潘成武张新鑫张晨嵩马家驰冯振中
潘成武,张新鑫,张晨嵩,李 雷,谢 波,李 靖,马家驰,冯振中
(蚌埠医学院第一附属医院:1.肿瘤外科;2.病理科,安徽蚌埠 233000)
结直肠癌(colorectal cancer,CRC)是最常见的消化道肿瘤。近年来,由于人们生活方式及饮食习惯的改变。CRC在我国的发病率明显升高,已成为影响我国公民身体健康的重要疾病之一[1]。Twist1是一种在进化上高度保守的螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子,不仅在胚胎发育、形成过程中具有重要作用,也是诱导肿瘤细胞发生上皮间质转化(EMT)并促进侵袭转移的关键调控因子[2]。Twist1已被证实是一种在多种肿瘤中过表达的新型致癌基因,可赋予肿瘤细胞更多浸润性表型特性[3]。血管生成拟态(vasculogenic mimicry,VM)是肿瘤细胞为满足自身血供需求,通过自身形变及细胞外基质的重塑,形成类似血管样的血运通道。血管内皮细胞钙黏连蛋白(VE-cadherin)是其重要的分子。研究表明,VM可以促进多种肿瘤的生长和转移。然而,Twist1对CRC VM的影响尚不清楚。本研究通过对CRC患者临床数据进行统计,分析Twist1对CRC侵袭、迁移的影响,探究其对VM的影响。
1 材料与方法
1.1 一般资料
选取本院2011年1月至2014年12月经手术切除CRC,随访资料完整并经病理医生诊断为CRC(术前未行放、化疗)的患者124例,取其CRC组织标本,并取30例患者的正常结直肠黏膜标本。患者纳入标准:(1)术前经肠镜活检确诊为原发性CRC;(2)无化疗、放疗史等其他方法治疗史;(3)临床资料完整。排除标准:(1)合并其他组织起源的恶性肿瘤;(2)死于除CRC以外的其他原因。通过电子病历系统采集患者临床资料信息。患者的临床资料包括年龄、病理分级、淋巴结转移、血管侵犯、临床分期等。随访至2019年12月或患者死亡。本研究已经通过本院伦理委员会批准并取得患者知情同意。
1.2 主要试剂与材料
HT-29、HCT116、SW480、LOVO直肠癌细胞和HCO正常肠上皮细胞购自上海中科院生物化学研究所。DMEM培养基、胰蛋白酶购自美国Hyclone公司,胎牛血清(FBS)购自浙江天杭生物科技股份有限公司,小干扰RNA(small interfering RNA,siRNA)由上海吉玛公司设计合成,LipofectaminTM2000购自美国Thermo Scientific公司。Transwell小室、基质胶购自中国碧云天生物技术有限公司;Twist1、VE-cadherin、神经型钙黏连蛋白(N-cadherin)、Snail、人甘油醛-3 -磷酸脱氢酶(GAPDH)一抗及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于英国Abcam公司。
1.3 免疫组织化学染色
将组织置于4%多聚甲醛中固定4 h,加热溶解脱水后放入机器组织槽中,随后3次浸蜡。选取模具,使用机器滴蜡包埋组织。切片机调整切片厚度后均匀切片,随后将切片置于40 ℃水槽中。切片烤干,于二甲苯溶液及梯度乙醇中脱蜡至水。免疫组织化学实验步骤参照实验说明书进行,抗体:Twist1、VE-cadherin(1∶200)。采用已知阳性切片作对照,以PBS代替一抗作为空白对照。由3位病理学医师采用双盲法在显微镜下观察组织切片上每个小块的所有区域,判定染色强度和染色阳性率。判定标准:根据染色强度和染色范围进行判定。其中染色强度根据颜色分为无染色(0分),淡黄色(1分),棕黄色(2分),深棕色(3分);染色范围为0分(0~10%)、1分(11%~25%)、2分(26%~50%)、3分(51%~75%)和4分(76%~100%)。用染色强度得分和染色范围得分的乘积判断表达结果,积分0~<4分为阴性,4~12分为阳性。
1.4 双重染色法
CD34免疫组织化学染色,然后将切片置于0.5%高碘酸溶液中氧化5~8 min。流水冲洗2 min,再用蒸馏水洗1次,于暗处置于Schiff液中染色10~20 min,然后用0.5%偏重亚硫酸钠液滴洗2次,每次1 min,依次苏木素染色细胞核、盐酸乙醇分化、返蓝、脱水透明及中性树胶封片。通过CD34与高碘酸-希夫(PAS)双重染色,在CRC组织切片中观察到由肿瘤细胞排列形成的管腔样结构,CD34阳性证实其为VM。
1.5 细胞培养
正常人肠上皮细胞HCO培养于含10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素的RPMI-1640培养基,CRC细胞株HT-29、HCT116、SW480、LOVO分别培养于含有10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素的DMEM培养基,5% CO2、37 ℃ 条件培养箱中传代培养。
1.6 细胞转染
按照脂质体LipofectamineTM2000转染试剂说明书,将si-NC(si-NC组,阴性对照)、si-Twistl(si-Twistl组)转染于HCT116细胞。取对数生长期细胞, 于转染前24 h将细胞以3×105/孔接种于6孔板;转染时加入相应试剂并混合均匀,将细胞培养基换为无血清培养基,5% CO2、37 ℃ 条件培养箱培养6 h后更换新鲜培养基,然后进行后续实验。si-Twistl正向:5′-CUG CAG ACG CAG CGG GUC A-3′;反向:5′-UGA CCC GCU GCG UCU GCA G-3′。si-NC 正向:5′-UUC UCC GAA CGU GUC ACG U-3′。反向:5′-ACG UGA CAC GUU CGG AGA A-3′。
1.7 Western blot
收集细胞,加入裂解液完全裂解细胞,12 000×g离心10 min,收集上清液,即为总蛋白溶液。BCA法检测蛋白浓度,并定量。蛋白上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,分离后的蛋白转移至聚偏氟乙烯(PVDF)膜,孵育一抗后,置于冰箱中4 ℃过夜,加入用封闭液稀释的二抗,室温孵育60 min。通过凝胶成像系统检测并计算Twist1、VE-cadherin、EMT和VE相关蛋白表达水平,以GAPDH为内参。
1.8 体外迁移、侵袭实验
在Transwell下室中加入趋化因子表皮生长因子(EGF,10 ng/mL) 600微升/孔,细胞用无血清培养基制成单细胞悬液,每种细胞做3个复孔,在上室孔中加入200 μL 1×105/L细胞悬液,培养24 h,弃去上室液体,用湿棉签擦去膜上未穿膜的细胞,苏木素染色,倒置显微镜下观察穿膜细胞(200×),每张膜中央部分和周围部分各取3个视野,计数每个视野内穿孔的细胞数。侵袭实验需要加Matrigel凝胶铺于Transwell上室。
1.9 统计学处理
2 结 果
2.1 Twist1、VE-cadherin在CRC中的表达及CRC组织中VM形成情况
Twist1在CRC组织中阳性70例,阴性54例,阳性率56.5%;Twist1在正常结直肠黏膜组织中阳性2例,阴性28例,阳性率6.7%。VE-cadherin在CRC组织中阳性60例,阴性64例,阳性率48.4%;VE-cadherin在正常结直肠黏膜组织中阳性1例,阴性29例,阳性率3.3%。Twist1、VE-cadherin在CRC组织中的阳性率较正常结直肠黏膜高,差异有统计学意义(P<0.05)。VM在CRC组织中阳性21例,阴性103例,阳性率16.9%。见图1。
2.2 CRC中Twist1、VE-cadherin的表达和VM与临床病理学的关系
为了研究Twist1和VE-cadherin对CRC预后的判断作用,分析了免疫组织化学结果与患者临床病例资料的关系,结果表明,Twist1表达与病理分级(P=0.03)、血管侵犯(P=0.04)和淋巴结转移(P=0.01)有关。VE-cadherin表达与血管侵犯(P<0.01)和淋巴结转移(P<0.01)有关。VM与病理分级(P<0.01)、TNM分期(P=0.03)、血管侵犯(P<0.01)和淋巴结转移(P<0.01)有关。见表1。
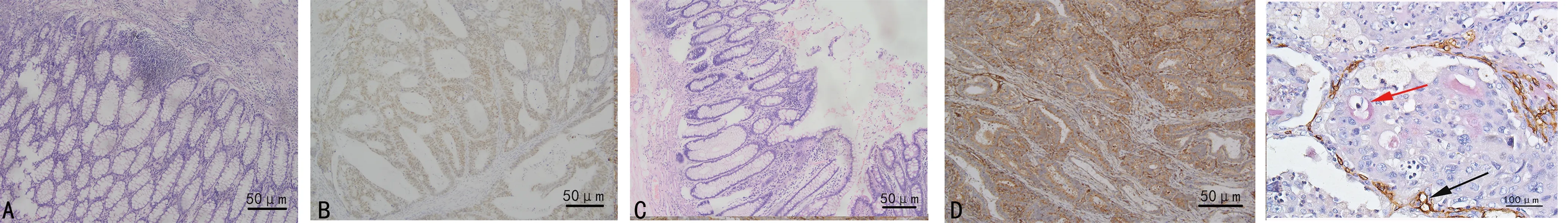
A:Twist1在正常黏膜组织中阴性表达;B:Twist1在CRC组织中阳性表达;C:VE-cadherin在正常黏膜组织中阴性表达;D:VE-cadherin在CRC组织中阳性表达;E:CD34和 PAS双染,红色箭头指示VM结构,黑色箭头指示血管结构。
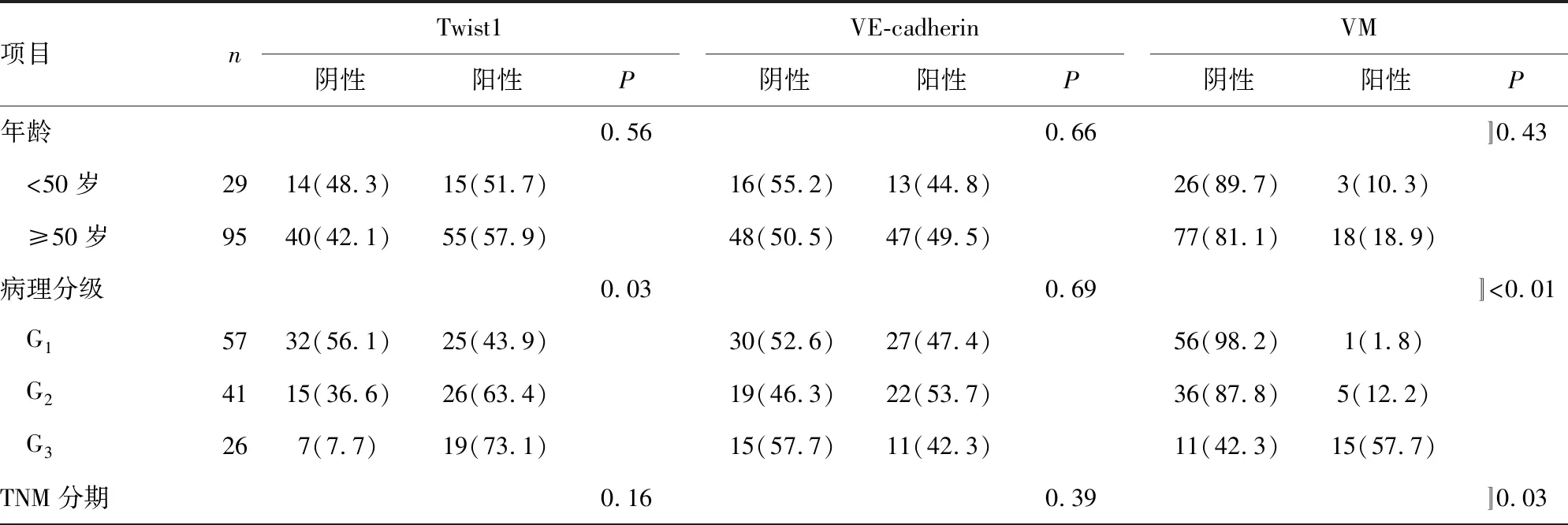
表1 Twist1、VE-cadherin表达和VM与CRC临床病理因素的关系[n(%)]
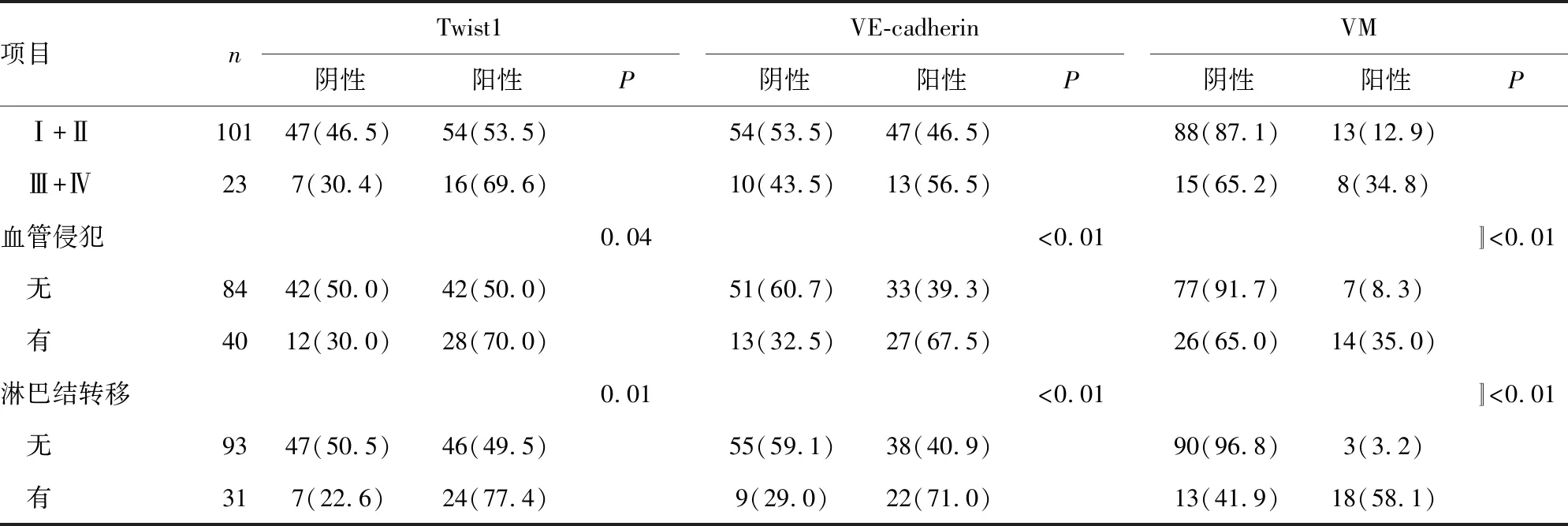
续表1 Twist1、VE-cadherin表达和VM与CRC临床病理因素的关系[n(%)]
2.3 CRC组织Twist1高表达与低表达组术后5年生存率比较
124例CRC患者随访数据分析结果表明,Twist1高表达组(n=69)术后5年生存率明显低于Twist1低表达组(n=62),差异有统计学意义(P<0.01),见图2。
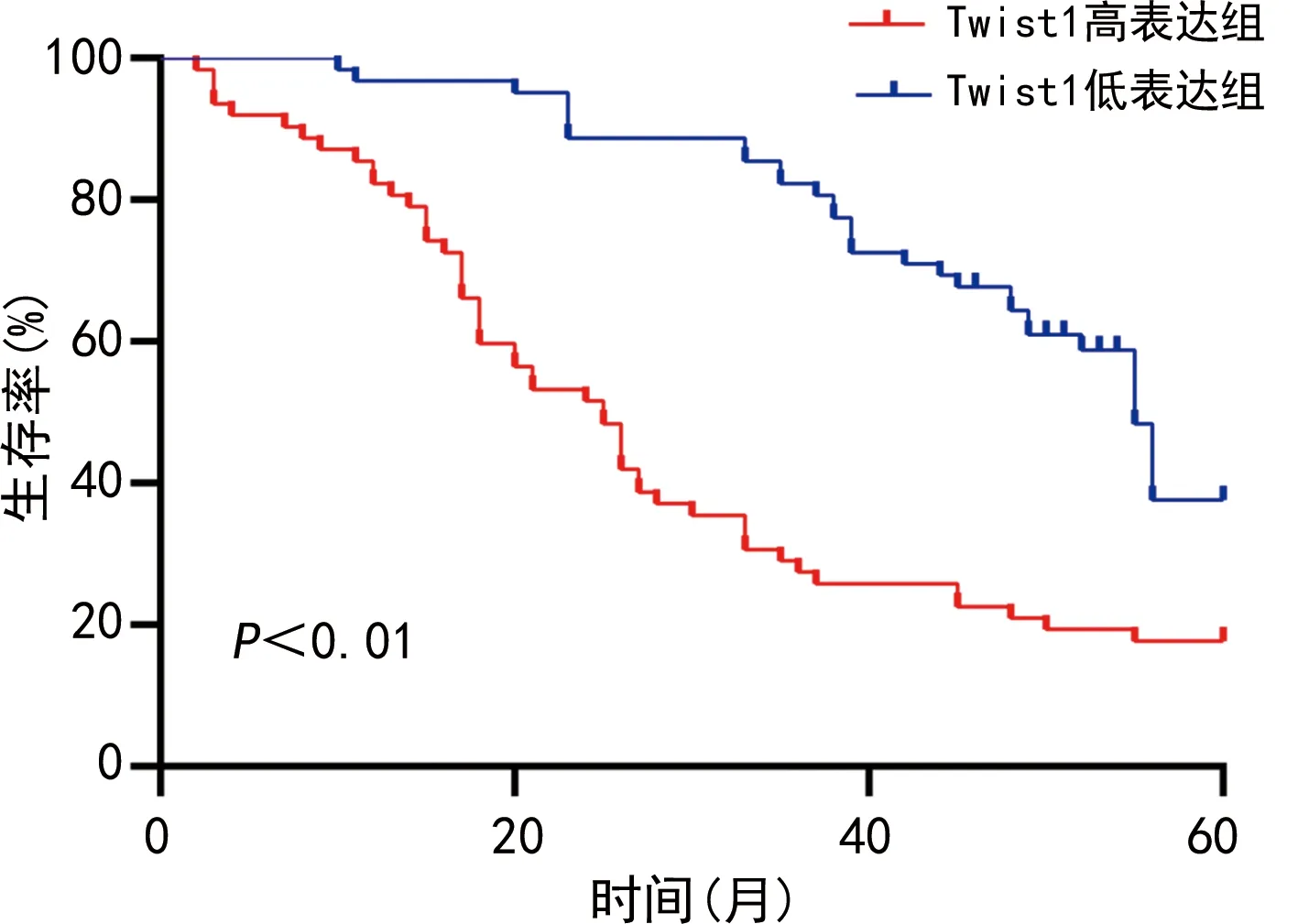
图2 Twist1高表达组与低表达组术后5年生存率比较
2.4 Twist1在CRC细胞株中的表达
Western blot检测显示,与正常肠上皮细胞HCO比较,CRC细胞株HCT116、HT-29、SW480、LOVO中Twist1的表达水平分别是其5.1、4.3、3.4、3.9倍。见图3。根据细胞株表达情况,选择表达水平最高的HCT116细胞进行后续实验。
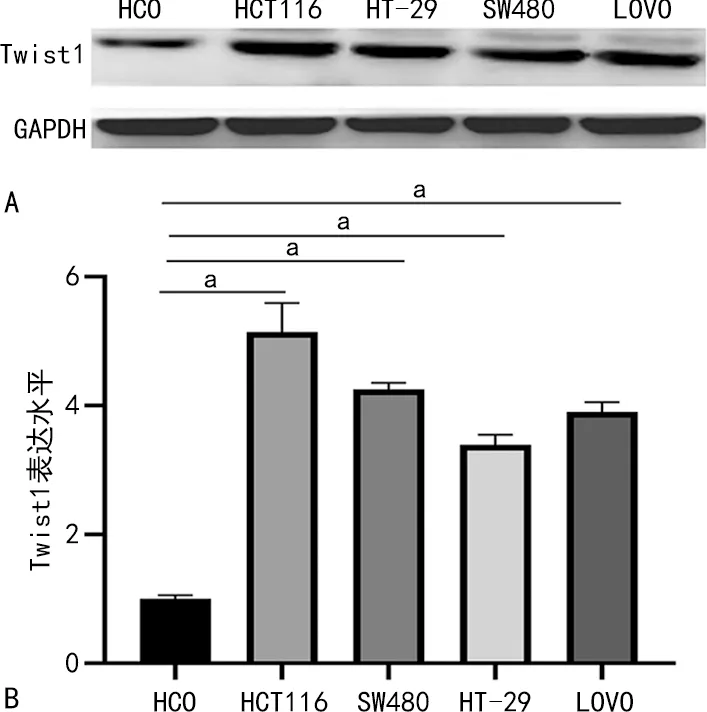
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.5 siRNA沉默Twist1表达后检测CRC细胞中Twist1表达水平
Western blot检测显示,与si-NC组比较,si- Twist1组HCT116细胞中Twist1水平降低,差异有统计学意义(P<0.05)。见图4。
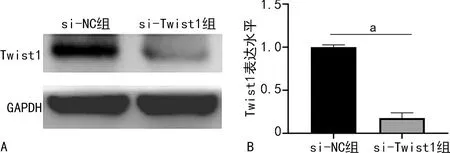
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.6 Twist1对CRC细胞EMT的影响
Western blot检测结果显示,与si-NC组比较,si-Twist1组HCT116细胞中N-cadherin、Snail的表达水平下降,差异有统计学意义(P<0.05)。见图5。
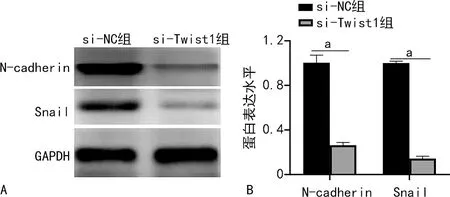
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.7 Twist1对CRC细胞VM的影响
Transwell迁移实验结果显示,si-Twist1组48 h HCT116细胞迁移数少于si-NC组,差异有统计学意义(P<0.05);侵袭实验结果显示,si-Twist1组48 h HCT116细胞的侵袭细胞数少于si-NC组,差异有统计学意义(P<0.05)。Western blot检测显示,与si-NC组比较,si-Twist1组中VE-cadherin表达水平下降,差异有统计学意义(P<0.05)。见图6。
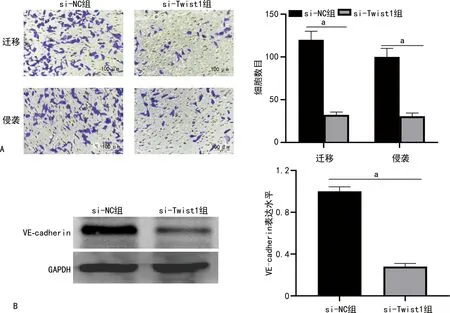
A:细胞迁移及侵袭实验及定量分析;B:VE-cadherin Western blot检测及定量分析;a:P<0.05。
3 讨 论
CRC在世界范围内发病率排名第3,病死率排名第4,其中70%为结肠癌[4]。尽管CRC的治疗有了进步,但其病死率仍很高[5]。因此,需要更可靠的分子预后标志物来改善CRC的诊断和治疗。
肿瘤的生长和转移需要足够的营养和氧气,“抗肿瘤血管生成的治疗”已成为近年来肿瘤研究一大热点。在恶性肿瘤研究中发现的一种PAS染色阳性,CD34等内皮细胞标志物染色阳性的管网状结构被命名为VM,并推测其参与了肿瘤的微循环过程[6]。VM是指某些高侵袭性肿瘤为满足自身的血供,肿瘤细胞在没有血管内皮细胞的参与下,能够模拟内皮细胞并形成管样结构,引起恶性肿瘤细胞可塑性改变、细胞外基质重塑并可以与宿主的微循环系统相通[7]。VM能够促进新生血管形成,并与肿瘤侵袭、转移及患者预后密切相关,在诸如乳腺癌、前列腺癌、卵巢癌、肝癌等上皮来源的肿瘤中相继证实了VM 的存在[8-10]。
VE-cadherin是血管内皮细胞中表达cadherin超家族的成员,是内皮细胞黏附连接的主要黏附受体。研究表明VE-cadherin在VM的形成中起着重要作用。VE-cadherin已被报道在多种肿瘤细胞中过表达,并参与肿瘤的新血管形成、生长和进展。已有研究表明,VE-cadherin的异常表达促进了恶性黑色素瘤的进展和转移,并参与了该肿瘤的VM。TANG等[11]预测HIF-1α可以直接或间接调控VE-cadherin、EphA2和Laminin 5γ2 (LN5γ2)基因的表达。它还能促进VM的形成,为CRC提供血供。但尚不清楚CRC中VM与VE-cadherin的相关性是否与其他因子的异常表达有关。
近年来,多项研究表明Twist家族碱性bHLH转录因子1(即Twist1)在膀胱癌、胃癌、鼻咽癌、前列腺癌、乳腺癌和滑膜肉瘤等多种癌症中均高表达。本研究通过收集CRC患者数据,同时结合免疫组织化学结果分析,发现Twist1、VE-cadherin在CRC中高表达。在高度恶性的CRC中存在VM现象,Twist1、VE-cadherin的过表达和VM与CRC的血管侵犯、淋巴结转移等恶性生物学明显相关。对术后患者进行随访调查发现,Twist1高表达组术后5年生存率明显低于Twist1低表达组。本研究创新性地利用临床数据分析了Twist1、VE-cadherin和VM与CRC临床病理特征的相关性,并且发现Twist1的表达与临床预后相关。
Twist1在肿瘤发生发展中的作用涉及多种机制,包括调节肿瘤细胞生长、分化、抑制凋亡、增加化疗耐药性、促进肿瘤血管生成[12-16]。已有研究表明,Twist1下调了肝癌细胞E-cadherin的表达水平,上调了VE-cadherin和基质金属蛋白酶-9(MMP-9)、MMP-2的表达水平,以促进肝癌细胞VM的形成[17]。然而,关于Twist1在CRC中VM形成的研究有限。为进一步验证临床结果Twist1对VM的影响。本研究沉默CRC细胞株HCT116 Twist1的表达,发现CRC细胞侵袭、迁移及EMT受到抑制。此结果说明Twist1表达水平可能影响侵袭、迁移及EMT。为了进一步研究Twist1与VM的关系,本研究通过Western blot检测VM重要分子VE-cadherin的表达,发现抑制Twist1表达水平,VE-cadherin的表达水平也受到抑制。这些结果均表明,Twist1的表达水平与VM相关分子VE-cadherin表达相关。然而,笔者并未深入研究VM形成的机制,本课题组将在后续研究中继续深入探索。
综上所述,Twist1在CRC组织中高表达并与肿瘤的转移和发展相关,对评估预后具有一定的价值。基础实验证实,Twist1通过影响VM来影响肿瘤的转移和发展。而其具体的作用机制仍需进一步探索。
