mTOR激酶抑制剂依赖Bim诱导MDA-MB-453乳腺癌细胞死亡*
2022-11-30罗哲婵邹胜泽
罗哲婵,邹胜泽
(浙江省温州市中医院药剂科 325000)
据世界卫生组织国际癌症研究机构(IARC)发布的数据显示,2020年乳腺癌新发病例高达226万例,已超越肺癌成为全球最高发病率的癌种。在我国,乳腺癌发病率和病死率仅次于肺癌、结直肠癌和胃癌,是威胁女性生命健康的重大疾病[1]。因此,临床迫切需要更高效的治疗方案以提高乳腺癌患者的生存率与生存质量。随着精准医疗的发展,乳腺癌药物治疗的响应率显著提升,其中特别典型的就是以抗人表皮生长因子受体2(HER2)为代表的靶向治疗[2]。HERA和NOAH临床试验提示,曲妥珠单抗治疗后乳腺癌患者的中位生存期可长达40.8个月[3-4]。CLEOPATRA研究结果进一步表明,在曲妥珠单抗联合多西他赛的基础上,帕妥珠单抗能够将中位总生存期增加16个月[5]。尽管如此,我国的靶向药物研发和管线药物仍较匮乏。
乳腺癌的分子分型在很大程度上帮助临床医生确立了规范化的治疗方案,为精准治疗提供了依据。目前乳腺癌根据基因背景可分为4种亚型:腺腔A型、腺腔B型、HER2过表达型和基底样型[6-7]。其中,HER2过表达型乳腺癌占近20%,其恶性程度高,易复发与转移且预后较差[8]。尽管基于HER2的靶向治疗响应率高、疗效确切,然而出现耐药的情况也多见[9]。其中,哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的活化是关键的耐药机制[10]。BOLERO-3研究结果提示,mTOR变构抑制剂依维莫司可逆转曲妥珠单抗的耐药性[11]。其实不仅仅局限在耐药状态下,mTOR通路的异常活化在乳腺癌中也高频率发生,是研究的热门靶点。
mTOR在生物体内以2种复合物的形式存在:mTORC1和mTORC2,它们分别介导不同的生物学功能[12-13]。依维莫司是mTOR变构抑制剂,主要抑制mTORC1的功能,无法全盘抑制mTOR信号通路,并且应用后可通过p70S6激酶1-胰岛素受体底物1(S6K1-IRS1)进行负反馈而活化细胞内磷脂酰肌醇肌酶/蛋白激酶B(PI3K/Akt)通路,治疗窗有限[14]。基于此研发的mTOR激酶抑制剂可全盘抑制mTOR通路,临床前研究结果提示抗肿瘤活性优于依维莫司或雷帕霉素[15]。我国经济目前也跻身于国际先进行列,新型mTOR激酶抑制剂MTI-31已进入临床研究阶段[16]。本研究拟明确MTI-31对HER2过表达和基底样乳腺癌细胞的作用并初步探究其药理机制。
1 材料与方法
1.1 实验试剂
MTI-31(货号:BCP36715)、雷帕霉素(货号:BCP01404)和拉帕替尼(货号:BCP01815)购自瀚翔生物科技公司。多西他赛(货号:MB1081)购自大连美伦生物技术有限公司。吐温-80(Tween-80,货号:P1754),丽春红(货号:P3504),羧甲基纤维素钠(CMC-Na,货号:21904)和二甲基亚砜(DMSO,货号:D8418)均购自美国Sigma-Aldrich公司。精密称定MTI-31、雷帕霉素、拉帕替尼和多西他赛适量,加入一定体积的DMSO溶液配置成20 mmol/L的储备液,涡旋混合均匀后分装并保存于-80 ℃备用。BD Matrigel基质胶(货号:356234)购自美国BD公司。shBim1和shBim2的序列分别为:5′-TAC ACA AAA TCC TGC TCC A-3′、5′-ATC TCT GGG CGC ATA TCT G-3′。
1.2 细胞培养
胎牛血清(货号:AQ-mv-09900)购自美国Analysis Quiz公司。青霉素-链霉素(货号:15140163)和丙酮酸钠(货号:11360070)购自美国ThermoFisher公司。乳腺癌细胞MDA-MB-453购自中国科学院细胞库;HCC1806购自美国典型培养物保藏中心。MDA-MB-453培养于MEM培养基(含10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素和丙酮酸钠);HCC1806则培养于RPMI-1640完全培养基(含10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)中。细胞放置于Eppendorf CellXpertC170i CO2培养箱,在37 ℃,5% CO2条件下培养,根据需求调整传代倍数。
1.3 异种移植瘤模型的建立与给药方案
订购5~6周龄BALB/c雌性裸鼠,并在无特殊病原体(SPF)级环境中适应性饲养1周。复苏并培养MDA-MB-453和HCC1806,用无血清培养基配置一定浓度的细胞悬液(MDA-MB-453需要1∶1添加基质胶),并皮下注射200 μL制备好的细胞悬液(MDA-MB-453,7×106个细胞/瘤块;HCC1806,5×106个细胞/瘤块)。根据公式: 计算获得瘤体积并分组(每组小鼠数量≥5只)。
利用0.5 %的CMC-Na溶剂配置MTI-31溶液,按照40 mg/kg的剂量每天灌胃1次。分别取等体积的无水乙醇和Tween-80混合后涡旋振荡,配制成含50%无水乙醇及50%Tween-80(v/v)的溶液;保存于4 ℃冰箱备用。每次给药前,称取适量的多西他赛加入适量体积的上述溶剂涡旋振荡,使药物完全溶解,再加入适量体积生理盐水,涡旋振荡,使液体混合均匀,乙醇和Tween-80终浓度均为12.5%,现配现用。按照15 mg/kg的剂量尾静脉注射给药,每周1次。给药前量取瘤块体积,并对小鼠进行称重。
1.4 蛋白免疫印迹(Western blot)法
利用NuPAGELDS(货号:NP0007)制备蛋白样品,然后经10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)分离总蛋白,随后采用电转硝酸纤维素膜转膜。转膜后利用丽春红染色,观察蛋白上样量,之后用TBST溶液漂洗。配置5%脱脂奶粉,于室温条件下封闭1~2 h。根据抗体说明书,按照比例稀释抗体[抗体Cleaved PARP(货号:5652)和Bim(货号:2933S)购自美国Cell Signaling Technology公司,GAPDH(货号:AP0063)购自美国Bioworld公司]并于4 ℃条件下孵育过夜。经TBST溶液漂洗3次后,用辣根过氧化酶标记的山羊抗兔二抗(货号:BS13278,购自美国Bioworld公司)在室温孵育2 h。TBST漂洗之后,利用化学发光试剂盒,在Bio-Rad成像仪中曝光,获取条带数据。
1.5 免疫组织化学
取新鲜瘤组织浸没在4%的中性多聚甲醛中,经脱水、包埋和切片后,获取厚度为4 μm的切片。随后进行抗原修复,配置5%的BSA溶液室温封闭1~2 h。之后一抗4 ℃孵育过夜。复温后,孵育二抗,之后利用DAB反应液进行显色,并用苏木素进行复染。最后利用莱卡显微镜进行拍摄。
1.6 统计学处理
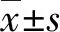
2 结 果
2.1 MTI-31对MDA-MB-453异种移植瘤的影响
在MDA-MB-453异种移植瘤模型中,当平均瘤体积达到(488.34±41.90)mm3时开始给药,并分为3组,MTI-31组1、多西他赛组1、对照组1(灌胃无水乙醇和Tween-80溶剂)。在初次给药后的第4、8天,MTI-31组1与对照组1瘤体积比较差异有统计学意义(P<0.05);到第11天MTI-31组1瘤体积降至(175.13±16.01)mm3。多西他赛组1与MTI-31组1的疗效相近,尽管在给药后的第4天多西他赛组1瘤体积与对照组1比较差异无统计学意义(P>0.05),但是到第8天时多西他赛组1瘤体积与对照组1比较差异有统计学意义(P<0.01);第11天时多西他赛组1进一步缩减至(154.21±14.16)mm3。为了明确多西他赛与MTI-31的联合效应,当对照组1瘤体积长到(561.92±72.79)mm3时联合给予2种药物(联合组)。给药后第3天联合组瘤体积迅速缩减至(358.31±53.01)mm3。在给药期间各组小鼠的体重差异无统计学意义(P>0.05)。见图1。
2.2 MTI-31对HCC1806异种移植瘤的影响
MTI-31和多西他赛在HCC1806异种移植瘤中的作用与MDA-MB-453相比呈现明显区别。当小鼠瘤体积达到(486.37±66.71)mm3时开始给药,将细胞分为3组,MTI-31组2、西他赛组2、对照组2(灌胃无水乙醇和Tween-80溶剂);MTI-31组2瘤体积的生长在第3、5天明显放缓,但到第7天时较给予前增长了31.74%(P<0.01)。多西他赛组2的整体趋势与MTI-31组2相近,在第7天时MTI-31组2、西他赛组2分别与对照组2比较,差异均有统计学(P<0.05或0.01)。给药期间,对照组2小鼠的体重相对稳定,末次给药时MTI-31组2的小鼠体重较给药前降低明显(23%,P<0.01);多西他赛组2则降低了16%(P<0.05)。见图2。因此后续实验选取MDA-MB-453为实验细胞。

A:瘤体的体积;B:小鼠的体重;a:P<0.05;b:P<0.01,与对照组1比较。

A:瘤体的体积;B:小鼠的体重;a:P<0.05;b:P<0.01;c:P<0.001,与对照组2比较。
2.3 Bim介导MDA-MB-453的凋亡性死亡
2.3.1MTI-31诱导MDA-MB-453死亡依赖于Bim
为了进一步研究MTI-31诱导MDA-MB-453异种移植瘤消退的分子机制,笔者在体外利用细胞进行研究。利用shBim1和shBim2构建Bim敲减的MDA-MB-453,细胞分为shNT组(无意义序列)、shBim1组、shBim2组,随后进一步分别给予溶剂(DMSO)、MTI-31(5 μmol/L)、雷帕霉素(1 μmol/L)、拉帕替尼(5 μmol/L)和多西他赛(1 μmol/L)。shNT组与各药物共孵育72 h后,MTI-31、拉帕替尼和多西他赛诱导MDA-MB-453,细胞分别死亡了(47.0±9.2)%、(83.0±3.3)%和(46.0±3.3)%,然而雷帕霉素仅抑制细胞的增殖(67.0±25.7)%。其中,MTI-31处理的shBim2组细胞死亡较MTI-31处理的shNT组减少,差异有统计学意义(P<0.05);而MTI-31处理的shBim1组细胞死亡较MTI-31处理的shNT组减少,但差异无统计学意义(P>0.05)。见图3。因此,后续实验选shBim2作为MDA-MB-453的干扰序列。

a:P<0.05;b:P<0.001,与各系药物的shNT组比较。
2.3.2敲减Bim后MTI-31诱导的凋亡生物标志物Cleaved-PARP明显减少
将MDA-MB-453分为2组:shNT组和shBim2组,然后分别用溶剂和MTI-31(5 μmol/L)处理。给予DMSO处理的shNT、shBim2组Bim、Cleaved-PARP蛋白表达水平无变化(P>0.05);给予MTI-31处理的shBim2组Cleaved-PARP和Bim表达水平均较shNT组明显降低(P<0.05),结果提示敲减Bim后可逆转MTI-31引起的MDA-MB-453细胞凋亡。见图4。

A:Western blot;B:光密度定量分析;a:P<0.01。
2.3.3MTI-31可诱导MDA-MB-453异种移植瘤表达Bim
MDA-MB-453异种移植瘤模型MTI-31给药11 d后,取瘤块并利用免疫组织化学检测Bim的表达情况。结果显示,MTI-31处理组的瘤组织中Bim表达较DMSO处理组明显增加,见图5。

图5 MTI-31可诱导MDA-MB-453皮下瘤表达Bim
3 讨 论
MDA-MB-453的基因背景为PIK3CA突变,同时是HER2高表达乳腺癌细胞[17]。HCC1806的PI3K属野生型且不表达HER2[18]。这两类细胞分别代表了临床分子分型为HER2高表达和基底样的乳腺癌。本研究结果显示,应用mTOR激酶抑制剂MTI-31后,MDA-MB-453异种移植瘤出现消退,这种作用与当前的一线化疗药物多西他赛相近。HER2高表达情况下,其下游的PI3K/Akt/mTOR通路被激活。同时,PIK3CA突变状态下mTOR信号通路也异常活化。因此MDA-MB-453乳腺癌对mTOR激酶抑制剂的响应较好,很大程度上取决于它对mTOR信号的依赖性。对HCC1806来说,其生存与生长不依赖于mTOR信号通路。因此,MTI-31作用于HCC1806移植瘤仅体现出生长抑制作用。PIK3CA和HER2过表达与mTOR激酶抑制剂的疗效密切相关。
在MDA-MB-453中,雷帕霉素仅抑制其生长。雷帕霉素是经典的mTOR变构抑制剂,可显著阻断mTORC1的功能,通过抑制基因的转录最终实现阻碍细胞增殖的作用。而MTI-31全盘抑制mTOR通路包括mTORC1和mTORC2,既具有抑制mTORC1而产生的生长抑制作用,又具有阻断mTORC2的特有生物学效应。特别是mTORC2,由于在细胞代谢、生存中起重要作用,已成为一个研究热点[19-20]。Bim是细胞凋亡相关性蛋白,有文献已明确其在拉帕替尼和多西他赛诱导乳腺癌细胞死亡中的关键作用[21-22]。通过特异性敲减Bim可显著减弱MTI-31及对照药物的疗效。结果提示mTORC2/Bim轴与MDA-MB-453的生存有关。有文献提示在乳腺癌中mTORC2可活化Akt进而调控FOXO3a Thr32位点的磷酸化[23]。同时,也有研究指出FOXO3a调控Bim介导细胞的凋亡[24]。因此,mTOR激酶抑制剂诱导MDA-MB-453乳腺癌凋亡的机制很可能是通过mTORC2/FOXO3a/Bim实现的,但是有待进一步研究确证。
mTOR激酶抑制剂可诱导MDA-MB-453异种移植瘤的消退,但仅抑制HCC1806异种移植瘤的生长。其疗效与多西他赛相当。在体内和体外,MTI-31、拉帕替尼和多西他赛均能诱导MDA-MB-453乳腺癌细胞凋亡性死亡,且其作用与诱导Bim表达有关。
