转基因溶菌酶羊hLZ-J1品系特异性数字PCR方法及样本中痕量转基因成分检测
2022-11-18王艺洁徐文婷杨立桃梁晋刚
王艺洁,徐文婷,杨立桃,梁晋刚
(1.上海交通大学生命科学技术学院,上海 200240;2.农业农村部科技发展中心,北京 100176)
人溶菌酶(Human lysozyme,hLZ)是一种糖苷水解酶,作为天然抗生素广泛分布于泪液、唾液、血液、乳汁和其他分泌物中[1],在宿主防御中发挥重要作用。体液中的溶菌酶保护机体,使其免受细菌的侵袭;而母乳中的溶菌酶可以传递给儿童,帮助他们建立先天免疫屏障。目前,溶菌酶已被证明具有抗细菌、真菌,抗炎症,预防感染等功能[2-6],已被用于食品工程中的防腐剂、乳品添加剂及炎症治疗等领域[7-9]。
溶菌酶天然存在于乳汁中,牛乳和山羊乳中仅含有0.130和0.250 μg/mL的溶菌酶,而人乳中含有400 μg/mL,其浓度是家畜乳汁的1600~3000倍[10]。受天然人溶菌酶的限制,随着转基因动物技术的发展,多种转基因溶菌酶家畜被研发出来[11-15],可在乳腺中表达大量的人溶菌酶。如Yu等[11]构建的转基因溶菌酶山羊,最高可在羊乳中表达6.2 mg/mL的人溶菌酶;Jia等[14]构建的转基因溶菌酶猪可在乳汁中表达0.320 μg/mL的溶菌酶,比天然猪生产的溶菌酶高50倍;Yang等[15]构建的转基因溶菌酶牛可在乳汁中表达25.96 μg/mL重组溶菌酶。
由于转基因动物技术的快速发展及产业化应用的需求,2017年我国制定了《转基因动物安全评价指南》,其中除了分子特征、遗传稳定性等评价内容外,还包括转基因动物对环境的影响等内容[16,17]。转基因动物对环境的影响,如基因水平转移等不可忽视[18]。目前,已有研究发现土壤、水、粪便、尿液及唾液中存在果蝇、老鼠和脂鲤等转基因动物的人工序列残留[19]。同时,公众对转基因生物及其产品的安全性仍存在担忧,需要对转基因产品进行明确标识[20]。因此,转基因动物的环境安全评价和标识管理都需要建立可靠、灵敏的检测技术和方法。
转基因生物及产品的检测方法根据检测对象分为核酸检测方法和蛋白质检测方法两类。核酸检测方法因为检测灵敏度高,稳定性好等优点,被广泛应用于转基因检测。根据检测靶序列的不同,核酸检测方法可以被分为四类,分别是通用元件、基因特异性、构建特异性及品系特异性。其中,品系特异性也被称为转化事件特异性,其检测的靶标序列包括外源DNA和外源基因整合位点两侧的受体基因组序列,品系特异性检测的特异性最高[21]。根据扩增技术和产物检测方法的不同,核酸检测方法还可以分为聚合酶链式反应(PCR)、多重PCR、实时定量PCR[22]、微滴式数字PCR[23]。微滴式数字PCR(ddPCR)是将每个DNA分子分配到独立的油包水反应微滴中,通过PCR扩增后,根据泊松分布的原理,统计阳性微滴个数和比例来实现核酸分子的绝对定量。ddPCR可检测出低拷贝痕量样本,灵敏度极高,且无需建立标准曲线,因此相较于传统PCR和定量PCR存在明显优势[24]。
在转基因溶菌酶羊的监管中,主要是针对转基因动物本身和其生产的产品,如羊奶、羊奶制品等。针对这些制品的检测,目前的荧光定量PCR技术存在灵敏度低、依赖标准物质等缺点。因此,本研究利用数字PCR技术,开发了一种转基因溶菌酶羊品系特异性定量检测方法。并将其应用于转基因溶菌酶羊样品及其环境样本的检测,从而为转基因成分标识、遗传稳定性、基因水平转移等环境安全评价提供高灵敏的检测新方法。
1 材料与方法
1.1 材料
G0代转人溶菌酶基因山羊(hLZ-J1)是由上海转基因研究中心和上海杰隆生物工程股份有限公司通过体细胞克隆技术开发的,并由G0代繁育出F1~F8代[11]。从转基因山羊hLZ-J1品系的后代共采集5份颈动脉血液样本(编号为B254,B325,B490,B514,B241),2份羊乳样本(编号为M221,M141),5份羊粪样本(编号为F1~F5)及4份转基因羊羊圈的土壤样本(编号为S1~S4)。从非转基因山羊中采集1份颈动脉血液样本(编号为B222),2份羊乳样本(编号为M388,M262),1份羊粪样本(编号为F6)及1份非转基因山羊羊圈土壤样本(编号为S5)。转基因人乳清蛋白(hSA)山羊,转基因阮病毒(PRNP)敲除山羊,转基因人乳铁蛋白(hLF)山羊的血液样本由上海杰隆公司提供。
1.2 DNA提取
使用TIANamp Genomic DNA Kit(DP304,TIANGEN Biotech,北京)从200 µL血液或2 mL羊乳样本中提取DNA。使用QIAamp Fast DNA Stool Mini Kit(51604,QIAGEN,上海)从500 mg粪便样本中提取粪便DNA。使用DNeasy Power Soil Kit(142579,QIAGEN,上海)从500 mg土壤样品中提取土壤DNA。使用NanoDrop 2000(Thermo Fisher Scientific,Waltham Mass,MA)对提取的DNA进行质量评估和浓度测定。提取的DNA在-20 ℃冰箱冷冻储存备用。
1.3 数字PCR引物探针设计与合成
基于品系特异性检测原理,根据转基因羊hLY-J1的品系特异性序列,使用软件Beacon Designer 8设计引物和探针,序列见表1和图1。山羊催乳素受体基因(PRLR)为内源性参考基因,其引物和探针(表1)来自本实验室已发表的研究[25]。本研究所用的引物和探针均订购自Invitrogen(上海)公司。
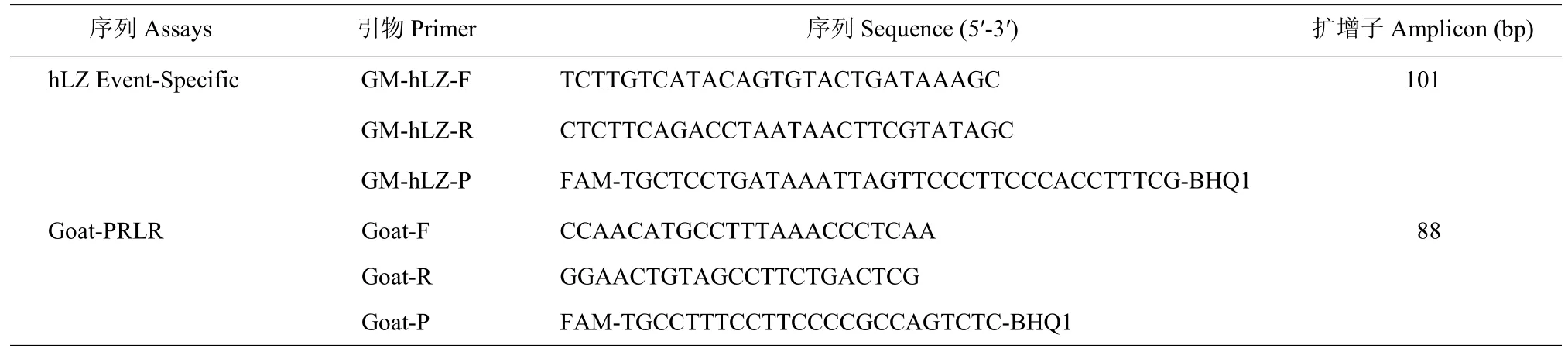
表1 引物和探针序列Table 1 The sequence of primers and probes

图1 转基因溶菌酶羊hLZ-J1品系特异性引物和探针的信息和位置示意图Fig.1 Schematic information and location of the event-specific primers and probe for GM event hLZ-J1
1.4 常规PCR
常规PCR的反应体积为25 μL,含有2×Hieff PCR Master Mix 12.5 µL,上下游引物(10 μmol/L)各1µL,10 ng基因组DNA模板,用ddH2O补齐25 µL。PCR程序:预变性94 ℃,5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸10 s,共35个循环;72 ℃延伸10 min。常规PCR扩增的片段大小为101 bp。
1.5 微滴式数字PCR(ddPCR)反应
ddPCR试验在Bio-Rad公司的QX200微滴式数字PCR仪上完成。整个试验包括ddPCR反应体系配制、微滴生成、PCR扩增反应及荧光信号读取 4个步骤。反应体系配置:于冰上加入 2×ddPCR Supermix(1863024,Bio-Rad)10 μL,上下游引物(10 μmol/L)各 1 μL,探针(10 μmol/L)0.5 μL,1 μL DNA 模板和6.5 μL ddH2O,补足20 μL ddPCR反应体系。微滴发生:将ddPCR反应液转移至微滴发生卡的小孔中,于发生卡下方一排小孔中加入微滴发生油70 μL,盖上胶垫后,放入Bio-Rad QX200微滴生成仪中制备微滴。ddPCR扩增:将微滴通过移液器转移至96孔板中,使用配套铝膜热封。放入常规PCR仪反应,扩增程序为95 ℃ 5min;95 ℃ 30 s,58 ℃ 1 min,40个循环;98 ℃ 10 min。荧光信号读取:将扩增后的96孔板转移至BIO-RAD QX200 Droplet Reader仪器中读取,使用配套软件QuantaSoft分析数据。
2 结果与分析
2.1 方法特异性验证试验
为了验证转基因溶菌酶羊hLZ-J1品系特异性ddPCR检测方法(后文简称“本方法”)的特异性,以转基因人溶菌酶山羊hLZ-J1、转基因人乳清蛋白山羊、转基因阮病毒敲除山羊、转基因人乳铁蛋白山羊和非转基因山羊的血液样本DNA为模板,分别利用常规PCR和ddPCR进行测试。在常规PCR分析中,使用ddPCR引物对以上样本进行PCR扩增,2%琼脂糖凝胶电泳可以观察到转基因羊hLZ-J1为模板的反应得到长度为101 bp扩增子,而转基因人乳清蛋白山羊、转基因阮病毒敲除山羊、转基因人乳铁蛋白山羊、非转基因山羊及H2O未发生扩增(图2A),说明该引物具有良好的特异性。在ddPCR反应中,所有样本均有高质量微滴生成,微滴数在 11980~14216。转基因羊hLZ-J1有阳性微滴生成,且阳性微滴和阴性微滴界限分明,而转基因人乳清蛋白山羊、转基因阮病毒敲除山羊、转基因人乳铁蛋白山羊、非转基因山羊和H2O均无阳性微滴生成(图2B),说明设计的引物、探针特异性好,建立的方法可以特异性地检测转基因羊hLZ-J1的成分。
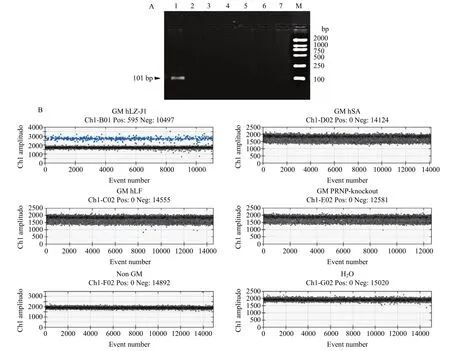
图2 PCR和ddPCR验证方法的特异性Fig.2 Specificity evaluation using conventional PCR and ddPCR
2.2 方法灵敏度及可重复性试验
为了研究本方法的适用性,分别对方法的灵敏度、稳定性和可靠性进行了测试。利用梯度稀释法,将转基因羊hLZ-J1血液DNA溶液分别稀释为7个不同浓度(6000、600、60、30、15、10和5拷贝/µL)的DNA稀释液,分别作为模板进行ddPCR分析测定,每个反应设置3个重复。试验结果如表2所示,7个浓度样品的hLZ-J1拷贝数分别为6693.33、657.33、65.00、26.67、16.47个拷贝,测定值与理论值接近,拷贝数的标准差(SD)介于0.46~70.24,相对标准偏差(RSD)介于1.05%~12.87%,均在可接受范围内(小于25%)。且随着DNA模板浓度的增加,相对标准偏差越小,越准确。上述结果表明本方法的可重复性好,可用于转基因羊hLZ-J1成分的检测。
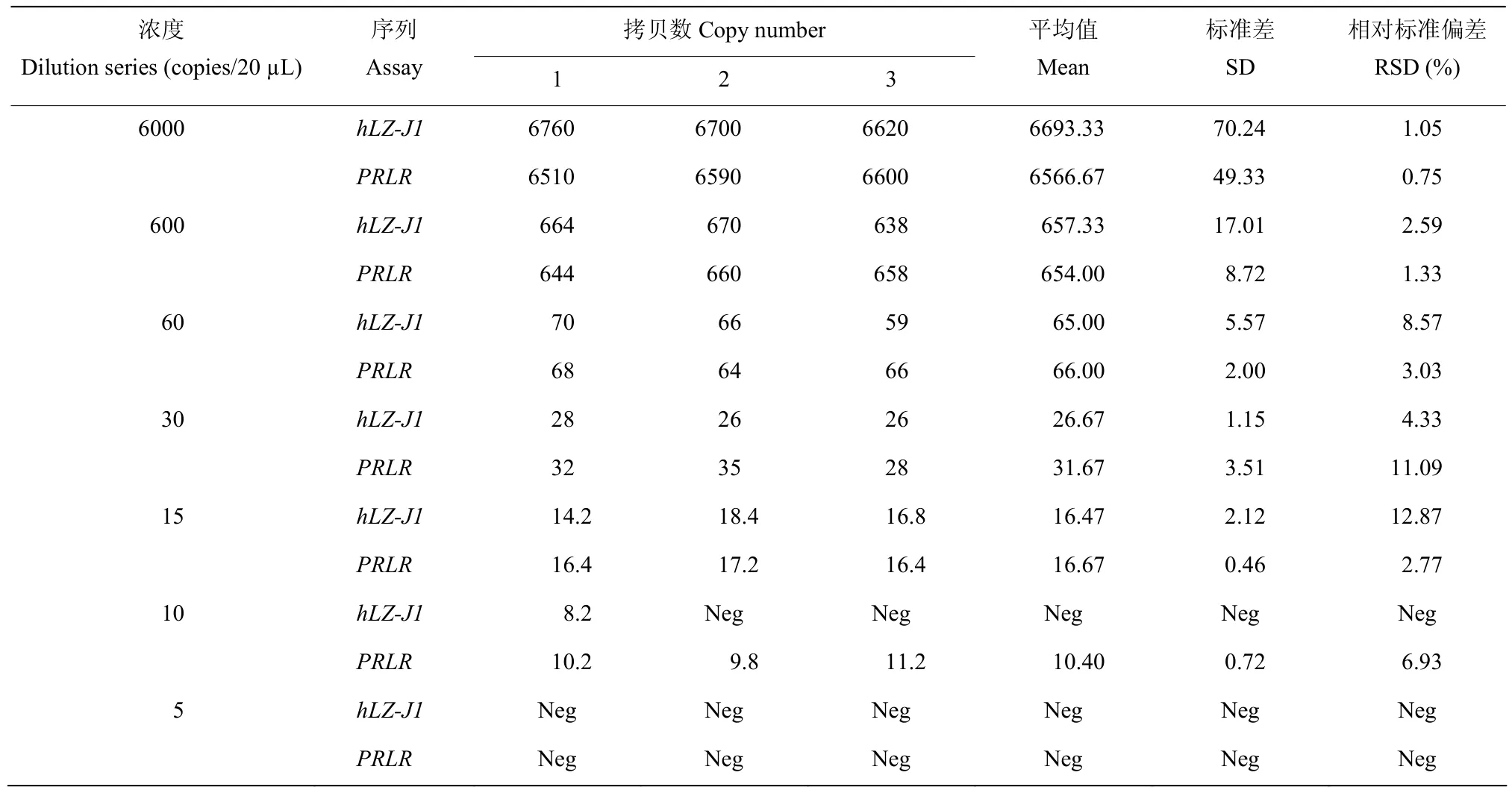
表2 品系特异性ddPCR方法的灵敏度及可重复性分析Table 2 Sensitivity and repeatability evaluation of the event-specific ddPCR assay
根据图3微滴生成结果显示,从每反应模板6000拷贝到15拷贝的样本均产生阳性微滴,且阳性微滴和阴性微滴区分明显。其中,反应模板为15拷贝时,相对标准偏差为12.87%;反应模板为10拷贝时,未检测到阳性微滴。因此可以确定,本方法的检测限(limit of detection,LOD)和定量限(limit of quantification,LOQ)均为每反应15个拷贝。因此,当反应体系中转基因羊hLZ-J1的基因组DNA大于15个拷贝时,均能实现准确定量。
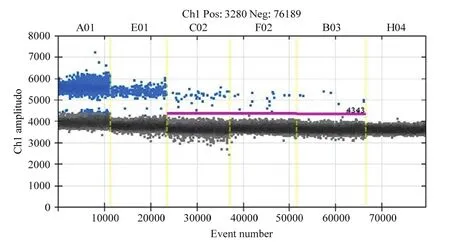
图3 转基因羊hLZ-J1品系特异性ddPCR灵敏度试验Fig.3 Sensitivity evaluation of the event-specific ddPCR assay of transgenic goat hLZ-J1
2.3 实际样本的检测
我们进一步利用本方法对四类实际样本进行定量检测,评估方法的适用性。四类实际样本分别是血液、羊乳、粪便和土壤,具体包括6个血液样本、4个羊乳样本、6个山羊粪便样本和5个山羊羊圈环境土壤样本,所有样本测试均重复3次。检测结果如表3所示,在羊血样本中,B254,B325,B490,B514,B241的hLZ-J1拷贝数分别为4863.33、7490、4496.67、5020、6886.67个拷贝,相对标准偏差范围为0.35%~2.02%,山羊内源基因拷贝数分别为4753.33、7406.67、4450.00、4896.67、6516.67个拷贝,相对标准偏差在0.31%~2.51%,结果说明这些血液样本均来自转基因羊 hLZ-J1,且溶菌酶外源基因能在其后代中稳定遗传。在B222血液样本的检测中,山羊内源基因拷贝数为7683.33个拷贝,RSD为0.49%,检测不到hLZ基因,说明B222不来源于转基因羊hLZ-J1。
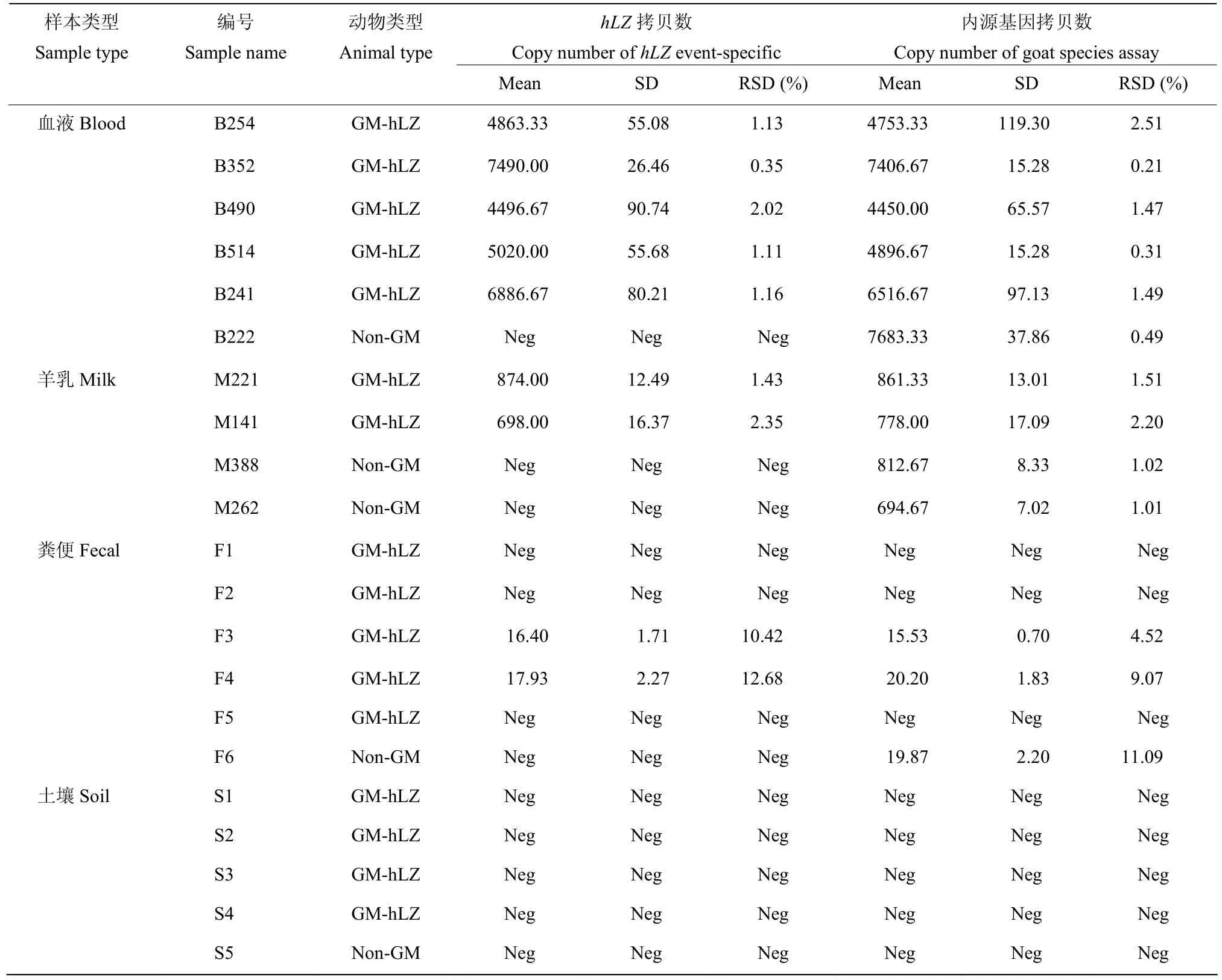
表3 实际的血液、羊乳、粪便和土壤样本ddPCR检测结果Table 3 ddPCR results of practical samples of blood, milk, fecal, and soil
在羊乳样本的检测中,M221和M141的hLZ-J1拷贝数分别为874和698个拷贝,相对标准偏差分别为1.43%和2.35%;内源基因拷贝数分别为861.33和778.00个拷贝,相对标准偏差分别为1.51%和2.20%,说明这些羊乳来自转基因羊hLZ-J1。在M388、M262中检测到山羊内源基因含有812.67、694.67个拷贝,RSD分别为1.02%和1.01%,但是检测不到转基因羊hLZ-J1的成分,说明M388、M262中不含转基因羊hLZ-J1羊乳的成分。这些结果表明转基因山羊hLZ-J1羊乳样品中普遍存在基因组DNA,可能来源于乳腺中脱落的体细胞。
在山羊粪便样本的检测中,样本 F3、F4、F6均观察到山羊内源基因的扩增,分别为 15.53、20.20、19.87个拷贝,其微弱的阳性信号说明粪便中可能含有山羊消化道脱落细胞。在这三个样本中,仅有F3和F4检测到hLZ-J1的扩增,拷贝数分别为16.4和17.93个拷贝,相对标准偏差分别为10.42%和12.68%,这两个样品的hLZ-J1拷贝数均在定量限附近,且相对标准偏差均小于25%,说明F3和F4粪便样本均来自转基因山羊hLZ-J1。除此之外,在其他粪便样本(F1、F2和F5)中,均检测到hLZ-J1和羊内源基因的扩增。这些结果表明,部分羊粪便样本可以检测出羊基因组DNA和转基因羊hLZ-J1基因组DNA,这部分DNA可能源于羊肠道脱落的细胞。
在5个羊圈环境土壤样本中,均未检测到羊内源基因成分和hLZ-J1转基因成分,表明转基因山羊的羊圈环境土壤样本中不存在羊和转基因羊hLZ-J1的基因组DNA残留。粪便和土壤样本的检测结果表明,转基因羊hLZ-J1基因组DNA在消化道和羊圈环境土壤中未发生可以观测到的基因水平转移。
3 讨论
本研究建立了一种转基因人溶菌酶山羊品系特异性微滴数字PCR检测方法。该方法具有良好的特异性和灵敏度。方法的检测限和定量限均达到每反应15个拷贝,且反应重复性好,相对标准偏差小于12.87%,满足转基因产品成分定量检测方法的要求。本方法与实验室以前开发的转基因溶菌酶羊qPCR检测方法相比[26],具有更高的灵敏度。同时,建立的 ddPCR方法不需要构建标准曲线就可以对样本进行定量,更加便捷。本方法的建立为转基因羊hLZ-J1的鉴定、遗传稳定性评估、环境安全评价提供了可靠的技术支持。
随着转基因动物的研究及产业化应用,其对环境的影响逐渐引起广泛关注。例如,转基因动物 DNA是否会通过粪便、皮肤细胞、尸体分解及其他方式转移到环境中;转基因动物逃逸是否会将外源基因引入非预期的种群和物种中等问题。目前研究发现,转基因DNA在自然环境中留存的时间远超出预期,已有部分研究报道转基因植物的DNA在环境样本里可以被检测到[27],且在不同自然环境中的留存时间也不尽相同,例如,在水生环境中可以保存数小时至数天,在陆地土壤环境中可以存在数天至数年[28]。但目前对于转基因动物DNA的水平转移研究甚少,人们对转基因动物DNA的传播及对生态的影响还存在较大的疑虑。本研究通过对粪便和土壤实际样本的检测,说明部分粪便中存在痕量转基因羊 hLZ-J1品系特异性序列DNA,可能来自于消化道脱落细胞。但在土壤中未检测出转基因DNA成分,尽管山羊消化道的脱落细胞可能存在于粪便当中,但粪便沉积在土壤中,户外环境能够迅速降解 DNA。因此,转基因动物基因组DNA无法在环境中长期存在,进而在土壤微生物间发生转基因DNA的基因水平转移。
