转cry30Fa1水稻对褐飞虱NlHRP基因表达模式的影响
2022-11-18普琪雯焦慧宇区文韬刘健丽
普琪雯,焦慧宇,区文韬,刘健丽,林 胜
(福建农林大学闽台作物有害生物生态防控国家重点实验室/福建农林大学海峡两岸特色作物安全生产省部共建协同创新中心/福建省农产品安全研究平台/害虫绿色防控福建省高校重点实验室,福州 350002)
水稻Oryza sativa是世界上分布最广、人类食用最多的粮食作物之一。褐飞虱被认为是对水稻最有威胁的害虫之一[1],主要以水稻韧皮部汁液为食物来源。由于缺乏抵抗褐飞虱入侵的第一道“屏障”,我国褐飞虱出现了连年暴发的现象,造成了巨大的经济损失[2]。抗性水稻一直是防治稻飞虱研究中的焦点,目前已成功育成了携带bph1和bph2基因的抗稻飞虱水稻[3],但很快就被稻飞虱适应[4-6]。自20世纪80年代以来,没有其他基因被广泛应用于现代水稻品种中。尽管如此,即使针对从未广泛应用的基因,稻飞虱种群适应转基因水稻的能力也有所增加(如bph8、Bph9、BPH25、BPH26)[6,7]。
cry30Fa1是由朱军等[8]通过菌株分离,鉴定出的1种新型Bt杀虫晶体蛋白基因。近期,王海鹏[9]通过农杆菌介导法将cry30Fa1转入受体水稻蜀恢818(R818)中,通过对目的基因的表达水平检测、苗期抗虫性鉴定和田间抗虫性鉴定等途径实现了对抗褐飞虱cry30Fa1的优化及成功转化。福建省农业科学院农业遗传工程重点实验室通过农杆菌转化法将cry30Fa1转入明恢86水稻(MH86)的愈伤组织中,在进一步诱导培育下得到新型转cry30Fa1水稻(KF30-14)[10]。本课题组前期研究发现,KF30-14能有效抑制褐飞虱雌成虫体质量、卵巢发育及繁殖力[11,12],但相关影响机制尚不清楚。
课题组通过相关转录组数据分析发现,取食KF30-14水稻的褐飞虱雌虫的NlHRP基因显著表达,其主要编码富组氨酸蛋白。组氨酸(His)是褐飞虱的必需氨基酸之一,在其生长发育中起着关键作用[13-15]。因此,本研究克隆了NlHRP基因,并研究了转cry30Fa1水稻(KF30-14)对其表达模式的影响,旨在为揭示转cry30Fa1水稻抗褐飞虱的分子机制提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试水稻 转cry30Fa1水稻(KF30-14)与其亲本水稻明恢86(MH86)均由福建省农业科学院农业遗传工程重点实验室提供。
1.1.2 供试昆虫 褐飞虱饲养于福建农林大学应用生态研究所人工气候室,温度(28±1)℃,光周期16L∶8D,相对湿度(80±1)%。已在KF30-14和MH86上连续饲养30代以上。
1.1.3 主要试剂与试剂盒 如表1。
表1 主要试剂与试剂盒Table 1 The mainly reagent and kits
1.1.4 主要仪器与设备 如表2。

表2 主要仪器Table 2 The mainly instrument
1.2 目的基因筛选
通过对比KF30-14实验种群与MH86实验种群中羽化3 d的褐飞虱雌雄成虫和褐飞虱3龄若虫的转录组数据,对显著差异基因进行分析。转录组数据与参考序列比对后,通过维恩图进行差异表达基因筛选。
1.3 NlHRP的序列及其表达模式分析
1.3.1 RNA提取及cDNA合成 用Trizol试剂提取褐飞虱组织与整虫的总RNA。步骤如下:取收集好的褐飞虱整虫或组织置于1.5 mL无酶离心管,再于每管加入2颗3 mm的钢珠,使用组织破碎仪进行30 s(30 Hz)破碎;取200 µL Trizol试剂,加入离心管中,使用组织破碎仪进行30 s(30 Hz)破碎后常温静置10 min;再加40 µL氯仿于每个离心管中,振荡5 s后常温静置10 min;4 ℃ 13000 r/min离心10 min;吸75 µL上清液,并转移至新离心管;加75 µL同体积异丙醇后振荡5 s混匀,将离心管置于-20 ℃冰箱中3 h以上;4 ℃ 13000 r/min离心20 min后弃上清;加600 µL无水乙醇,振荡至沉淀悬浮,从而达到洗涤沉淀的目的;4 ℃ 13000 r/min 离心10 min后弃上清;加600 µL 无水乙醇,再次洗涤沉淀;4 ℃ 13000 r/min离心10 min后倒上清,用吸水纸吸取多余液体,侧倒在通风橱里用吹风机冷风吹干;加适量DEPC水溶解RNA,剧烈振荡1 min;1%的琼脂糖凝胶检测,并使用核酸检测仪检测RNA浓度及质量。
使用FastKing gDNA Dispelling RT SuperMix(TIANGEN,KR118)试剂盒将RNA反转录,合成第一链cDNA。根据试剂盒说明书在冰上配置反转录混合液,5×FastKing-RT SuperMix 4 µL,Total RNA定量到1 µL,RNase-Free ddH2O补足到20 µL,瞬离至没有气泡后放入PCR仪中进行以下程序:42 ℃,15 min;95 ℃,3 min。将得到的cDNA放到-20 ℃冰箱保存。
1.3.2NlHRPEST序列扩增 以反转录产物为模板,以该基因在转录组测序中的预测序列设计引物NlHRP-F和NlHRP-R(表3),通过PCR扩增获得NlHRP的EST序列,PCR扩增程序为:95 ℃,3 min;5个循环(95 ℃,15 s;74 ℃,60 s);5个循环(95 ℃,15 s;72 ℃,60 s);5个循环(95 ℃,15 s;70 ℃,60 s);25个循环(95 ℃,15 s;68 ℃,60 s);68 ℃,5 min。

表3 NlHRP序列扩增PCR引物Table 3 PCR primer of NlHRP sequence amplification
1.3.3NlHRP全长cDNA的扩增 用HiScript-TS 5′/3′ RACE Kit试剂盒(Vazyme,China)进行NlHRP的全长扩增。根据NlHRP的EST序列设计RACE引物,NlHRP-R与试剂盒中的通用引物用于5′ cDNA末端的快速扩增,NlHRP-F与试剂盒中的通用引物用于3′ cDNA末端的快速扩增。扩增程序:98 ℃,1 min;25个循环(98 ℃,10 s;68 ℃,15 s;72 ℃,3 min);72 ℃,5 min。
取第1轮PCR产物,进行巢式PCR。NlHRP-inner-R、NlHRP-inner-F(表3)与试剂盒中的通用巢式引物用于第2轮巢式扩增。扩增程序:95 ℃,3 min;5个循环(95 ℃,15 s;74 ℃,60 s);5个循环(95 ℃,15 s;72 ℃,60 s);5个循环(95 ℃,15 s;70 ℃,60 s);25个循环(95 ℃,15 s;68 ℃,60 s);68 ℃,5 min。最终得到的产物通过电泳切胶进行回收纯化,将回收纯化产物连接到pESI-Blunt载体上,转化到DH5ɑ感受态中,挑选阳性克隆进行测序,菌株送往上海生工生物工程公司进行测序。
1.3.4NlHRP的序列分析NlHRP-2开放阅读框预测:NCBI ORFFINDER(https://www.ncbi.nlm.nih.gov/orffinder/);NlHRP蛋白保守结构域预测:NCBI Conserved Domain Seach(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);NlHRP蛋白的信号肽预测:SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0);NlHRP分子量、等电点预测:网站 Expasy(https://www.expasy.org/resources/protparam);NlHRP蛋白的二级结构预测:网站 Psipred(http://bioinf.cs.ucl.ac.uk/psipred/&psipred_uuid=ef7ef9dc-e415-11ec-a6b3-00163e100d53);NlHRP蛋白序列跨膜区域预测:网站DETTAIBIO(http://www.detaibio.com/tools/transmembrane.html)。
1.3.5 褐飞虱不同组织和不同发育阶段样品收集 收集羽化24、72、96 h的褐飞虱雌虫,每个样品4个生物学重复、每个重复至少含10头虫,液氮处理后置于-80 ℃冰箱中保存。
用医学显微解剖镊(5.SA)解剖褐飞虱雌虫的头、胸、中肠、脂肪体、卵巢各组织,其中脂肪体放入RNA laterTMRNA Stabilization Reagent(Qiagen,Germany)中保存,其他组织放入液氮中保存。每个样品4个生物学重复,每个重复至少30个虫体组织,液氮处理后放于-80 ℃冰箱中保存。
1.3.6NlHRP在褐飞虱不同发育时期、不同组织中的表达分析 根据基因NlHRP预测的保守结构域序列,通过NCBI Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi)设计荧光定量PCR引物。
将保存在-80 ℃冰箱中不同发育时期的褐飞虱与褐飞虱组织提取RNA,反转录,稀释至50 ng/µL。根据样品收集情况,设计4个生物学重复,3个技术学重复,Actin作为内参基因,使用qNlHRP-F/qNlHRP-R和Actin-F/Actin-R进行荧光定量PCR实验,引物序列见表4。根据试剂盒Taq Pro Universal SYBR qPCR Master Mix(Vazyme,China)说明书,在冰上配置qPCR混合液(表4)。使用实时荧光定量PCR仪,扩增程序如下:95 ℃,30 s;40个循环(95 ℃,10 s;60 ℃,30 s);95 ℃,15 s;60 ℃,1 min;95 ℃,1 s。

表4 荧光定量PCR反应体系Table 4 Reaction system of fluorescent quantitation PCR amplification
两个实验种群间NlHRP表达量的比较采用独立样本t检验。
2 结果与分析
2.1 目的基因获得
Venn图显示,KF30-14影响褐飞虱雌虫和3龄若虫的基因中表达量差异显著的共有基因31条,同时在雄虫与雌虫、若虫中有表达量差异显著的共有基因4条(图1)。通过对表达量有显著差异的基因进行分析,为选取与雌虫生殖相关的基因,在不含雄虫的雌虫与若虫的表达量显著差异的 27条基因中进行研究,并在后续试验中成功克隆出了基因NlHRP。
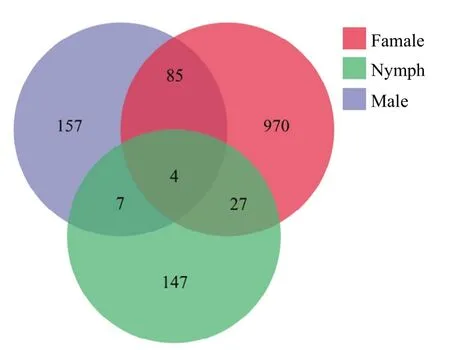
图1 两种水稻上的褐飞虱表达量差异显著的基因Venn图Fig.1 Venn diagram of genes with remarkably different expression between BPHs in the two rice
2.2 NlHRP的序列及表达模式
2.2.1NlHRP克隆及序列 经过对NlHRP全长序列克隆、测序、拼接,获得了基因NlHRP完整的CDS序列(图2)。克隆的NlHRP基因全长905 bp,位于褐飞虱2号染色体上。使用NCBI ORFFINDER预测NlHRP的开放阅读框,ORF长为837 bp,共编码278个氨基酸。通过网站Psipred预测该基因编码蛋白二级结构(图3),其中该蛋白包括ɑ-螺旋16.18%、β-折叠2.51%、无规则卷曲81.29%。用NCBI Conserved Domain Seach发现NlHRP编码的蛋白无保守结构域,用SignalP-5.0预测NlHRP蛋白的信号肽,预测氨基酸序列中1~19位氨基酸为该蛋白质的N端信号肽序列。通过DETTAIBIO网站对蛋白序列中的跨膜区域进行预测,结果显示该蛋白无跨膜结构,说明该蛋白可能是一个外分泌蛋白,利用信号肽来引导该蛋白定位分泌到细胞特定区间从而行使该蛋白的功能。经过网站 Expasy预测,该基因编码的蛋白分子量为31.4 kD,等电点为5.02。

图2 NlHRP的核苷酸序列及其预测的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequence of NlHRP
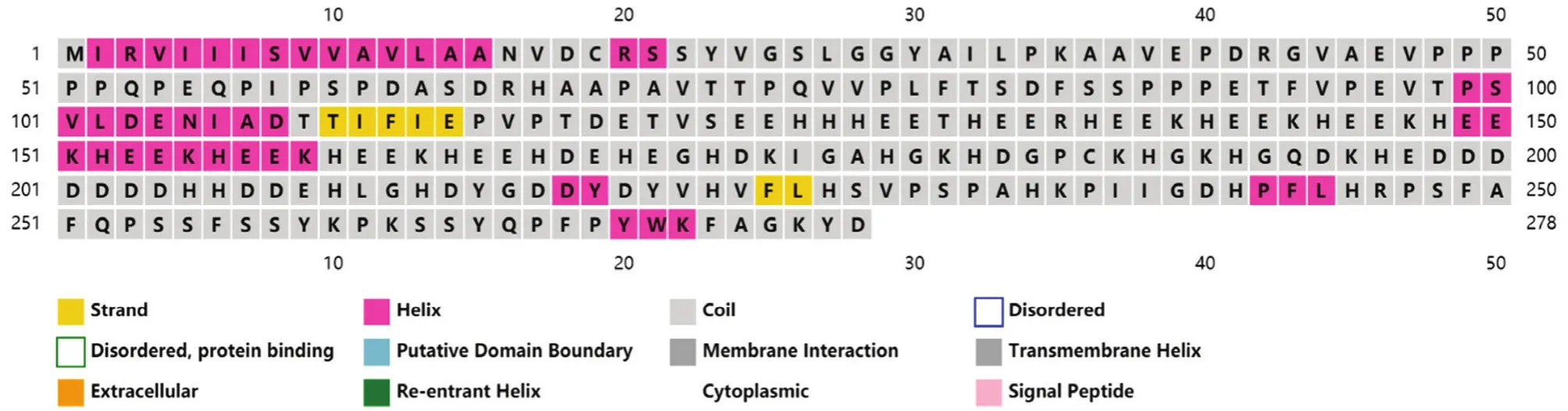
图3 NlHRP蛋白二级结构预测图Fig.3 Prediction diagram of secondary structure of NlHRP protein
2.2.2NlHRP表达模式 在羽化24、72、96 h时,NlHRP在KF30-14实验种群的褐飞虱雌虫的表达量均高于MH86种群,且在羽化72 h时KF30-14实验种群的NlHRP表达量显著高于MH86实验种群(图4)。不同组织的表达谱分析结果表明,NlHRP在头部、中肠、胸部都有较高的表达丰度,其中头部表达量最高(图5),且NlHRP在KF30-14实验种群褐飞虱头部的表达量显著高于MH86实验种群褐飞虱。
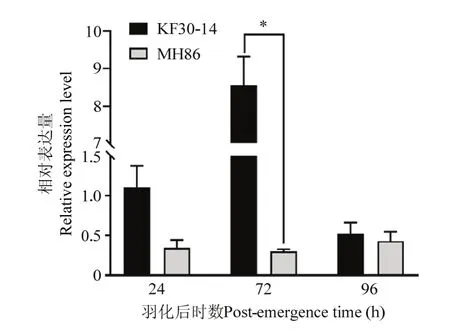
图4 褐飞虱分别在羽化24、72、96 h时NlHRP的表达量Fig.4 Expression levels of NlHRP in N.lugens at 24, 72 and 96 h after eclosion
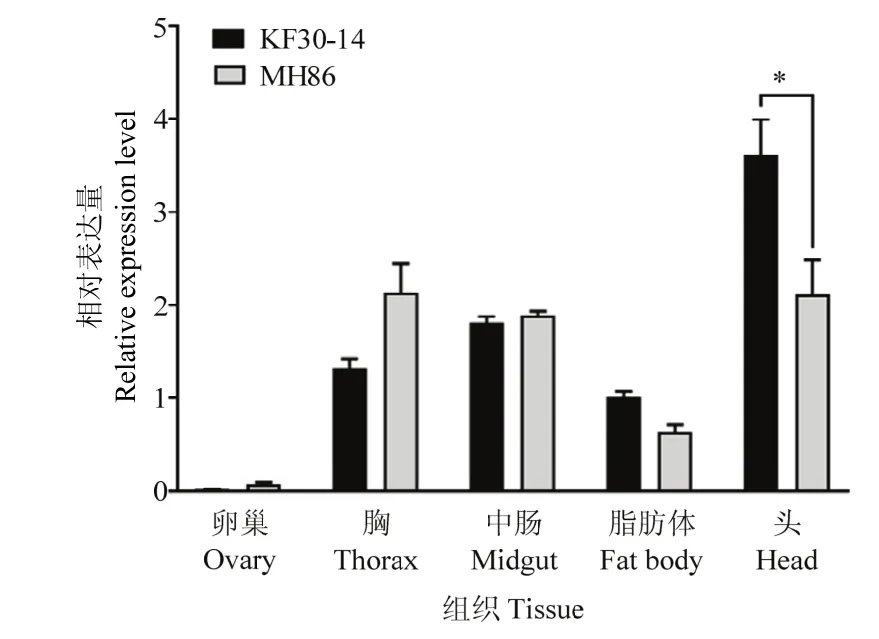
图5 NlHRP在褐飞虱不同组织中的表达量Fig.5 NlHRP expression in different tissues of N.lugens
3 讨论
褐飞虱缺乏合成组氨酸等 10种必需氨基酸的能力,而褐飞虱的唯一食物来源——水稻韧皮部汁液,并不能提供这些必需的营养物质[16]。研究人员对类酵母共生体(YLS)基因组序列分析发现,YLS保留了与宿主高度互补的氨基酸合成途径,其基因组中存在必需氨基酸生物合成所需的所有基因,因此,YLS作为额外的供应源,可以提供褐飞虱无法合成的必需氨基酸[17]。本研究中,我们获得了褐飞虱的一种编码富组氨酸蛋白的基因序列——NlHRP。KF30-14种群中羽化72 h的褐飞虱雌虫与MH86种群中羽化72 h的褐飞虱雌虫相比,NlHRP表达量显著升高,而在两个种群中的褐飞虱在羽化24 h与96 h时NlHRP表达量未达到显著差异水平,而褐飞虱体内的组氨酸是由YLS独立合成[18-20],Tang等[21]提出,细菌内共生体也决定了稻飞虱种群对水稻品种的偏好。由于它们在稻飞虱营养中的作用,类酵母共生体(YLS)也被认为在稻飞虱(褐飞虱)对抗性水稻品种的毒力适应中发挥作用[22-24],有研究人员发现在对褐飞虱具有抗性的转基因水稻上取食的褐飞虱YLS密度高于常规水稻,且研究结果表明YLS密度会随着水稻品种的抗性提高而升高[25]。故推测NlHRP蛋白的合成受YLS密度影响,而KF30-14种群的褐飞虱在羽化72 h时,NlHRP表达量显著升高现象可能与YLS有关。
检测NlHRP在羽化72 h的褐飞虱雌虫各组织中的表达量,结果显示KF30-14种群中的褐飞虱头部中NlHRP表达量显著高于MH86种群,且NlHRP在头部与胸部均出现高表达现象,说明NlHRP可能与褐飞虱神经和降低肌肉氧化损伤有关[26]。
上述这些结果表明NlHRP与转cry30Fa1水稻的抗虫性有关,而NlHRP蛋白的功能及NlHRP表达量的变化与转cry30Fa1水稻的抗褐飞虱机理间的关系还需要进一步的研究。
