生姜姜辣素的分离及对HepG2细胞胰岛素抵抗的预防作用
2022-11-11陈梦霞孟凡强周立邦陈晓宇赵洪源陆兆新
陈梦霞,汪 妮,孟凡强,周立邦,陈晓宇,赵洪源,唐 超,陆兆新
(南京农业大学食品科学技术学院,江苏南京 210095)
胰岛素抵抗(Insulin Resistance,IR)是指由于各种原因机体代偿性地分泌过多的胰岛素而导致葡萄糖的利用率下降[1]。肝脏是胰岛素作用的重要靶器官之一,对控制葡萄糖稳态起着至关重要的作用[2]。当其产生胰岛素抵抗时,组织中活性氧浓度大量增加,造成氧化应激反应[3]。此外,胰岛素介导的PI3K/AKT途径与肝脏糖代谢和胰岛素抵抗密切相关[4]。胰岛素抵抗是造成糖尿病的主要原因之一[5]。糖尿病的危害不仅在于高血糖,它还会造成各种糖尿病并发症[4],并对器官和组织造成进一步的损害[2,4,5]。目前,治疗糖尿病的方式主要以口服阿卡波糖等药物及注射胰岛素为主,降糖药的使用容易产生低血糖的副作用且会加重肝脏的负担。因此,寻找一种相对安全的成分来预防胰岛素抵抗的发生是十分有意义的。
生姜(Zingiber officinaleRoscoe)是一种姜科植物,其原产地为东南亚。生姜根茎在中国、韩国和澳大利亚等许多国家被广泛用作香料和调味品[6]。生姜中的主要成分为姜精油[7]、姜辣素[8]以及二苯基庚烷类化合物[9]。姜辣素是生姜中不易挥发的物质,主要包括6-姜酚、8-姜酚、10-姜酚等[10]。关于姜辣素与胰岛素抵抗的报道主要集中在生姜粗提物、6-姜酚和6-姜烯酚,生姜粗提物中姜辣素含量不明。Fajrin等[11]发现生姜96%乙醇提取物能缓解糖尿病性神经病变。有研究显示[12],6-姜酚可通过氧化应激途径缓解由亚砷酸钠引起的胰岛素抵抗,其与高脂饮食引发的胰岛素抵抗发病机制不同。6-姜烯酚能够通过抗炎和抗氧化作用改善糖尿病肾病[13]。但目前,有关生姜姜辣素是否具有预防肝脏中胰岛素抵抗的作用还未知。
本研究通过提取富含6-姜酚、8-姜酚和10-姜酚的生姜姜辣素来研究其预防HepG2细胞产生胰岛素抵抗的作用,为生姜姜辣素作为一种潜在的预防糖尿病的药物提供实验依据。
1 材料与方法
1.1 材料与仪器
生姜 山东潍坊农贸市场;无水乙醇、乙酸乙酯、石油醚 分析纯,国药集团化学试剂有限公司;香草醛、6-姜酚、8-姜酚、10-姜酚、DPPH、ABTS、牛胰岛素 上海源叶生物科技有限公司;HepG2细胞 中国科学院(上海)细胞库;DMEM高糖培养基
美国Gibco公司;葡萄糖氧化酶法测定试剂盒 北京普利莱基因技术有限公司;BCA试剂盒 碧云天生物技术有限公司;SOD、CAT试剂盒 南京建成生物工程研究所;TransZol up plus RNA Kit试剂盒北京全式金生物技术有限公司;HiScript® II Q RT SuperMix for qPCR试剂盒 南京诺唯赞生物科技股份有限公司。
RE 52-99旋转蒸发仪 上海亚荣生化仪器厂;WFJ7200可见分光光度计 上海尤尼柯仪器有限公司;DIONEX3000高效液相色谱仪 美国DIONEX公司;InfiniteF200多功能酶标仪 瑞士Tecan公司;Series water jacke细胞培养箱 美国Thermo公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 生姜姜辣素的提取工艺 生姜预处理:将生姜洗净切片晒干,用高速粉碎机磨成粉,过80目筛后,放于4 ℃冰箱密封备用。取密封保存的生姜粉0.5 g,按料液比1:30 g/mL加入80%的乙醇,在40 ℃下水浴振荡提取1 h后,离心取上清,测定上清液的体积及姜辣素含量,计算姜辣素得率。
1.2.2 单因素实验 改变料液比1:10、1:20、1:30、1:40、1:50 g/mL、提取时间20、40、60、80、100 min、乙醇体积分数60%、70%、80%、90%、100%和提取温度 20、30、40、50、60 ℃来研究各提取因素对姜辣素得率的影响。
1.2.3 正交试验 根据以上单因素实验结果,选取四个因素的四个水平,依据L16(45)正交试验表,设计正交试验,根据正交试验结果,确定最佳提取条件,正交试验因素水平表见表1。

表1 姜辣素提取正交试验因素水平设计Table 1 Factors and levels of orthogonal test of gingerols'extraction
1.2.4 姜辣素含量测定 姜辣素含量测定:参考张明昶等[14]的测定方法,因香草醛与姜辣素结构相似,选用香草醛做标准品。香草醛标准曲线的制作:以90%乙醇作溶剂,配制浓度为 2.0、4.0、6.0、8.0、10.0、12.0 μg·mL-1的香草醛标准溶液,测定采用分光光度计,以90%乙醇调零,波长为280 nm,求得回归方程为:y=0.0709x-0.0053,R2=0.9999。样品溶液同样以90%乙醇溶液调零,在280 nm处测定吸光度,代入方程即可计算出相应浓度,并测定提取液的体积,可得姜辣素得率。
姜辣素得率(%)=cV/m
式中:c为代入方程得到的相应浓度;V为提取液体积;m为生姜粉质量。
1.2.5 姜辣素的检测条件 姜辣素中主要成分6-姜酚、8-姜酚、10-姜酚的高效液相色谱条件[15]:色谱柱Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相乙腈:甲醇:水(40:5:55);检测波长为280 nm;体积流量为 1.0 mL·min-1;柱温 25 ℃;进样量 10 μL。
1.2.6 姜辣素的萃取 将按照正交试验提取的姜辣素提取液用旋转蒸发仪除去乙醇后,加入同等体积的乙酸乙酯[16]萃取3次,合并萃取液旋蒸除去乙酸乙酯,得到深棕色粘稠状物质。将上述粘稠状物质溶于70%乙醇,再加入同等体积的石油醚,置于-20 ℃12 h后取出,得下层深色油状物,减压浓缩后制得姜辣素成品[17]。准确称取10 mg的姜辣素,加入10 mL的蒸馏水涡旋混匀后,制成1 mg/mL的姜辣素溶液,再根据需要稀释至所需浓度,进行后续实验。
1.2.7 姜辣素抗氧化活性研究
1.2.7.1 DPPH自由基清除率的测定 参照An等[18]的方法略作修改。取200 μL 0.4 mmol·L-1的DPPH溶液,加入 20 μL 不同浓度(0.4、0.6、0.8 mg·mL-1)的姜辣素样品溶液,空白组为无水乙醇+DPPH,本底对照为姜辣素溶液+无水乙醇,室温避光反应30 min,517 nm测定吸光度。采用VC作阳性对照,VC浓度为 0.1、0.2、0.4 mg·mL-1,姜辣素对 DPPH 自由基的清除率的计算公式为:
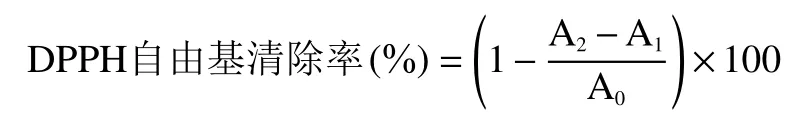
式中:A0为空白对照;A1为本底对照;A2为姜辣素与DPPH。
1.2.7.2 ABTS+自由基清除率的测定 参照An等[19]的方法略作修改。将7 mmol·L-1的 ABTS+和2.45 mmol·L-1的过硫酸钾按 1:1(v/v)的比例混合,静置12 h后用PBS稀释,使混合液在734 nm处的吸光度为 0.70±0.02,取 200 μL 稀释后的溶液,加入 20 μL不同浓度(0.08、0.1、0.2 mg·mL-1)的姜辣素溶液,空白组为无水乙醇+ABTS,本底对照为姜辣素溶液+PBS,反应10 min,734 nm测定吸光值,按照下式计算清除率。同时采用VC作为对照,VC溶液浓度为 0.04、0.06、0.08 mg·mL-1,姜辣素对 ABTS+自由基的清除率的计算公式为:
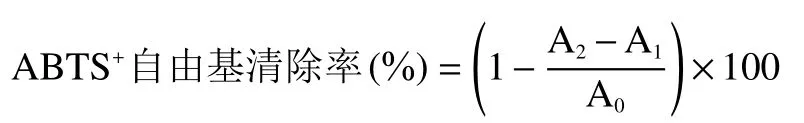
式中:A0为空白对照;A1为本底对照;A2为姜辣素与ABTS。
1.2.8 HepG2细胞胰岛素抵抗模型的建立 取对数期的HepG2细胞消化计数,使细胞浓度为6×104个/mL,96孔板每孔加100 μL,边加边轻轻摇动细胞,防止细胞沉淀。实验分组为:空白组(不加细胞)、正常组(不加胰岛素)、模型组(加入 0.2、1、5、25 μg·mL-1浓度的胰岛素)。待孔底细胞生长至80%左右时,吸弃旧培养液,用PBS清洗1~2遍,按照以上分组加入含不同浓度胰岛素的培养基,边缘孔加入无菌PBS,分别培养24、48和72 h[20]。
培养结束后,利用葡萄糖氧化酶法测定试剂盒[21]测定葡萄糖含量,计算葡萄糖消耗量(空白孔含量25 mmol·L-1-测定孔含量)。另外,培养过程中细胞数目发生了变化,需测定细胞活力计算实际葡萄糖消耗量(实际葡萄糖消耗量=测定葡萄糖消耗量/细胞活力)。
细胞活力的测定采用MTT法[22]。具体的方法为:吸弃上清液,每孔加入 100 μL 0.5 mg·mL-1的 MTT溶液,继续培养4 h。4 h后小心(避免吸走甲瓒结晶)将上清吸弃,加入150 μL DMSO,待结晶物充分溶解,于490 nm测定吸光值,计算细胞活力:细胞活力(%)=(实验组-空白组)/(正常组-空白组)。
1.2.9 不同浓度姜辣素对HepG2细胞活力的影响细胞接种方法同1.2.8,实验分组为:空白组(不加细胞)、正常组(不加胰岛素)、姜辣素组(6.25、12.5、25、50、100 μg·mL-1)。待孔底细胞生长至 80% 左右时,吸弃旧培养液,用PBS清洗1~2遍,按分组加入含不同浓度姜辣素的培养基,培养48 h,采用MTT法检测细胞的活力大小,MTT方法同1.2.8。
1.2.10 姜辣素对IR-HepG2细胞糖代谢的影响 取对数期的HepG2细胞,消化计数,使细胞浓度为2×106个/mL,6孔板每孔加2.5 mL,边加边轻轻摇动细胞,防止细胞沉淀。实验分组为:空白组(不加细胞)、正常组(不加胰岛素)、模型组(只加胰岛素,浓度为25 μg/mL)、姜辣素高、中、低剂量组(胰岛素与姜辣素混合添加,胰岛素浓度为25 μg·mL-1,姜辣素浓度分别为 25、50、100 μg·mL-1)。待细胞长至 80%左右,吸弃旧液,按各组要求加入含不同物质的培养基,培养48 h。培养48 h后取出细胞,按照1.2.8方法计算葡萄糖消耗量和细胞活力。
1.2.11 姜辣素对IR-HepG2细胞SOD和CAT活力的影响 使用1.2.10方法处理细胞,48 h后取出六孔板,去上清,用PBS清洗,加入细胞裂解液(含1 mmol/L 的 PMSF)150 μL,裂解 5 min,整个操作在冰上进行。充分裂解后,收集裂解后的细胞8000 r·min-1离心5 min,取上清,根据试剂盒,测定蛋白浓度、SOD和CAT活力。
1.2.12 qRT-PCR检测基因表达 使用1.2.10方法处理细胞,48 h后取出六孔板,去上清,用PBS清洗,使用TransZol up plus RNA Kit试剂盒提取细胞的RNA,然后使用HiScript® II Q RT SuperMix for qPCR试剂盒进行反转录,得到cDNA模板。qRT-PCR反应体系为:cDNA 2 μL,上下游引物(表2)各 1 μL,ddH2O 6 μL,SYBR green Mix 10 μL。RT-PCR 反应条件为:预变性 95 ℃ 5 min,循环扩增 95 ℃ 15 s,60 ℃1 min(40 个循环),熔炼曲线 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。

表2 qRT-PCR引物表Table 2 Primer sequence of qRT-PCR
1.3 数据处理
实验数据以平均值±标准差表示,使用SPSS 26进行统计学分析。组间比较采用LSD法,P<0.05表示具有显著性差异。作图软件采用Origin 2019。
2 结果与分析
2.1 姜辣素提取单因素实验
如图1所示,姜辣素得率随料液比的增加而增加。这是因为提取溶剂少,不能将姜辣素全部提取出来。当料液比为1:40 g/mL时姜辣素得率最大,之后反而下降,这可能是因为乙醇增多,提取出来的脂类物质也随之增多。因此选取1:40 g/mL的料液比进行下一步试验。提取时间增加,姜辣素得率也随之增加,之后略有减小。姜辣素得率在提取时间为60 min时达到最大。这表明姜辣素在60 min时已基本提取完全。乙醇体积分数为60%时姜辣素得率最大,之后逐渐减小,这可能是因为姜辣素只有在合适的极性下才能被提取出来。因姜辣素为脂溶性物质,所以选取乙醇体积分数60%为最佳提取浓度。项敏[23]采用超声辅助乙醇提取姜辣素,最佳乙醇体积分数也为60%。随提取温度升高,姜辣素得率也升高,但升高的趋势逐渐趋于平缓,这可能是因为姜辣素的提取量已接近饱和。姜辣素在高温下不稳定[24],选择最佳提取温度为50 ℃。张鲁明等[25]采用乙醇提取姜辣素,单因素实验结果为最佳乙醇浓度80%,最佳固液比为1:10(g/mL),最佳提取时间为3 h。这与本文得到的结果略有差异,可能与生姜的品种、采摘季节、实验条件不同等有关。
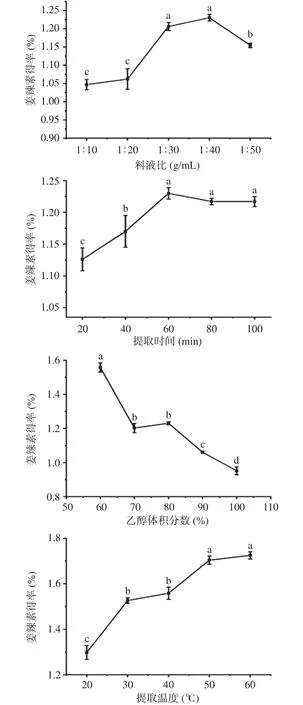
图1 料液比、提取时间、乙醇体积分数和提取温度对姜辣素得率的影响Fig.1 Effects of solid-liquid ratio, extraction time, ethanol volume fraction and extraction temperature on the yield of gingerols
2.2 姜辣素提取的正交试验结果
根据2.1实验结果,采用L16(45)正交试验表对姜辣素提取工艺进行优化。如表3所示,因素的极差越大,表明该因素的影响越大。因此,影响姜辣素得率的因素首先为乙醇体积分数,其次为料液比、提取温度和提取时间。由表4可知,乙醇体积分数对姜辣素得率影响最大(P<0.01),其次为料液比(P<0.05)。根据均值可得,姜辣素提取最佳条件为:料液比1:50 g/mL、提取时间80 min、乙醇体积分数60%、提取温度50 ℃。因最优组合不在表3中,需进行验证试验,验证试验的结果为姜辣素的得率为1.885%±0.071%,大于表中的得率。

表3 生姜姜辣素得率的正交试验结果及极差分析Table 3 Orthogonal test results and range analysis of gingerols' yield
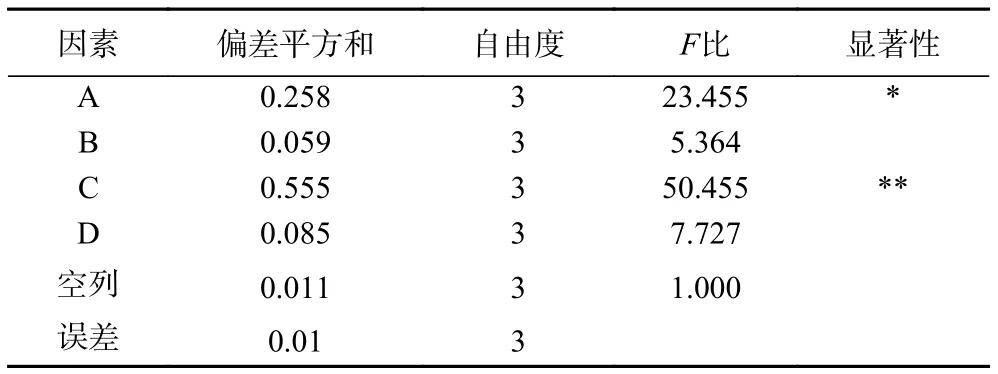
表4 姜辣素提取方差分析表Table 4 Analysis of variance of gingerols' extraction
姜辣素是生姜中呈辛辣味活性物质的总称,易溶于有机溶剂,难溶于水,且在高温下不稳定。姜辣素在生姜中含量较少,李田叶等[26]研究发现干姜中6-姜酚、8-姜酚、10-姜酚和6-姜烯酚的含量分别为4.164、1.343、2.488 和 1.008 mg·g-1,其总和不到 1%。An等[19]研究发现新鲜生姜中6-姜酚、8-姜酚和10-姜酚的含量分别为 5.91、2.52和 2.62 mg·g-1,干燥后6-姜酚的含量大幅减少。这与本文得到的姜辣素含量相差不大,可能与生姜的种类及干燥方式有关[19]。
2.3 姜辣素分离纯化实验结果
根据高效液相色谱分析可得姜辣素中主要成分6-姜酚、8-姜酚和 10-姜酚的回归方程为:6-姜酚:y=0.0672x+0.324,R2=0.9993;8-姜 酚 :y=0.1084x-0.3075,R2=0.9999;10-姜酚:y=0.0765x-0.3123,R2=0.9994,以此作为定量依据。由表5可知,生姜姜辣素中的主要成分为6-姜酚,其次为10-姜酚和8-姜酚。通过乙醇提取得到的姜辣素粗提物中姜辣素含量不高,6-,8-,10-姜酚含量之和仅为4.98%。对姜辣素粗提物继续进行乙酸乙酯萃取和石油醚脱脂后,姜辣素含量大幅提高,6-,8-,10-姜酚的含量分别达到了 25.16%±0.78%、3.07%±0.10%和 6.32%±0.22%,其姜辣素含量大于34.55%。这表明姜辣素在乙酸乙酯和石油醚中具有更好的溶解性能。因此,选用乙醇提取、乙酸乙酯萃取和石油醚脱脂后的姜辣素进行后续研究。

表5 不同溶剂分离姜辣素中6-,8-,10-姜酚的含量变化(%)Table 5 Changes of 6-, 8-, 10- gingerol content during separation and purification of gingerols (%)
2.4 姜辣素抗氧化活性
姜辣素和维生素C对DPPH和ABTS+自由基的清除率如图2所示。生姜姜辣素和维生素C对DPPH和ABTS+自由基清除率随浓度增加而增大,且在一定范围内具有线性关系。选取其清除率在50%附近的三个点,通过线性拟合曲线,得到姜辣素对DPPH 的EC50为0.501 mg·mL-1,VC为0.200 mg·mL-1,小于姜辣素的EC50。姜辣素对 ABTS+的EC50为0.111 mg·mL-1,VC为 0.057 mg·mL-1,也小于姜辣素的EC50。生姜姜辣素对DPPH和ABTS+自由基的EC50虽稍大于维生素C对DPPH和ABTS+的EC50,但仍表明姜辣素具有良好的抗氧化活性。Shukla等[27]也发现Sungro-sung生姜对DPPH自由基的清除率为91.25%,Thingpui生姜对ABTS+自由基的清除率为88.25%。刘步云等[28]发现永康黄姜和云南黄姜均具有极强的DPPH和ABTS+自由基清除能力。这可能都与生姜中的姜辣素有关。氧化应激可能导致多种疾病[29],包括胰岛素抵抗。抗氧化剂可以减轻氧化应激反应,达到预防相关疾病的目的。这表明姜辣素可作为一种良好的抗氧化剂预防由氧化应激产生的胰岛素抵抗。
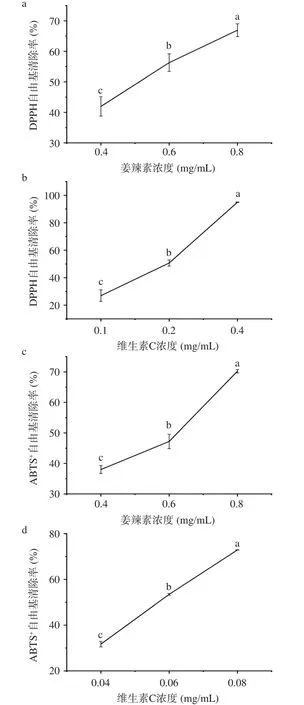
图2 姜辣素对DPPH和ABTS+自由基的清除率Fig.2 Elimination rate of gingerols against DPPH and ABTS+free radical
2.5 HepG2细胞胰岛素抵抗模型的建立
肝脏是人体代谢中心,是胰岛素抵抗的重要靶器官。肝脏对维持机体内葡萄糖动态平衡起着至关重要的作用,其通过调节糖原储存、糖原分解和糖异生之间的平衡来维持血糖的正常水平[30]。因此,干扰肝脏葡萄糖合成与代谢最终可能导致代谢综合征、非酒精性脂肪肝病及胰岛素抵抗等病理改变。当肝脏产生胰岛素抵抗时,肝脏组织对胰岛素的敏感性下降,葡萄糖的摄取及利用率也随之下降[31]。
如表6所示,在24 h内,各实验组均不能使细胞葡萄糖消耗量降低。高胰岛素处理48 h后,与对照组相比,各处理组细胞的葡萄糖消耗量均显著下降(P<0.05),且随着胰岛素浓度增大,其消耗量也逐渐减少。当用25 μg·mL-1胰岛素处理细胞48 h后,其葡萄糖消耗量降为 1.271±0.188 mmol·L-1,表明其达到了胰岛素抵抗最大化。胰岛素处理72 h后,25 μg·mL-1胰岛素浓度能显著降低 HepG2细胞葡萄糖消耗量(P<0.05),其余处理组均无明显变化。姜保平[32]研究发现 1×10-9、5×10-9、1×10-8、5×10-8、1×10-7、5×10-7mol·L-1胰岛素作用 HepG2 细胞 48 h均能显著降低细胞葡萄糖消耗量。Jiang等[21]采用100 nmol·L-1胰岛素作用HepG2细胞12、24和36 h后,均能显著降低葡萄糖消耗量,这表明HepG2细胞经高胰岛素诱导,能够产生胰岛素抵抗。因此,本实验采用25 μg·mL-1胰岛素处理HepG2细胞48 h来构建细胞胰岛素抵抗模型。

表6 不同浓度和时间的胰岛素对HepG2细胞葡萄糖消耗量的影响Table 6 Effects of different concentrations and time of insulin on glucose consumption in HepG2 cells
2.6 不同浓度姜辣素对HepG2细胞活性的影响
图3为不同浓度姜辣素对HepG2细胞活力的影响。从图3中可以看出,与空白组相比,6.25、12.5、25、50 和 100 μg·mL-1的姜辣素作用 HepG2 细胞48 h后,均对细胞活力无显著性影响(P>0.05),表明在此浓度范围内的姜辣素对HepG2细胞无毒性作用,细胞能正常生长。因此,本研究选择25、50和100 μg·mL-1的姜辣素作为低、中、高剂量组进行后续研究。

图3 不同浓度姜辣素对HepG2细胞活性的影响Fig.3 Effects of different concentrations of gingerols on HepG2 cell activity
2.7 不同浓度姜辣素对HepG2细胞葡萄糖消耗量的影响
图4为姜辣素对IR-HepG2细胞葡萄糖消耗的影响。如图4所示,模型组细胞葡萄糖消耗量明显下降,影响显著(P<0.05),表明其发生了胰岛素抵抗,当用 25、50 和 100 μg·mL-1的姜辣素作用细胞后,能显著改善细胞对葡萄糖的利用率(P<0.05),且姜辣素的浓度越高,其葡萄糖的消耗量也越高。这表明,姜辣素具有预防细胞产生胰岛素抵抗的作用,能够显著提高肝脏细胞对胰岛素的敏感性,且高剂量组100 μg·mL-1的姜辣素效果最好。
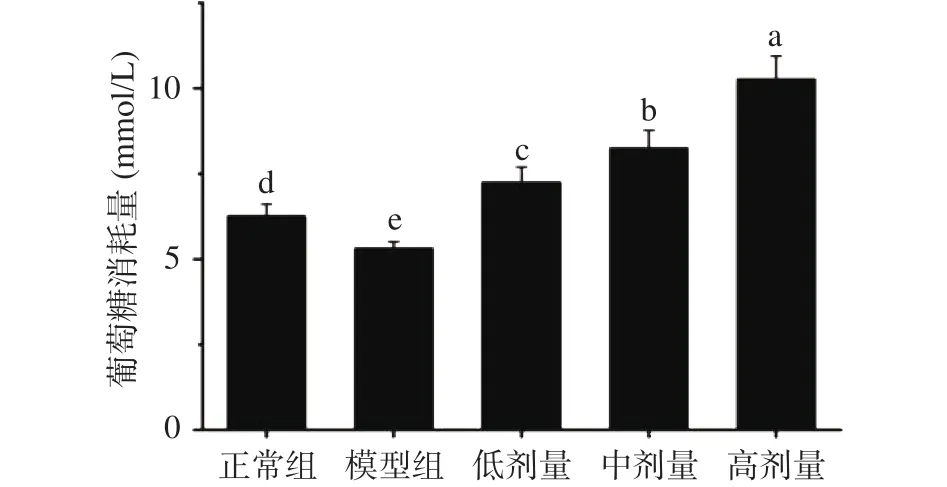
图4 不同浓度姜辣素对细胞葡萄糖消耗量的影响Fig.4 Effects of different concentrations of gingerols on glucose consumption in cells
2.8 姜辣素对IR-HepG2细胞氧化指标的影响
机体产生过量的自由基容易引起氧化损伤,进而导致胰岛素抵抗,造成糖尿病及其并发症。SOD和CAT在清除氧自由基和抑制氧化损伤中起重要作用。SOD又称为Cu-Zn酶,它能催化超氧阴离子歧化生成氧和过氧化氢,维持体内氧化和抗氧化平衡[4]。CAT能够增强机体对羟基自由基及超氧阴离子的抑制能力,缓解由氧化应激所造成的机体或功能性损伤[33]。
如图5所示,与正常组相比,模型组HepG2细胞在高胰岛素环境下,其超氧化物歧化酶SOD活力显著下降(P<0.05)。与模型组相比,姜辣素低、中、高剂量组均能显著提高IR-HepG2细胞的SOD活力,并呈现剂量依赖性(P<0.05)。与正常组相比,模型组细胞的过氧化氢酶(CAT)活力有所下降,低、中剂量姜辣素对胰岛素抵抗细胞的CAT活力无显著影响(P>0.05),而高剂量 100 μg·mL-1的姜辣素能显著提高细胞的CAT活力(P<0.05)。模型组中SOD和CAT活力降低可能是因为过量葡萄糖的自动氧化产生了大量的羟基自由基和过氧化氢,而这些自由基能使抗氧化酶的活性部分失活[34]。这表明生姜姜辣素预防HepG2细胞产生胰岛素抵抗可能是通过提高SOD和CAT活力,进而抑制氧化应激反应。
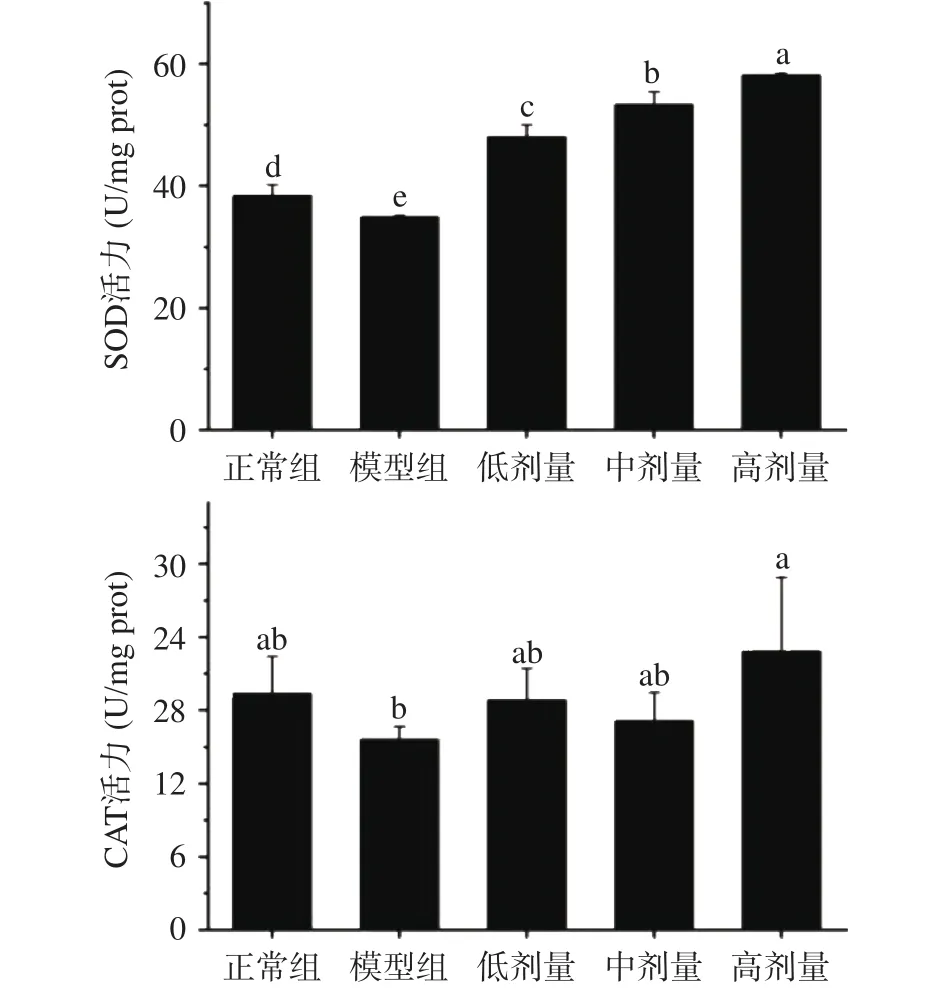
图5 姜辣素对IR-HepG2细胞SOD和CAT活力的影响Fig.5 Effects of gingerols on SOD and CAT activities of IRHepG2 cells
2.9 姜辣素对IR-HepG2细胞糖类代谢的调节作用
目前,已有很多研究证明PI3K/AKT途径是介导胰岛素合成代谢的关键信号通路[35]。当胰岛素与胰岛素受体结合时,胰岛素受体底物IRS-2能够激活PI3K,形成PIP3。IRS-2蛋白通过与胰岛素受体上的磷酸酪氨酸残基结合,将PI3K途径与胰岛素受体连接起来。PIP3通过3-磷酸肌醇依赖的蛋白激酶1激活AKT[36]。AKT是必需的下游信号激酶。肝脏中AKT的缺失会导致严重的胰岛素抵抗、葡萄糖耐受和肝脏脂质合成减少。AKT能够通过抑制GSK-3β促进糖原合成。除此之外,AKT也能通过抑制FoxO1,进而抑制PEPCK的表达来抑制糖异生途径[37]。Chen等[38]研究发现,牛磺酸能够通过上调PI3K和AKT的表达来缓解HepG2细胞的胰岛素抵抗,增加葡萄糖消耗量和改善氧化应激反应。Mazibuko-Mbeje等[39]采用罗汉果提取物处理胰岛素抵抗大鼠,罗汉果提取物能显著增强PI3K和AKT的表达,从而改善肝脏胰岛素抵抗。
由图6可知,与正常组相比,模型组中PI3K、IRS-2和AKT的mRNA表达量均有显著下降(P<0.05),模型组中GSK-3β、FoxO1和PEPCK的 mRNA表达量均有显著上升(P<0.05)。表明高浓度胰岛素在一定程度上抑制了PI3K/AKT途径,降低了肝脏利用葡萄糖的效率。与模型组相比,姜辣素剂量组均能显著上调PI3K、IRS-2和AKT这些基因的表达量(P<0.05),并能显著下调GSK-3β、FoxOI和PEPCK的表达量(P<0.05)。这结果表示姜辣素与胰岛素抵抗细胞共培养能有效激活PI3K/AKT途径,促进PI3K、IRS-2和AKT的表达,进而抑制GSK-3β、FoxO1和PEPCK的表达,促进糖原合成,抑制糖异生,提高葡萄糖的利用率。
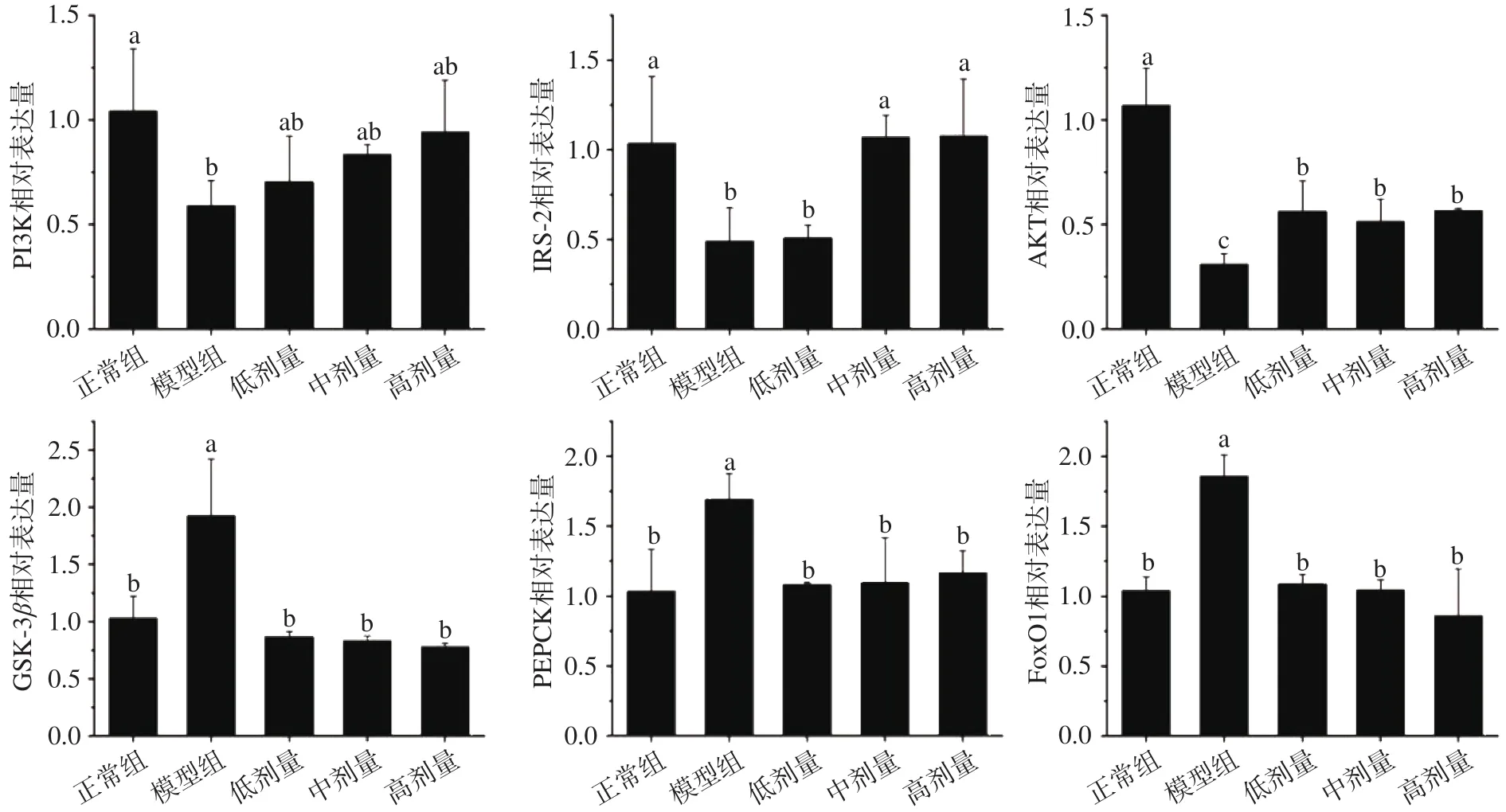
图6 姜辣素对PI3K/AKT胰岛素抵抗途径主要基因表达量的影响Fig.6 Effects of gingerols on expression levels of major genes of PI3K/AKT insulin resistance pathway
3 结论
本文通过正交试验确定了生姜姜辣素乙醇提取的最佳条件,其条件为料液比1:50 g/mL、提取时间80 min、乙醇体积分数60%、提取温度50 ℃。在此条件下,姜辣素的得率为1.885%±0.071%。对乙醇提取的姜辣素进行乙酸乙酯萃取和石油醚脱脂后,姜辣素中主要成分6-姜酚、8-姜酚和10-姜酚的含量大幅提高,其总和达到了34.55%,是乙醇提取的6.94倍。将纯化后的姜辣素作用于DPPH和ABTS+自由基,其 EC50分别为 0.501和 0.111 mg·mL-1,虽稍大于维生素C对DPPH和ABTS+自由基的清除率,但仍表明姜辣素具有良好的抗氧化活性。纯化后的姜辣素与高浓度胰岛素共同作用于HepG2细胞时,姜辣素各剂量组能明显提高胰岛素抵抗细胞的葡萄糖消耗量、SOD和CAT活力,并呈现剂量依赖关系。通过检测HepG2细胞内与葡萄糖代谢相关的基因表达量可知,姜辣素能够通过激活PI3K/AKT途径来提高葡萄糖的利用率,预防高浓度胰岛素引起的HepG2细胞胰岛素抵抗。这些研究为生姜姜辣素的制备及探究姜辣素对胰岛素抵抗的缓解作用提供实验依据,同时也对天然活性产物的药理作用研究具有重要意义。
