免疫检查点抑制剂在肝细胞癌新辅助治疗中的研究进展*
2022-10-29陈顺赵宝银贾栋仵朝晖王盼谢小青综述于晓辉审校
陈顺 赵宝银 贾栋 仵朝晖 王盼 谢小青 综述 于晓辉 审校
原发性肝癌是世界范围内最常见的恶性肿瘤之一,据最新的流行病学调查显示,2020 年全球新发病例数超过90 万,死亡人数超过83 万,其已成为全球第六大最常诊断的癌症,也是癌症相关死亡率的第三大原因[1]。我国是原发性肝癌的高发国家,每年新发人数约占全球总发病例数的一半,其中肝细胞癌(hepatocellular carcinoma,HCC)是主要组织学亚型,约占所有肝脏原发恶性肿瘤的90%[2-3]。目前,针对HCC最有效的根治性治疗手段仍然是手术切除及肝移植,但是大多数患者由于肝功能储备不足、门静脉或肝静脉大体侵犯或肝外侵犯,仅有不足1/3 患者在初次诊断时符合根治性治疗的条件[4]。然而,即使在复发风险较小的病例中,通过根治性治疗后5 年内患者复发的风险仍然超过80%[5]。此外,20%的患者在等待移植过程中因肿瘤进展而丧失手术机会,目前还没有既定的方法来降低复发和死亡的风险[6-7]。因此,扩大根治性治疗患者的比例,降低手术复发风险,延缓移植过程中肿瘤进展是一个亟需突破的领域,而旨在降低HCC 分期以实现局部治疗并最大程度降低复发风险的新辅助策略成为当前研究者关注的焦点。
在过去十余年里,中晚期HCC 的治疗发生了巨大的变革,随着以细胞程序性死亡受体1 及其配体(programmed cell death protein 1/programmed cell death-ligand 1,PD-1/PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的引入,使HCC 的治疗取得较大的突破,并逐渐成为标准化和系统化治疗的选择[8]。在CHECKMATE 040 的I/Ⅱ期临床试验以及KEYNOTE-224 的研究中,ICIs的治疗能明显延长晚期HCC 患者总生存期(overall survival,OS),改善患者预后,且进一步IMbrave 150Ⅰ/Ⅱ期临床试验结果也论证了这一点,以上使得基于ICIs 的联合疗法于2020 年5 月首次被美国食品药品监督管理局(FDA)批准作为一线药物用于晚期HCC 的治疗[9-10]。鉴于ICIs 在抗肿瘤治疗中的突出疗效,研究人员进一步探索了免疫治疗在新辅助治疗环境中的应用。
1 ICIs 应用于HCC 新辅助治疗的原理
免疫检查点蛋白细胞毒性T 淋巴细胞相关抗原4(cytotoxict lymphocyte associated antigen-4,CTLA4)和PD-1 是表达于细胞毒性T 细胞表面的受体,其配体分别为CD80/CD86 和PD-L1。肿瘤细胞高表达的免疫检查点分子将共抑制信号传递至T 细胞或其他免疫活性细胞,并且在肿瘤组织中形成免疫抑制微环境,进而赋予肿瘤细胞逃逸免疫杀伤的作用[11]。而ICIs 则是通过阻断肿瘤细胞高表达的免疫检查点分子与T 细胞上配体结合,导致T 细胞增殖并浸润到肿瘤组织中,诱发细胞毒性T 细胞反应,从而恢复机体的抗肿瘤免疫特性,是目前最有前途的抗肿瘤治疗方法之一[12]。
实际上,在HCC 早期就已经形成免疫抑制的微环境。Bozward 等[13]对比分析了早期HCC 患者中肿瘤组织和正常组中T 细胞数量,结果显示调节性T 细胞比例上升,效应T 细胞/调节性T 细胞比值下降,自然杀伤细胞和树突状细胞减少。Shimada 等[14]发现在HCC 肿瘤微环境中,CD4+T 细胞增加时,患者复发时间延长,同时还发现记忆性CD8+T 细胞与低复发风险相关,而效应CD8+T 与高复发风险相关,且随着肿瘤组织中PD-L1 表达的增加,复发时间更短。此外,研究发现,由于HCC 独特的免疫耐受微环境,可通过多种机制逃避免疫监视,包括抗原递呈受损、T 细胞反应失调和免疫抑制性髓系细胞的上调,这可能是导致机体抗肿瘤反应受损的原因之一[15]。Zhang 等[16]研究发现,在PD-1、PD-L1 和PD-L2 水平较低的HCC患者中,无病生存率和总生存率较高。这些为免疫治疗应用于早期HCC 提供了理论依据,同时也进一步证实HCC 的免疫治疗相较于其他肿瘤治疗可能更有优势。
2 ICIs 应用于HCC 新辅助治疗的进展
2.1 新辅助免疫治疗在可切除的HCC 中的研究进展
随着对高危人群筛查率的提高,越来越多患者被确定为可以进行手术切除的早期HCC 患者。然而,这类患者术后大多数会复发,使得临床治疗效果不尽人意。迄今为止,围手术期治疗初步展现出对患者的生存益处,值得去进一步探究。2019 年Kaseb 等[17]首次报道在可切除HCC 中新辅助免疫治疗的Ⅱ期临床试验结果,在20 例可评估的患者中给予纳武利尤单抗(3 mg/kg,2 周1 次)或纳武利尤单抗联合伊匹木单抗(1 mg/kg,每3 周1 次)作为术前治疗。经过6 周治疗后,20 例患者中17 例按计划完成手术治疗,5 例(25%)患者观察到病理完全缓解(pathologic complete response,pCR),6 例患者有轻度免疫相关不良反应(immune-related adverse events,irAE),未发现4 级或更高的级别的irAE。这项报告表明新辅助免疫治疗对可切除的HCC 治疗是安全的,未出现严重的irAE致患者停止治疗,也未延误手术切除时间。Pinato等[18]调查了纳武利尤单抗联合伊匹木单抗用于可切除HCC 术前新辅助治疗的Ib 期临床试验,在HCC患者中,联合用药是安全的、可接受的,3~4 级irAE比例为27.1%,停药率为2%,该研究结果支持纳武利尤单抗和伊匹木单抗联合应用在可切除的HCC 新辅助治疗。近期Marron 等[19]报道了目前最大规模的PD-1 抑制剂西米普利单抗单药在可切除的HCC 患者(Ib 期、Ⅱ期和Ⅲb 期)新辅助治疗中的研究,其主要终点为病理检查显示明显肿瘤坏死(切除肿瘤的>70%坏死),次要终点包括手术延迟、有总体反应的患者比例、CD8 的变化、T 细胞密度和irAE。在纳入的21 例患者中,20 例成功切除,有4 例(20%)出现明显的肿瘤坏死,3 例(15%)部分缓解(影像学检查肿瘤大小减少≥30%),仅1 例患者由于在最初计划的切除日之前出现免疫疗法相关的肺炎而延误2 周,有7 例患者出现3 级irAE,未观察到4 级或5 级irAE,该队列中观察到的结果支持更大规模试验的设计,以确定最佳治疗时间,并最终确定术前PD-1 阻断对HCC 患者的临床益处。除此之外,临床前模型和早期临床试验结果表明,研究者可通过评估新辅助免疫治疗中肿瘤的反应,探索个体患者对于ICIs 治疗的反应和抵抗,还可以比较治疗前后的肿瘤样本的免疫微环境以及连续检测免疫相关生物标志物来评估治疗效果[20]。目前正在进行的大规模临床试验将进一步评估免疫治疗在可切除的HCC 新辅助治疗中的作用(表1)。
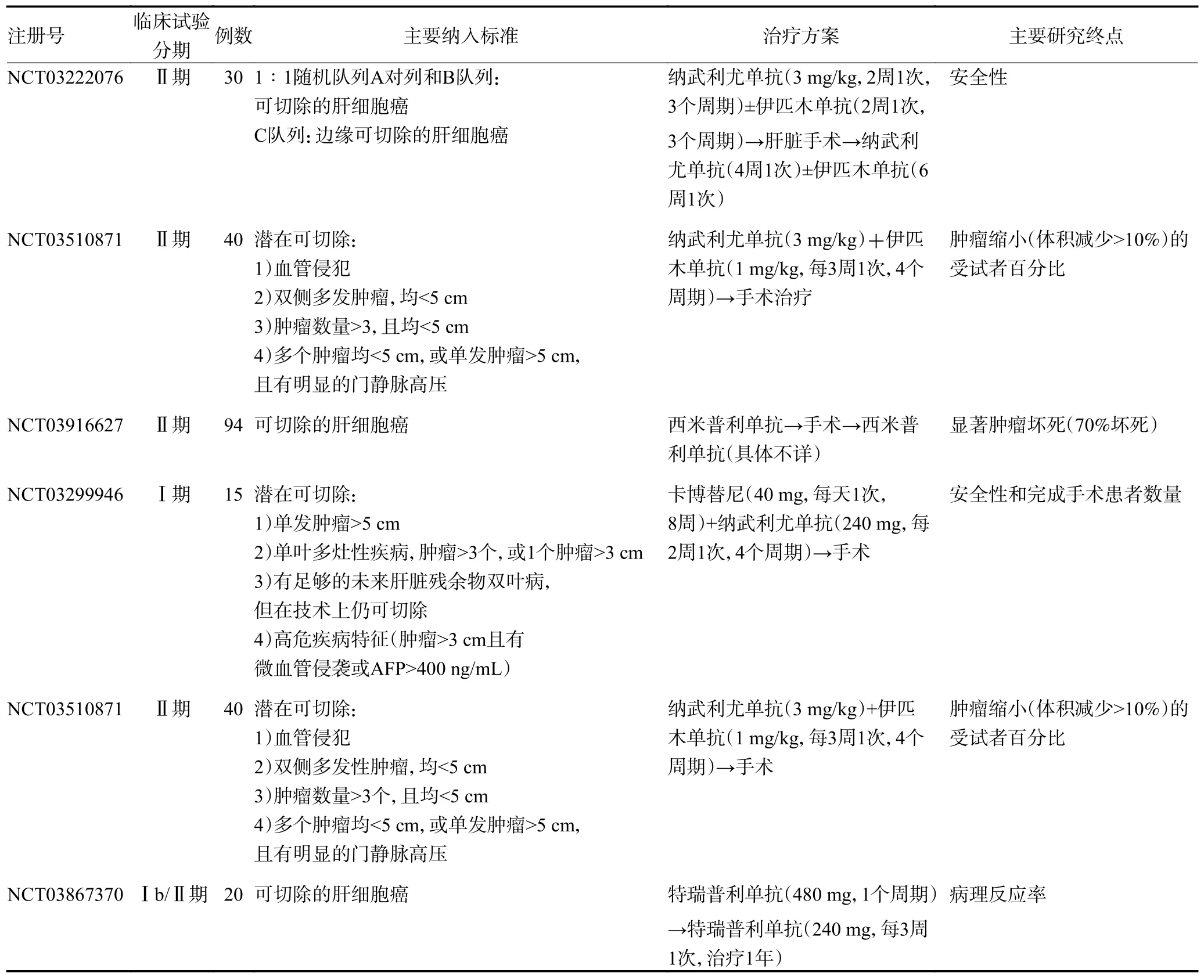
表1 进行中的可切除的HCC 新辅助免疫治疗Ⅰ、Ⅱ期临床试验
2.2 新辅助免疫治疗在肝移植中降期或桥接治疗的研究进展
降期治疗是指原本不具备肝移植(liver transplantation,LT)指征或超米兰标准患者,在经过新的辅助治疗后,符合米兰标准或符合LT 指征[21]。而桥接治疗则通过新辅助治疗防止患者因在等待LT 期间因疾病进展失去LT 机会,最大程度确保患者满足LT的标准[22]。
器官移植后诱导的免疫耐受是移植物存活的关键因素,PD-1 和CTLA-4 信号通路均与移植后的免疫耐受密切相关。然而,在临床上由于对器官移植排斥反应的的担忧,ICIs 很少被纳入接受实体器官移植患者的治疗[23]。此外,由于缺乏与安全性相关的大规模临床试验,并未推荐在恶性肿瘤移植受者中使用ICIs抗肿瘤治疗[24]。研究发现,新辅助免疫治疗能对不符合移植标准的患者进行降期治疗,增加患者移植机会。
Schwacha-Eipper 等[25]首次报道新辅助免疫治疗在LT 中的应用,1 名代偿性肝硬化合并HCC 肝内多发转移灶的患者,用纳武利尤单抗进行36 个周期的治疗后,患者肝内多发转移灶数目减少,成功降级到米兰标准之内,顺利进行LT 手术。Lizaola-Mayo 等[26]报道了1 例代偿性肝硬合并HCC 的老年男性患者,其存在高AFP(AFP>3 000 ng/mL)被认为是LT 的禁忌证,在采用伊匹木单抗联合纳武利尤单抗治疗6 个月后,患者AFP 明显下降(AFP 为19.6 ng/mL)且无新发的HCC 病灶,最终成功接受LT 手术。此外,另一研究表明,肿瘤降期至米兰标准的患者与初次诊断符合米兰标准的患者的预后相似[27]。Mazzaferro 等[28]一项Ⅱ、Ⅲ期临床随机对照研究也充分证明了这一策略对HCC 患者的临床益处。Qiao 等[29]评估了帕博丽珠单抗(200 mg,每2 周1 次)联合乐伐替尼在超出米兰标准的LT 患者中新辅助治疗的安全性和有效性,7 例患者在LT 前接受帕博丽珠单抗或卡瑞丽珠单抗(200 mg,每2 周1 次)联合乐伐替尼(8~12 mg,每6周1 次)新辅助治疗,最终结果显示治疗的客观有效率和疾病控制率分别为71%和85%,且没有irAE 的发生。以上数据均表明新辅助免疫治疗的单一或联合酪氨酸酶抑制剂(tyrosine kinase inhibitor,TKI)在移植受者中具有良好的疗效和较低的irAE。然而,基于安全性的考虑,目前还没有相关的指南和共识推荐在HCC 肝移植受者中使用ICIs。
当前的小型队列研究和个案报道以及初步试验证实了在严密监测下,新辅助免疫治疗在LT 患者中的应用是可行和有效的。但是,如何进一步平衡器官移植失败的风险和ICIs 抗肿瘤疗效,未来还需要更深入研究,明确导致排斥反应的危险因素,降低患者的死亡风险,提高抗肿瘤疗效,一些正在进行的临床试验可能会回答这些问题(表2)。
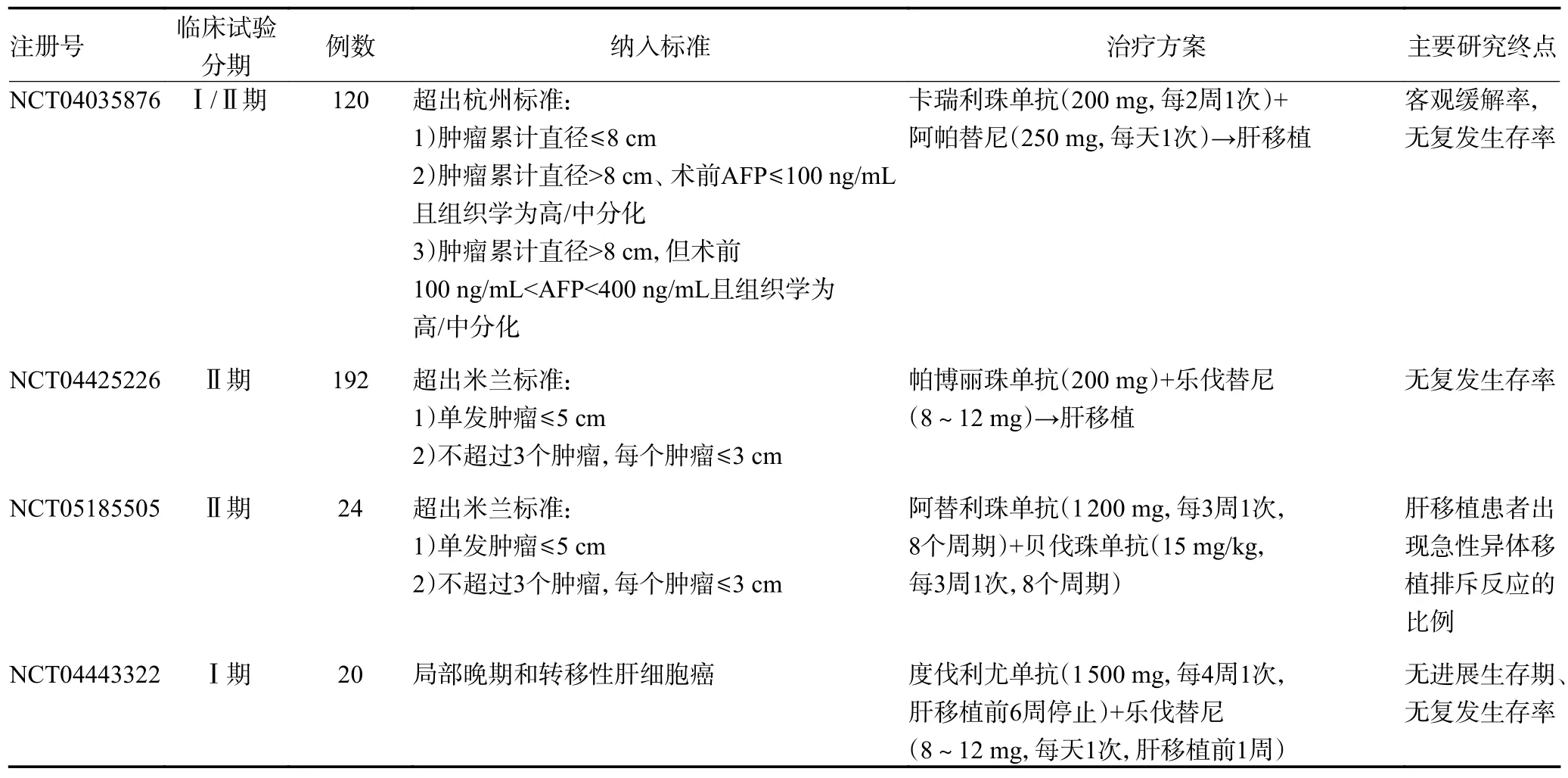
表2 进行中的肝移植应用新辅助免疫治疗的临床试验
3 新辅助免疫治疗在HCC 治疗中的安全性研究
将免疫疗法扩大到HCC 患者的早期治疗中,一些随之而来的临床问题需要前瞻性解决,其中治疗的安全性是一个不可忽视的关键问题。首先,鉴于大多数HCC 患者多伴有肝硬化及乙肝病毒感染,而ICIs的治疗是否会诱发患者乙肝病毒再活化,需要进一步去探究。Burns 等[30]回顾性药物警戒分析的数据表明,乙肝病毒重新激活与帕博丽珠单抗之间存在关联性,但与其他PD-1/PD-L1 抑制剂没有关联。其次,在HCC肝移植患者中,鉴于ICIs 增强免疫系统可能导致宿主对移植器官免疫排斥增加,而器官移植后的免疫抑制治疗又可能会阻碍ICIs 的疗效,因此,LT 前新辅助免疫治疗有效性和安全性的问题仍然没有答案。近期有研究报道11 例患者在LT 后接受ICIs 治疗的情况,其中4 例(36%)出现急性排斥反应,伴有或不伴有移植物丢失,5 例(45%)进行免疫治疗后HCC 复发[31]。最后,已被招募到ICIs 临床试验的大多数患者可能接受了局部区域疗法(射频消融或肝动脉化疗栓塞),目前尚缺乏早期、未接受治疗的HCC 患者对ICIs 的敏感性和安全性的数据。
4 新辅助免疫治疗当前面临的挑战
尽管新辅助免疫治疗已在多种癌症中展现巨大的潜力,但是目前仍然存在着诸多挑战亟待解决。
首先是如何筛选出合适的治疗人群,提高有效应答率,寻找有助于识别治疗反应的生物标志物和耐药机制。其次,鉴于不同类型的HCC 复发(早期和晚期)与独特的临床、分子和免疫特征相关,如何识别肿瘤复发的高危患者也是一个关键性问题[32-33]。此外,尽管目前进行了多种治疗模式(单一或联合模式)的尝试,新辅助免疫治疗尚无标准统一的方法,未来的研究应该进一步确定多种模式治疗的最佳组成,以产生最大的治疗效果。
5 结语与展望
鉴于HCC 高复发、高转移的特性,因此针对其治疗仍然是一种极具挑战性的任务。当前早期HCC 可采取切除和原位肝移植等治疗方案,但均不能实现对疾病的长期控制,因此采取额外的治疗措施必不可少。新辅助免疫治疗通过早期消除可见的转移或微转移病灶,降低原发灶的肿瘤负荷,减少循环肿瘤细胞的数量,对肿瘤降期或桥接治疗,预防和减少HCC 术后复发,在HCC 治疗中具有极大的优势。此外,除了探索单一或联合ICIs 在新辅助免疫治疗中的应用外,靶向TKI 药物与ICIs 的“强强联手”也是近期研究的热点。有研究显示,靶向药物联合ICIs 方案的对肿瘤的平均客观反应率明显高于单药ICIs 的治疗。但是,值得注意的是由于ICIs 和靶向药物的不良事件发生具体机制及种类不完全一致,相比单一或两种ICIs 联合后的irAE 发生率更高、程度更严重[34]。目前正在进行的高质量的临床试验可能有助于将基于ICIs 的新辅助治疗纳入HCC 的多学科管理,使更多HCC 患者获益,期待更多研究结果的问世。
