荷伯生氏斜盖伞的同核体菌株制备
2022-10-18王玉宸王欣玉龙1袁志林1
王玉宸,王欣玉,彭 龙1, *,袁志林1, *
(1.林木遗传育种国家重点实验室,中国林业科学研究院,北京 100091;2.南京林业大学林学院,江苏 南京 210037;3.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400)
荷伯生氏斜盖伞(Clitopilushobsonii),在分类地位上属于担子菌门(Basidiomycota)伞菌目(Agaricales)粉褶蕈科(Entolomataceae)。基于最新的形态学特征和分子系统发育分析,斜盖伞属真菌可分3组:Clitopilus组、Scyphoides组和Crispi组,荷伯生氏斜盖伞属于Scyphoides组[1]。此真菌首次分离自栎类林腐木[2],是典型的土壤腐生型真菌。本研究组在2017—2018年开展了多种国外栎类树种菌根组织真菌的资源调查、分离培养工作,发现荷伯生氏斜盖伞从大果栎(Quercusmacrocrpa)、舒玛栎(Q.shumardii)、牛栎(Q.michauxii)、琴叶栎(Q.lyrata)、白栎(Q.fabri)等栎类树种的新鲜菌根组织中均能分离获得,进一步研究发现,该菌不仅能与多种苗木建立共生关系,形成类似“微菌核”的侵染结构,还能促进苗木根系发育和养分吸收[3]。上述研究基础证明荷伯生氏斜盖伞不仅可从腐生型(saprotrophy)转变为兼性活体营养型(facultative biotrophy),还可对植物产生一定的促生抗逆作用。因此,笔者认为破译该菌的遗传信息(如制备荷伯生氏斜盖伞的同核菌株)不仅能为丰富“外生菌根真菌起源自腐生真菌”这一观点[4-5]提供更多基因组进化证据,还能为今后开展菌-植互惠机制研究奠定良好基础。然而,伞菌目真菌大多为异核双核体菌株,其基因组存在不同的杂合度,这将给基因组组装带来一定挑战。“单核化”作为“简化”复杂基因组的一种重要策略,也是有效开展异核体真菌全基因组测序分析的重要环节[6-8]。在遗传上,把通过原生质体再生法得到的单核体和同核体分别称为单核原生质体(protoplasted monokaryon)和同核原生质体(protoplasted homokaryon),此现象则被称为原生质体单核化(monotikaryotization by protoplasting)[9]。菌体单核化的方法主要包括机械分割法、化学处理法、孢子分离法和原生质体再生法[10-12]。机械分割法是基于体细胞的物理分离策略,获得的单核体遗传信息能完整、准确地保留,但该方法对细胞破坏程度大,分割后细胞存活率降低,而且分割产物不均匀,单核体得率低;化学处理法是基于体细胞的化学分离策略,尽管单核体遗传信息也能完整、准确地保留,但对于处理条件要求严格,具有细胞毒性;孢子分离法是基于生殖细胞的分离策略,相比于其他制备单核体的方法,孢子分离法仅适用于产孢菌株的单核体制备,且单核孢子的形成需要经过遗传重组、减数分裂,因而遗传信息无法完整保留;原生质体再生法曾用于分离同宗结合菌双孢蘑菇的同核体[13-15],由原生质体再生形成的细胞核未经过减数分裂及遗传重组,亲本细胞核内的遗传信息能被更完整、准确地保留[13]。目前通过原生质体再生获得的单核、同核体菌株已被广泛应用于食用真菌杂交育种中亲本材料的制备[9, 16-17]。
本研究利用原生质体再生法制备荷伯生氏斜伞同核体菌株,即仅具有1种基因型的纯合体,并通过形态学特征、细胞核染色及基因杂合位点检测加以论述,为该菌种的科学制备提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
荷伯生氏斜盖伞(C.hobsonii)(菌株编号:QYL-10),分离自琴叶栎(Q.lyrata)1年生实生幼苗菌根组织[18],保藏于中国林业科学研究院亚热带林业研究所。
1.1.2 主要试剂与仪器设备
真菌DNA快速提取试剂盒购自北京艾德莱生物科技有限公司(货号:DN4102);PCR引物合成、扩增产物测序均由擎科生物科技有限公司完成;PCR反应试剂盒购自擎科生物科技有限公司;裂解酶(lysing enzyme)购自Sigma公司,用0.5 mol/L蔗糖溶液配置成质量浓度为10 μg/μL的工作液后经0.22 μm微孔滤膜过滤除菌备用;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)购自Sigma公司,用无菌水配置成质量浓度为50 μg/mL的母液,使用前用磷酸盐(PBS)缓冲液(pH 6.8,浓度0.1 mol/L)稀释成质量浓度为5 μg/mL的工作液[19];其他化学试剂均为国产分析纯。全温振荡器(THZ-C-1,苏州培英实验设备有限公司);PCR扩增仪(MyCycler,Bio-Rad公司);电泳仪(DYY-6C,北京六一仪器厂);立式压力蒸汽灭菌器(LDZF-50KB-Ⅱ,上海申安医疗机器厂);光学显微镜(Axio Scope A1,德国卡尔蔡司公司);激光共聚焦荧光显微镜(LSM700,德国卡尔蔡司公司)。
1.1.3 培养基与缓冲液
马铃薯固体(PDA)培养基;麦芽浸汁固体(MYG)培养基:10 g葡萄糖,4 g酵母提取物,10 g麦芽提取物,15 g琼脂,0.5 mol蔗糖溶液,pH 7.0。麦芽浸汁液体(YMG)培养基:10 g葡萄糖,4 g酵母提取物,10 g麦芽提取物,0.5 mol蔗糖溶液,pH 7.0。渗透压稳定剂:0.5 mol/L蔗糖溶液。
1.2 同核体菌株制备
1.2.1 原生质体制备
QYL-10菌丝细胞原生质体制备参考鲍大鹏等[20]的方法并做改动。将10个直径6 mm的菌饼接种至YMG液体培养基,25 ℃、120 r/min培养7 d。然后收集菌丝体,用无菌水洗涤3次,再用渗透压稳定剂洗涤1次。将洗净后的菌丝体置于10 g/L裂解酶溶液中(1 g菌丝/5 mL酶液),在37 ℃下80 r/min震荡酶解3 h。酶解后将菌丝酶解液经无纺布过滤,得到较纯的原生质体悬液,将所得滤液在4 ℃下3 000 r/min离心10 min,弃上清,得到原生质体沉淀;用渗透压稳定剂冲洗2次,弃上清,保留沉淀;用1 mL渗透压稳定剂重悬沉淀。将得到的原生质体重悬液置于光学显微镜下进行镜检,用血球计数板计数并记录拍照原生质体形态。经血球计数板计数,原生质体数量浓度为1×106个/mL。
1.2.2 原生质体再生
将100 μL原生质体重悬液均匀涂布于MYG培养基上,25 ℃避光培养,每天观察菌落生长情况。挑取10 d后长出的再生菌落转接至PDA固体培养基上,25 ℃避光培养。
1.3 同核体菌株鉴定
1.3.1 再生菌株与出发双核体菌落的培养
菌落形态特征观察:用直径为6 mm的打孔器沿再生菌株、出发菌株的菌落边缘打孔,分别接种于PDA培养基上,置于25 ℃培养箱,避光培养12 d后观察菌落表型特征(包括菌落正反面及边缘特征、色素、生长速度等),拍照记录。
1.3.2 再生菌株与出发菌株生长速度测定
用直径为6 mm的打孔器沿再生菌株、出发菌株的菌落边缘打孔,分别接种于PDA培养基中心,25 ℃避光培养,以十字交叉法测量菌落直径,计算菌丝的生长速度(mm/d),设置3次生物学重复。
1.3.3 菌丝形态观察
用直径为6 mm的打孔器沿再生菌株、出发菌株的菌落边缘打孔,分别接种于PDA培养基上,25 ℃避光培养3 d,在菌落边缘斜插入无菌盖玻片,待菌丝延伸至盖玻片2/3处时,在无菌条件下取出盖玻片,制片后置于光学显微镜下镜检,在100倍显微镜下观察此两类菌株的菌丝是否存在锁状联合结构。
1.3.4 细胞核荧光染色及观察
参考胡晓棣等[21]的方法并稍做改动。用镊子取出经插片培养附着有菌丝体的盖玻片,擦去背面菌丝,向菌丝附着位置均匀滴加50 μL DAPI染色工作液(5 μg/mL),在4 ℃、避光条件下对再生菌株、出发菌株的菌丝进行细胞核荧光染色,10~15 min后用PBS缓冲液(pH 6.8,0.1 mol/L)洗涤3次。将盖玻片附着菌丝一面朝下置于滴有PBS缓冲液的载玻片上,置于激光共聚焦荧光显微镜63倍镜下观察,激发光与发射光波长分别为340、488 nm。
1.3.5 基因杂合位点鉴定
用真菌基因组DNA快速提取试剂盒分别提取荷伯生氏斜盖伞再生菌株、出发菌株的基因组DNA。采用fRPB2-5F/fRPB2-7cR和983F/2218R两对引物分别扩增rpb2[22]和tef[23]基因片段。
PCR扩增体系(50 μL)如下:25 μL 1-5TM2×High-Fidelity Master Mix,1 μL模板DNA(10~20 ng/μL),上下游引物各2 μL(10 μmol/L),20 μL ddH2O。rpb2基因PCR扩增程序:95 ℃预变性4 min;95 ℃变性40 s,55 ℃退火50 s,72 ℃延伸1.5 min,扩增35个循环;72 ℃延伸10 min。
采用降落PCR(touch-down PCR)方法扩增tef基因,降落PCR程序:94 ℃预变性4 min;94 ℃变性40 s,66 ℃退火50 s,每循环下降1 ℃,72 ℃延伸1.5 min,扩增10个循环;94 ℃变性40 s,56 ℃退火50 s,72 ℃延伸1.5 min,扩增30个循环;最后72 ℃延伸10 min。PCR扩增产物经质量分数1.5%琼脂糖凝胶电泳检测后送擎科生物科技有限公司进行双向测序。采用SeqMan 5.0软件分别对再生菌株、出发菌株的rpb2基因和tef基因进行核酸序列比对和双峰杂合位点鉴定。
1.4 数据分析
使用SPSS 20.0进行数据统计分析,采用t检验进行差异显著性分析(α=0.05);菌株生长速度以平均值±标准偏差表示。
2 结果与分析
2.1 原生质体再生菌落的获得
通过酶解实验,成功获得了荷伯生氏斜盖伞原生质体(图1A),在MYG再生培养基上培养10 d后可观察到两种形态的菌落(图1B)。其中一类表现为菌丝快速萌发(大多出现在再生培养前期),将其转接至PDA培养基上培养,此类菌丝萌发后呈稀薄毛毡状,形成的菌落边缘呈放射状,与出发菌落形态差异较小(图1C);另一类表现为菌丝缓慢萌发(大多出现在再生培养后期),转接至PDA培养基上培养,此类菌丝萌发后呈浓密绒毛状,形成的菌落有裂褶状纹路且边缘明显,与出发菌落形态差异大(图1D),推测后者可能是潜在的同核菌株。随机挑取50个菌落转接至PDA固体培养基用于后续鉴定分析。

A.原生质体形态protoplast morphology;B. MYG培养基表面再生菌落regenerated colonies on MYG medium;C. PDA培养基表面再生菌落类型Ⅰ regenerated colony type Ⅰ on PDA medium;D. PDA培养基表面再生菌落类型Ⅱ regenerated colony type Ⅱ on PDA medium。图1 荷伯生氏斜盖伞再生菌落形态Fig.1 Protoplast and colony morphology of regenerated strains of C. hobsonii
2.2 再生菌株与出发菌株的菌落性状和形态特征
以其中1株与出发菌株具有明显差异的再生菌株为材料,比较再生菌株与出发菌株间的菌落形态特征和生长速度差异。培养结果表明再生菌株萌发后呈辐射状生长,菌丝呈浓密绒毛状,菌落表面形成裂褶,有深黄色色素分泌(图2A)(表1)。出发菌株萌发后则呈现轮纹状生长,菌丝呈稀薄毛毡状,菌落表面形成轮状纹,有淡黄色色素分泌(图2B)。
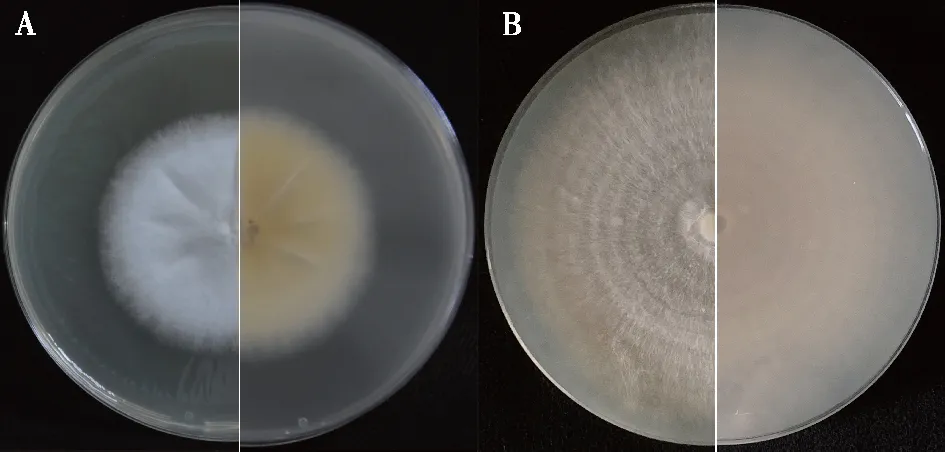
A. PDA培养基表面再生菌株菌落(左正、右反)colony of regenerated strains (front and reverse) on PDA culture medium;B. PDA培养基表面出发菌株菌落(左正、右反)colony of original strains (front and reverse) on PDA culture medium。图2 荷伯生氏斜盖伞再生菌株与出发菌株菌落及其形态特征Fig.2 Colony and morphological characteristics of regenerated and original strains of C. hobsonii
此外,出发菌株的菌丝生长速度为(5.72±0.07) mm/d,再生菌株的菌丝生长速度为(2.82±0.03) mm/d,显著低于出发菌株的菌丝生长速度(P<0.01)(表1)。
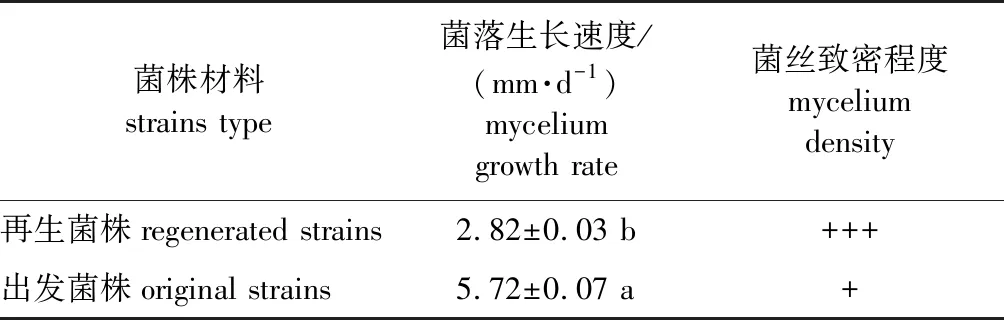
表1 再生菌株与出发菌株的生长特征比较
2.3 再生菌株与出发菌株的菌丝显微形态特征
锁状联合是担子菌特有的菌丝结构特征[24-25]。然而,不同于多数担子菌,在荷伯生氏斜盖伞出发菌株与再生菌株的菌丝中均未见锁状联合结构(图3)。
此外,DAPI细胞核染色结果表明:再生菌株的幼龄菌丝中可观察到少量具有单个细胞核的菌丝细胞,相邻细胞核之间被隔膜分开(图4B),但大部分菌丝细胞仍呈现双细胞核且与单核细胞共存(图4A);出发菌株的菌丝细胞中均含有两个细胞核(图4C)。

A.再生菌株regenerated strains;B. 出发菌株original strains。图3 荷伯生氏斜盖伞再生菌株与出发菌株的菌丝形态Fig.3 Hyphal morphologies of the regenerated andoriginal strains of C.hobsonii

A. 再生菌株单、双核共存现象binuclear and mononuclear coexist phenomenon of regenerated strains;B. 再生菌株单核现象mononuclear phenomenon of regenerated strains;C. 出发菌株original strains;箭头表示隔膜the arrows indicate septa in mycelia。图4 荷伯生氏斜盖伞再生菌株与出发菌株细胞核荧光显微观察结果Fig.4 Fluorescence microscopy of the mycelia of the regenerated and original strains of C. hobsonii
2.4 再生菌株与出发菌株rpb2和tef基因序列特征
由于异核体菌株基因型杂合,因此在基因Sanger测序峰图中通常出现套峰现象,即存在杂合位点;而同核菌株基因型理论上应该是纯合的[26],不存在杂合位点。通过对rpb2和tef基因片段扩增产物进行电泳检测(图5A),对扩增序列峰图进行比对发现,出发菌株存在多个杂合位点,尤其是rpb2基因(图5B1、5B3);而再生菌株均未发现杂合位点(图5B2、5B4)。
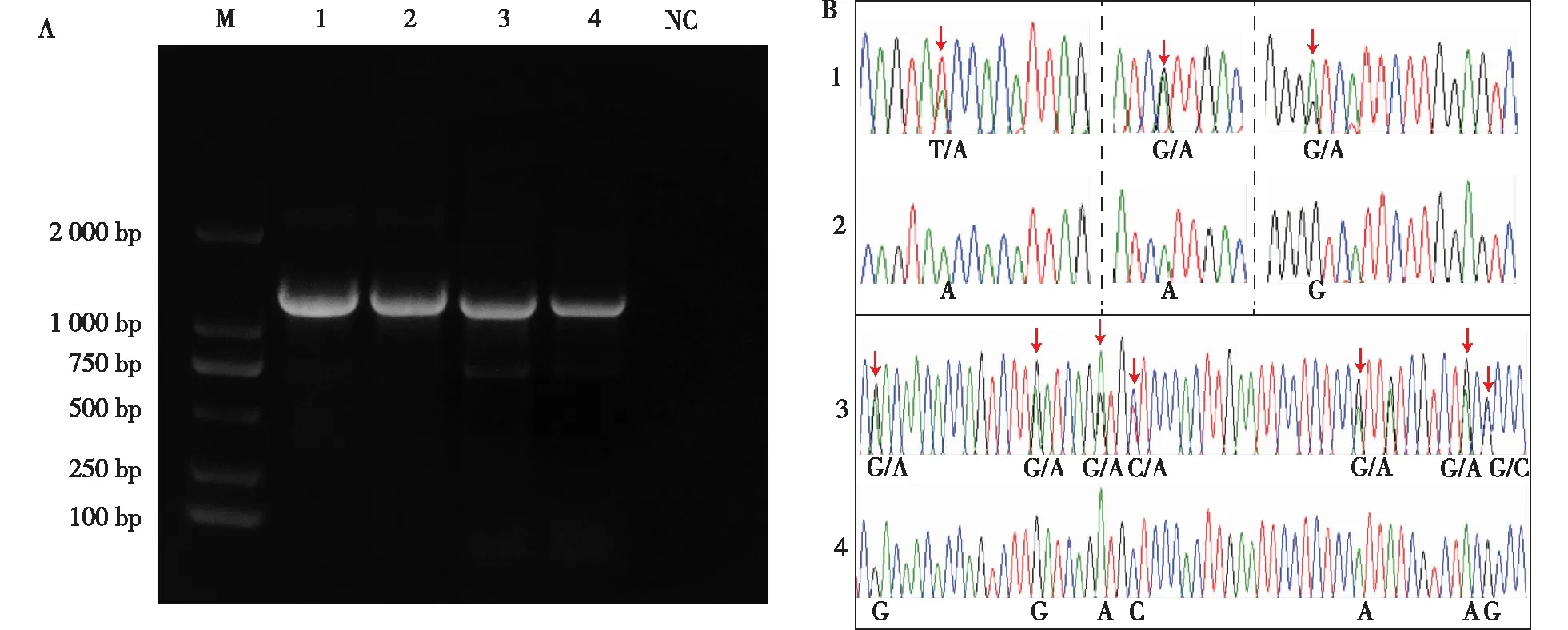
A.荷伯生氏斜盖伞出发菌株与再生菌株tef、rpb2基因PCR扩增产物电泳检测图PCR amplification results of tef and rpb2 from original and regenerated strains of C. hobsonii:M. DL2000 PCR Marker;B. 出发菌株与再生菌株tef、 rpb2基因部分序列峰图partial tef and rpb2 sequence chromatograms from original and regenerated strains。 1. 出发菌株tef 基因tef from original strains;2. 再生菌株tef基因 tef from regenerated strains;3. 出发菌株rpb2基因 rpb2 from original strains;4. 再生菌株rpb2基因 rpb2 from regenerated strains;NC. 阴性对照negative control. 红色箭头指示套峰the red arrows indicate bimodal site.图5 荷伯生氏斜盖伞出发菌株与再生菌株rpb2、tef基因PCR检测及部分序列峰图Fig.5 PCR identification and partial rpb2 and tef sequence chromatograms from original and regenerated strains of C. hobsonii
3 讨 论
本研究采用原生质体制备和再生筛选技术获得了荷伯生氏斜盖伞同核体菌株。比较再生菌株与出发菌株,发现再生菌株与出发菌株形态差异显著,且菌丝生长速度显著低于出发菌株,这与单倍型纯合体菌株的性状较吻合[10, 25]。本研究显示荷伯生氏斜盖伞菌丝不具备双核担子菌常见的锁状联合结构,这与Singer[27]认为斜盖伞属真菌缺乏锁状联合结构这一结论一致,因此不能直接通过有无锁状联合结构判断细胞核分布情况[24-25]。与常见研究不同,本研究通过原生质体再生获得了双核同核体菌株(偶见单核),而非典型的单核体菌株[16-17]。为了确认双细胞核的异同情况,笔者再次对两个基因片段进行PCR扩增和Sanger测序,结果证实再生菌株依然不存在杂合位点。此外,同类研究结果显示无论是单、双或多核的同核菌株,其菌落形态特征与异核菌株均有显著差异[28],与本研究结果相符。综上,该结果进一步证实本研究获得的再生菌株无论是双核菌丝细胞还是单核菌丝细胞,都属于单倍型纯合体。
本研究所采用的原生质体再生法常用以获得异宗结合型食用菌单核育种材料,在次级同宗结合型菌中则获得同核体[9, 16-17],如双孢蘑菇经原生质体再生获得的同核菌株[13-15]。因此,认为本研究中荷伯生氏斜盖伞单核原生质体经再生萌发后以次级同宗结合型真菌生活方式进行营养生长,即初生单核菌丝不需经过异体菌丝融合就能发生双核化,从而完成生活史,故尽管在初期偶见单核现象,其他时期菌丝细胞仍呈现双核状态,类似现象在香菇同核菌株中也有见报道,即在香菇菌丝的不同营养发育阶段,可观察到无核、单核、双核与多核等多种表型[29]。
此外,本研究仅获得了其中1种基因型的荷伯生氏斜盖伞菌株,不符合分离比例为1∶1的预期值,这与灵芝(Ganodermalucidum)、香菇(Lentinulaedodes)等担子菌单核菌株分离结果类似[17, 24]。一般认为可能有以下原因,首先两种交配型的等位基因或基因表达差异导致的菌丝生长速度差异过大[30-33],其次也可能是在原生质体游离过程中线粒体在每个单核中的分配不均,影响菌丝生长速度[34-35]。由于其中一种基因型的同核菌丝的再生速度较快,推测其为再生前期出现的菌落,因此容易获得;而另一种基因型的同核菌丝再生能力较弱,推测其为再生后期出现的菌落,但由于异核菌丝生长极为迅速,导致再生后期出现的菌落被异核菌丝覆盖,增加了筛选难度[28]。本研究共挑选了约200株再生菌株,最终得到4株同核体菌株。今后工作可以围绕裂解酶、酶浓度、酶解时间、菌龄及培养条件等因素进行优化,以期更高效地获得2种单倍型同核菌株。
