阪崎克罗诺杆菌耐干燥相关基因ESA-00281的功能研究
2022-10-18吕文张正阳李萍杜欣军王硕
吕文,张正阳,李萍,杜欣军*,王硕
(1.食品营养与安全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457;2.天津市食品科学与健康重点实验室,南开大学医学院,天津 300071)
阪崎克罗诺杆菌是一种兼性厌氧革兰氏阴性细菌,不产生孢子,但具有形成生物膜的能力,可以在人类和动物的肠道中存活[1]。该菌是一种食源性病原体,通常检出于婴儿配方奶粉中。该致病菌可以引起婴幼儿菌血症、脑膜炎和坏死性小肠结肠炎等,死亡率较高[2]。此外,该细菌还会感染免疫功能减弱的老年人和成年人,并导致肺炎、结膜炎、伤口感染和尿路感染等[3-4]。这种细菌对各类极端外部环境表现出不同的抵抗力,例如耐酸性[5]、耐药性[6]和耐压力性[7]。与其他细菌相比,耐干燥性是阪崎克罗诺杆菌最突出的环境抵抗能力,这也是导致食品污染、引起婴幼儿感染的重要原因[8-10]。因此,研究阪崎克罗诺杆菌的耐干燥机制具有重要意义,能够为防治该病原菌提供重要的参考。
目前的研究表明,生物膜、海藻糖和细胞中的相容物质有利于阪崎克罗诺杆菌对抗周围环境中的不利因素。生物膜不仅有助于细菌附着在一些物体的表面,还能增强微生物在各种环境中的抵抗力[11]。生物膜的产生可以增强细菌在低水活度环境中的生存能力,同时增强细胞对外界环境压力的抵抗能力[12]。在低水分条件下,阪崎克罗诺杆菌可以产生大量的海藻糖。海藻糖可稳定磷脂膜和蛋白质之间的结构,以抵抗有害的外部干燥环境[13]。此外,细胞中相容物质的摄取和合成,如脯氨酸、甜菜碱、甘氨酸、胆碱也可以在渗透调节过程中发挥关键作用,从而保护菌株细胞免受干燥环境造成的损害[14]。虽然目前对于阪崎克罗诺杆菌耐干燥机制已经开展了一些研究,但并未发现属于该菌的独特机制,因此,很难解释阪崎克罗诺杆菌突出的干燥抵抗能力。需要进一步研究该致病菌突出耐干燥能力的潜在机制。
前期对一株耐干燥能力较强的阪崎克罗诺杆菌进行了蛋白质组学分析,从蛋白表达水平分析了菌株在干燥刺激前后蛋白表达的差异[15]。其中,ESA-00281基因编码的假设蛋白表现出明显的表达差异。对比分析显示,它与鼠伤寒沙门氏菌中对应的同系物STM3155相似度为51.88%,STM3155由于在半固体培养基中表达情况类似于其他的运动相关基因,因此,被描述为运动基因[16]。Hartmann等[11]通过转座子突变构建阪崎克罗诺杆菌ESA-00281突变体发现,该基因对生物膜结构有强烈影响,且有助于与Caco-2肠上皮细胞的黏附。但该基因对阪崎克罗诺杆菌脱水耐受性的影响及其作用机制尚需进一步研究。
本研究构建阪崎克罗诺杆菌ATCC BAA-894的ESA-00281基因敲除菌株和回补菌株,基于对野生株、突变株及回补株的耐干燥能力、表面疏水性、膜透过性以及运动性、生物膜形成能力进行比较分析,探究ESA-00281基因在阪崎克罗诺杆菌耐干燥过程中的可能作用机制,可为阪崎克罗诺杆菌的防控提供参考。
1 材料与方法
1.1 材料与试剂
阪崎克罗诺杆菌标准菌株ATCC BAA-894:美国菌种保藏中心。S17lambda pir菌株、DH5α菌株、pCVD442质粒等为食品营养与安全国家重点实验室保存。
限制性内切酶BamHI、SalI:美国NEB公司;DNA提取试剂盒:天根生化科技有限公司;肉膏蛋白胨培养基(lauria broth,LB):美国BD公司;平板计数琼脂培养基:国药集团化学试剂有限公司;RPMI-1640培养液:赛默飞世尔科技(中国)有限公司;质粒小提试剂盒:美国OMEGA公司;无缝克隆和组装试剂盒:中国诺唯赞生物科技有限公司;甲醛(分析纯):上海生工生物有限公司;结晶紫、1-N-苯基萘胺(分析纯)、二甲苯(分析纯):天津泰进科技有限公司。
1.2 主要仪器
DYY-6C型电泳仪、WD-9405B型水平摇床:北京市六一仪器厂;德国Eppendorf公司;UV-Vis紫外可见分光光度计:上海光谱仪器有限公司;HCJ-4C型磁力搅拌水浴锅:苏州东鹏仪器制造有限公司;5424C-150339型台式离心机:艾本德中国有限公司;LBI-250型生化培养箱:上海龙跃仪器设备有限公司;OHG-914385型电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司;Sunrise Basic酶标仪:奥地利Tecan公司。
1.3 试验方法
1.3.1 引物设计
参考美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)阪崎克罗诺杆菌ATCC BAA-894基因序列设计引物(Genbank序列号:NC_009778.1),引物序列见表1,引物位置见图1。

图1 引物位置示意图Fig.1 Locations of primers

表1 试验引物Table 1 Primers for test
1.3.2 ESA-00281基因缺失突变体的构建
在阪崎克罗诺杆菌ATCC BAA-894中,使用pCVD442自杀载体介导的同源重组实现ESA-00281基因的敲除[17]。使用引物pCVD442F和pCVD442R(表1)对pCVD442进行线性化。使用两对引物ESA-00281UF/ESA-00281UR和ESA-00281DF/ESA-00281 DR(表1)从阪崎克罗诺杆菌ATCC BAA-894的DNA中扩增ESA-00281的上下同源臂。使用商用无缝克隆和组装试剂盒将上游和下游片段克隆到pCVD442自杀载体中,生成目标载体pCVD442-Q-H。将目标载体转化到大肠杆菌S17 lambda pir,然后通过电转化构建缺失突变体ΔESA-00281。
1.3.3 回补菌株的构建
使用含有限制性内切酶位点的cpESA-00281F/cpESA-00281R引物(表1)从阪崎克罗诺杆菌ATCC BAA-894的基因组DNA中扩增ESA-00281基因。将产物克隆到pACYC184,转移到突变体中获得回补菌株cpESA-00281。对重组质粒和回补菌株中ESA-00281编码区的核苷酸序列进行测序验证。
1.3.4 生长曲线的测定
取活化后的菌液按照1∶100(体积比)接种于LB液体培养基中培养14 h。从转接开始,每隔1 h取样,测定OD600。用LB液体培养基作为空白对照。测定菌液OD600直至平台期,最后绘制出生长曲线。比较阪崎克罗诺杆菌ATCC BAA-894野生型菌株、ΔESA-00281突变株和回补株生长曲线的差异。每个样本作3个平行。
1.3.5 耐干燥性评估
将菌株活化,以1∶100(体积比)将10μL培养12h~14 h的菌液接种于1 mL LB液体培养基培养到对数期(OD600值为0.6~0.8),平板计数琼脂培养基培养12 h~14 h后进行平板计数,得到干燥前的菌落总数。将对数期的菌液加入96孔板并置于灭菌的干燥器中(内有500 g脱水硅胶),封口膜密封,每个干燥器内放置1个96孔细胞培养板,置于温度为37℃、湿度为45%的恒温培养箱恒温恒湿培养6 d后取出96孔板,在每个孔中加入200 μL/孔的磷酸盐缓冲溶液,梯度稀释后平板计数琼脂培养基培养12 h~14 h后进行平板计数,得到干燥后的菌落总数。以上步骤重复3次,计算死亡率。死亡率越高,耐干燥能力越弱。
1.3.6 表面疏水性评估
将菌株接种于LB液体培养基中,置于摇床中振荡培养(37℃、200 r/min)12 h~14 h。5 000 r/min离心5 min后收集菌体,用磷酸盐缓冲溶液冲洗3次后,将OD600调至0.5,将2 mL细菌悬浮液与400 μL二甲苯混合液在室温(25±1)℃下培养2 h,取出水相物质测定OD600值,记为H。细菌表面疏水性指数(H/%)计算公式为H/%=(0.5-H)/0.5 ×100[18]。
1.3.7 生物膜形成能力评估
将菌株接种于10 mL LB液体培养基中,37℃培养至细胞密度达到107CFU/mL,各取100 μL菌液加入96孔细胞培养板中,以无菌的LB培养基为空白对照,置于37℃恒温培养箱静置培养48 h。48 h后取出96孔板,将悬浮的菌液吸出,待平板完全干透后于孔中加入200 μL 99%甲醇将生物膜固定15 min,吸出上清液,将平板晾干。随后,向孔中加入200 μL 0.1%结晶紫(crystal violet,CV)溶液。30 min后取出多余的 CV,用生理盐水清洗3次,将结晶紫溶液洗净。最后,加入200 μL 95%乙醇释放结合的CV。使用Sunrise Basic酶标仪在570 nm处测量吸光度。
1.3.8 运动能力评估
运动性分析参考文献[19]稍加修改。将菌株接种于LB液体培养基中,置于摇床中振荡培养(37℃、200 r/min)12 h~14 h。吸取 5 μL 菌液滴于软琼脂平板(含0.3%琼脂的LB琼脂培养基)中央,待无菌风吹干后封口膜密封于30℃恒温培养箱倒置培养12 h~14 h,观察菌落大小。
1.3.9 膜透过性评估
将菌株接种于LB液体培养基中,振荡培养(37℃、200 r/min)12 h~14 h。12 000 r/min离心 1 min获得菌体沉淀,用磷酸缓冲盐溶液洗涤3次后,利用磷酸缓冲盐溶液将菌体复溶至OD600值为0.5。取1.92 mL细胞悬液和80 μL荧光探针1-N-苯基萘胺混合,设置荧光分光光度计的宽度、激发波长和发射波长分别设置为5、350 nm和420 nm,在此条件下监测混合物的荧光强度[20]。
1.4 数据处理与统计学分析
使用Origin8.0进行统计分析。每个试验独立重复3次,以确保重复性。所有结果均采用邓肯多区间检验和方差分析(ANOVA)进行分析,以分析组间的差异。
2 结果与分析
2.1 ESA-00281缺失突变体和回补菌株的构建与验证
构建ESA-00281基因敲除突变体ΔESA-00281及相应的回补菌株cpESA-00281。突变株和回补株的聚合酶链式反应(polymerase chain reaction,PCR)验证结果见图2。

图2 突变株和回补株的PCR验证Fig.2 PCR validation of the mutant and complementary strains
利用ESA-00281F/R和YZESA-00281F/R引物对突变株进行验证,利用ESA-00281F/R对回补株进行验证。结果显示,ESA-00281F/R引物对在野生株、突变株和回补株中扩增片段大小为367 bp、无扩增、367 bp,YZESA-00281F/R引物对在野生株和突变株中扩增片段大小分别为979、577 bp,证明敲除株和回补株均构建成功。
2.2 ESA-00281在阪崎克罗诺杆菌ATCC BAA-894中的作用分析
2.2.1 阪崎克罗诺杆菌野生株、突变株及回补株生长曲线的测定
Research on coupled heating system of air source heat pump and gas boiler
用紫外可见分光光度计测定生长曲线,结果见图3。

图3 阪崎克罗诺杆菌野生株、突变株及回补株的生长曲线Fig.3 Growth curves of wild,mutant and complementary strains of C.sakazakii
由图3可知,与野生株相比,ΔESA-00281突变体及cpESA-00281回补株表现出类似的生长速度,回补株相对于其他两株菌先进入对数期,但三者均符合细菌正常生长的规律,OD600均于10 h左右开始保持稳定。结果表明,生长性能并不受基因缺失的影响,排除了不同生长规律对后续试验结果的影响。
2.2.2 阪崎克罗诺杆菌野生株、ΔESA-00281突变株及回补株耐干燥性评估
对阪崎克罗诺杆菌野生株、突变株及回补株6 d干燥胁迫下的死亡率进行检测,结果见图4。

图4 阪崎克罗诺杆菌野生株、突变株及回补株的干燥死亡率Fig.4 Desiccation-induced mortality rates of wild,mutant and complementary strains of C.sakazakii
由图4可知,野生株、突变株、回补株的干燥死亡率分别为56.02%、64.78%、57.84%。干燥刺激后,相对于野生株 WT,ΔESA-00281突变株的死亡率有所升高,回补株的死亡率则与野生株大致相同,表明ESA-00281基因的缺失降低了阪崎克罗诺杆菌的干燥耐受能力,ESA-00281在阪崎克罗诺杆菌抵御干燥环境过程中起到正向作用。
2.2.3 表面疏水性分析
对野生株、ΔESA-00281突变株及其回补株的表面疏水性进行了比较分析,结果见图5。
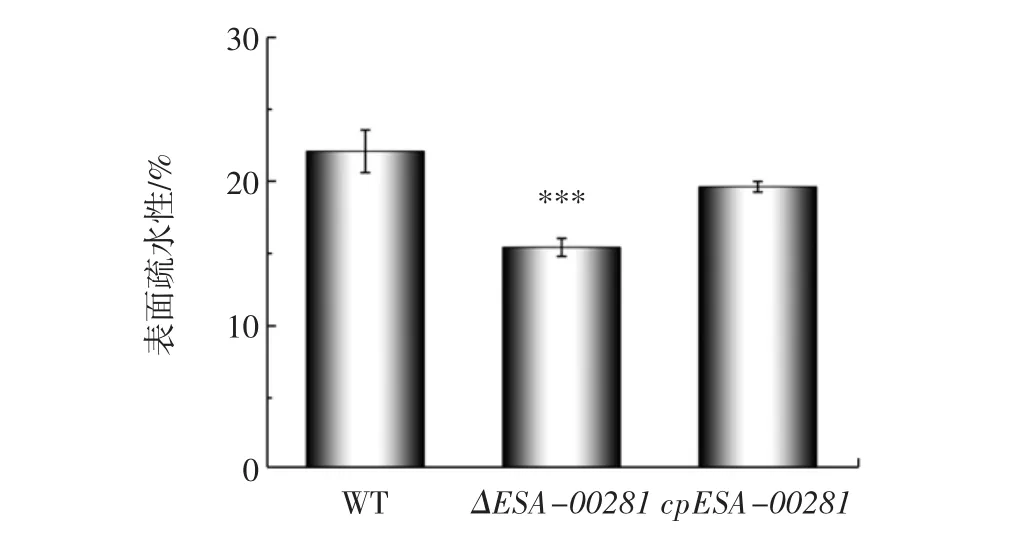
图5 阪崎克罗诺杆菌野生株、突变株及回补株细胞表面疏水性Fig.5 Cell surface hydrophobicity of wild,mutant and complementary strains of C.sakazakii
2.2.4 生物膜形成能力分析
采用结晶紫染色研究ESA-00281基因对阪崎克罗诺杆菌ATCC BAA-894生物膜形成的影响,结果见图6。
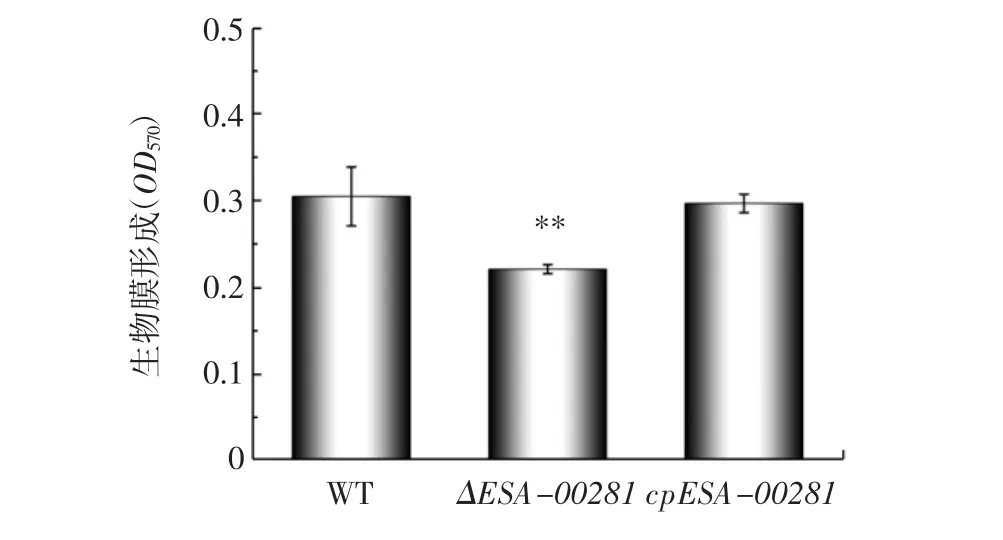
图6 阪崎克罗诺杆菌野生株、突变株及回补株的生物膜形成能力比较Fig.6 Biofilm formation capacity of wild,mutant and complementary strains of C.sakazakii
由图6可知,与野生型相比,ΔESA-00281突变株的生物膜量明显减少,回补株的生物膜形成能力与野生株相似。结果表明,ESA-00281基因在生物膜形成方面发挥正向作用。
2.2.5 运动能力分析
阪崎克罗诺杆菌在半固体培养基培养可以形成明显的运动环。野生株(WT)、ΔESA-00281突变株和cpESA-00281回补株的菌株运动性结果见图7。

图7 阪崎克罗诺杆菌野生株、突变株及回补株的运动性鉴定Fig.7 Mobility identification of wild,mutant and complementary strains of C.sakazakii
由图7可知,与野生株相比,ΔESA-00281突变株的运动环直径无明显变化,表明ESA-00281对阪崎克罗诺杆菌的运动性无关。
2.2.6 膜透过性测定结果
对阪崎克罗诺杆菌野生株、ΔESA-00281突变株及回补株细胞的外膜通透性进行测定,结果见图8。
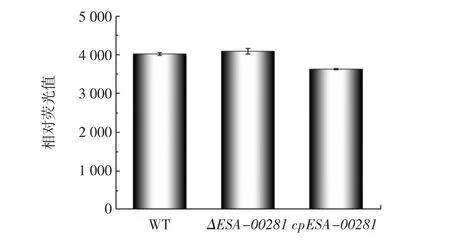
图8 阪崎克罗诺杆菌野生株、突变株及回补株细胞膜通透性测定Fig.8 Membrane permeability of wild,mutant and complementary strains of C.sakazakii
由图8可知,与野生株相比,ΔESA-00281突变株的膜通透性无明显变化,说明ESA-00281基因的缺失并不会影响其外膜通透性。
3 讨论与结论
以上试验说明,ESA-00281基因对菌体生长、运动性以及细胞膜通透性无明显影响,可通过调节细胞表面疏水性及生物膜的形成能力等机制以抵抗外界环境的压力并确保生命活动的正常进行,从而应对干燥胁迫,调节菌株的耐干燥性能。在面对外界复杂的生存环境时,最先感知到外界变化并作出响应的往往是细菌细胞的表面,细菌细胞的表面具有许多生物活性物质,它们体现了细菌生命活动的情况,其变化会影响细胞的表面疏水性。在液体环境中,细胞表面的疏水作用使细胞表面具有一定的黏附能力[21],从而增强其生存能力。文献[11]表明,该基因对Caco-2细胞的黏附有一定的影响。因此,ESA-00281基因缺失导致的表面疏水性降低可能是该突变株耐干燥能力下降的原因之一。细菌细胞形成菌膜能有效提高对外界环境的耐受性[22]。一般认为,细菌可以通过形成生物膜以增加对干燥环境的抵抗力[23]。很多报道已经显示,菌膜形成对沙门氏菌[24]、单核细胞增生李斯特菌[25]和大肠杆菌抵抗干燥环境具有重要作用[26]。本结果表明,ESA-00281可能通过促进生物膜的形成进而增强耐干燥能力。
本文利用基因敲除技术构建了ΔESA-00281突变株,并以此研究阪崎克罗诺杆菌ATCC BAA-894中该基因的功能。对阪崎克罗诺杆菌ATCC BAA-894野生株及ΔESA-00281突变株的耐干燥性比较结果显示,ESA-00281基因缺失后菌株在干燥胁迫下的死亡率有所升高,表明该基因在阪崎克罗诺杆菌耐干燥中发挥正向作用。此外,对阪崎克罗诺杆菌ATCC BAA-894野生株及ΔESA-00281突变株的生理活性进行比较分析,结果显示,ESA-00281对于阪崎克罗诺杆菌的生物膜形成及表面疏水性发挥正向调节作用,表明该基因可能通过改变表面疏水性来调节生物膜的形成和对介质的黏附,从而正向调节菌株的耐干燥能力。
