外源诱导物对丛毛红曲霉固态发酵产莫纳可林K的影响
2022-10-18温钦友叶燕芳郑政淮张亚如陈丽晨黄志伟
温钦友,叶燕芳,郑政淮,张亚如,陈丽晨,黄志伟*
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建农林大学福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
红曲米是将红曲霉(Monascus)接种到大米中发酵制备而成的,含有多种活性物质,是一种药食两用的传统中药,也可作为食品的染色剂和防腐剂、治疗消化不良等。红曲米的生理功能主要来源于红曲霉的活性代谢产物[1],如莫纳可林K[2](monacolin K,MK)、γ氨基丁酸和色素等[3]。其中MK具有降低胆固醇、抗癌防癌、神经保护、抗炎抑菌等功效[4-6]。MK又称洛伐他汀(lovastatin),最早由日本学者远藤章于1979年从红色红曲霉(M.ruber)的发酵产物中首次分离获得[7],MK可通过竞争性抑制胆固醇合成限制酶——3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMGR)的活性而抑制胆固醇的合成,从而降低人体和动物血液中的胆固醇水平[8]。研究表明,在红曲米中至少含有14种具有降血脂功能的物质,包括莫纳可林K、莫纳可林J、莫纳可林L、莫纳可林M、莫纳可林X及它们的酸式结构、脱氢莫纳可林K、二氢莫纳可林L、康伐他汀等[9]。除了产生具有降血脂作用的活性物质,多数红曲霉菌株还会产生具有肝肾毒性的桔霉素,这种毒素的存在限制了红曲霉产业的发展[10]。但不同红曲霉菌株产桔霉素的能力差异很大,Dai等[11]从商业红曲产品中分离出4株丛毛红曲霉菌株 MS-1、YDJ-1、YDJ-2 和 K104061,且发现这4株丛毛红曲霉在高产MK的同时不产桔霉素,这对丛毛红曲霉的进一步开发利用具有深远意义。
他汀类药物已成为降血脂治疗的主流药物[12-13],因此如何提高发酵产物中的MK产量是红曲霉领域近年来的研究热点。一般红曲霉产MK的常见发酵模式有固态发酵(solid state fermentation,SSF)和液态发酵(submerged fermentation,SmF)[2]。相比 SmF,SSF 法有许多优势,如真菌在SSF中能够产生更高活性的酶,因而代谢产物的产量也更高,甚至能够产生SmF下无法生成的酶类[14],还有研究发现,SSF下红曲霉的MK合成速率、甘油消耗率、生物量的积累速率、细胞膜的流动性与渗透性以及甘油耐受浓度都明显高于SmF下的红曲霉[15-16],SSF发酵的MK产量高出SmF下的数倍甚至数十倍[17-18]。
向红曲霉的固态发酵基质中添加碳源(甘油、葡萄糖、乳糖等)、氮源(谷氨酸、大豆粉、蛋白胨等)、无机盐等营养物质,也是提高其MK产量的有效方法之一。甘油常作为碳源,用于红曲霉的MK发酵[15]。Shi等[19]通过生理学和转录组分析发现,在红曲霉发酵过程中甘油加速了其糖酵解和碳代谢。也有研究指出甘油不仅被红曲霉用作碳源,而且直接参与其代谢[20]。这些研究表明,甘油作为碳源在红曲霉发酵中起到了很好的促进作用。氮源是真菌菌丝生长必需的营养物质,也能促进 MK 合成,如 NaNO3[21]、大豆粉[22]等,张占军等[23]利用响应面法研究发现,当接种量为17.50%、装料量为32.95 g/250 mL、玉米粉添加量为3.80%和蛋白胨添加量为2.37%时,烟色红曲霉(Monasucs fuliginosus Sato)固态发酵的MK产量最高。此外,将一些氨基酸作为氮源或前体物质添加到培养基中,能显著提高红曲霉的MK产量[24],如谷氨酸[25]、蛋氨酸[26]。对于红曲霉等许多丝状真菌,某些单价和二价阳离子对其细胞的生长和代谢产物的合成都具有重要的促进作用,Panda等[27]研究发现MgSO4、NH4Cl和NaCl均能大幅度提高紫色红曲霉菌株MTCC 369的MK产量,MnSO4和CaCl2也有促进效果。Dikshit等[28]对紫色红曲霉(M.purpureus)与血红红曲霉(M.sanguineus)两种菌株的SSF培养基进行优化,结果发现MgSO4·7H2O和MnSO4·7H2O对两种菌株的MK产量都有显著的促进作用。
目前,紫色红曲霉、红色红曲霉和丛毛红曲霉为红曲发酵生产中3种主要红曲霉,国内外学者关于提高红曲霉MK产量的研究报道,多以红色红曲霉和紫色红曲霉的研究为主,关于丛毛红曲霉的文献报道较少。因此,根据前期研究结果,选择11种对红曲霉MK产量具有显著提高效果的外源诱导物,研究其对丛毛红曲霉固态发酵产MK的影响,从而为丛毛红曲霉更好地应用于高MK红曲发酵产物的工业化生产提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株与试剂
丛毛红曲霉(Monascus pilous)菌株 CICC 5045:中国工业微生物菌种保藏管理中心。葡萄糖、琼脂粉、蛋白胨、磷酸二氢钾、无水乙醇、氢氧化钠、磷酸、蛋氨酸、谷氨酸、三水合乙酸钠、二水合柠檬酸钠、FeSO4·7H2O、MgSO4·7H2O、ZnSO4·7H2O、MnSO4·H2O、Na2MoO4·2H2O、CaCl2、CoCl2·6H2O(均为分析纯):国药集团化学试剂有限公司;乙腈(色谱纯):格雷斯(中国)有限公司;MK标准品(洛伐他汀≥98%):中国食品药品检定研究院。
1.1.2 仪器与设备
中药粉碎机(50 g,LG-01):瑞安市百信药机有限公司;高压蒸汽灭菌锅(MJ-54A):施都凯仪器设备有限公司;超低温保存箱(MDF-382E):日本三洋电机贸易会社;电子天平(BSA2202S-CW)、电子天平(BSA-124S-CW):赛多利斯科学仪器有限公司;水浴锅(HH-2):江苏金坛精达仪器制造厂;洁净工作台(VS-1300LU):苏州安泰空气技术有限公司;恒温摇床(ZHWY-200D):上海智城分析仪器制造有限公司;霉菌培养箱(MJX-50):宁波江南仪器厂;电热鼓风干燥箱(DHG-9005):上海一恒科学仪器有限公司;高效液相色谱仪(e2695):美国沃特斯公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g新鲜土豆,削皮、切块,于沸水中煮20 min至煮烂成汁,经4层纱布过滤后,加入葡萄糖20 g、琼脂粉20 g,加水溶解后定容至1 000 mL,121℃下高压灭菌20 min。
种子液培养基:葡萄糖60g、蛋白胨20g、NaNO32g、KH2PO41 g、MgSO41 g,于250 mL三角瓶中装入100 mL种子液培养基,121℃下高压灭菌20 min。
固态发酵基础培养基:取30 g大米,加入6 g甘油与20 mL水,封口后于121℃下高压灭菌20 min。
1.2 试验方法
1.2.1 丛毛红曲霉固态发酵的培养方法
丛毛红曲霉固态发酵的培养方法参照Zhang等[15]与陈慎等[29]的研究方法:用无菌水冲洗PDA斜面培养基上培养7 d~14 d的红曲霉孢子并轻轻刮下,倒入种子液培养基中。将种子液培养基置于28℃恒温摇床内,160 r/min振荡培养2 d后,取8 mL种子培养液,加入到装有固态发酵基质的塑料发酵瓶内,并置于28℃培养箱内培养3 d,待米粒长满菌丝后,加入20 mL无菌水,随后每日加水5 mL并将米粒摇匀打散,培养至第15天,发酵完成。
1.2.2 丛毛红曲霉固态发酵产MK的单因素试验设计
在固态发酵基础培养基中,分别加入蛋氨酸(0.05、0.10、0.15、0.20、0.25 mg/g)、谷氨酸(0.25、0.50、0.75、1.00、1.25 mg/g)、三水合乙酸钠(0.60、0.80、1.00、1.20、1.40 mg/g)、二水合柠檬酸钠(1.00、1.50、2.00、2.50、3.00 mg/g)、FeSO4·7H2O(0.05、0.10、0.15、0.20、0.25mg/g)、MgSO4·7H2O(1.00、1.50、2.00、2.50、3.00 mg/g)、ZnSO4·7H2O(1.00、1.50、2.00、2.50、3.00mg/g)、MnSO4·H2O(1.00、1.25、1.50、1.75、2.00 mg/g)、Na2MoO4·2H2O(0.25、0.50、0.75、1.00、1.25 mg/g)、CaCl2(1.00、1.50、2.00、2.50、3.00mg/g)、CoCl2·6H2O(0.05、0.10、0.15、0.20、0.25 mg/g),培养基的其他成分及培养条件均保持一致,同时以不添加外源诱导物的固态发酵基础培养基作为对照,按照1.2.1中的方法进行丛毛红曲霉的固态发酵培养后,检测发酵产物的MK含量,每个处理设4个重复。
1.2.3 丛毛红曲霉固态发酵外源诱导物最优组合的响应面优化设计
根据固态发酵的单因素试验结果,选取MK产量提高效果最显著的3种外源诱导物,进行外源诱导物最优组合的响应面试验设计,因素水平见表1。

表1 响应面试验的因素和水平Table 1 Factors and levels of response surface experiment
1.2.4 固态发酵产物中MK含量的高效液相色谱检测
待测样品的前处理:将发酵培养后的红曲米样品置于60℃的鼓风干燥箱中烘干至恒重,随后将红曲米研磨粉碎并过80目筛,取1 g粉末置于10 mL离心管中,加入75%乙醇定容至10 mL,超声处理30 min,期间摇匀1次,待超声完成后再摇匀1次,并静置5 min,随后取上清液,经0.45 μm滤膜过滤后,用于高效液相色谱(high performance liquid chromatography,HPLC)进样检测。
酸型MK标准溶液的配制:称取1.50 mg MK标准品,置于10 mL棕色容量瓶中,加入2 mL 0.2 moL/L NaOH溶液,用75%乙醇溶解后定容至10 mL,50℃水浴30 min,期间振摇2次,使内酯型MK转化为酸型MK,配制成150 μg/mL的标准溶液,置于4℃冰箱中保存备用。
内酯型MK标准溶液的配制:称取1.50 mg MK标准品,置于10 mL棕色容量瓶中,用75%乙醇溶解后定容至10 mL,配制成150 μg/mL标准溶液,置于4℃下冰箱中存备用。
HPLC检测的色谱条件:Waters高效液相色谱仪(e2695),色谱柱为 SunfireC18(5μm,250mm×4.6mm);流动相为乙腈∶0.1%磷酸水溶液=55∶45(体积比);流速为1 mL/min;紫外检测器的波长为238 nm;柱温为30℃;进样量为 20 μL。
待测样品中MK含量(mg/kg)的计算公式如下。
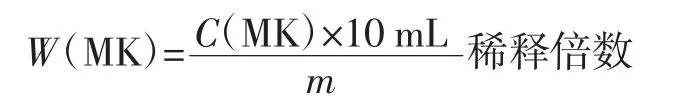
式中:W(MK)为样品中 MK 含量,mg/kg;C(MK)为MK标准品浓度和待测样品目标物质峰面积(A)的比值,μg/mL;m为待测样品的质量,g。
1.2.5 数据处理与统计
采用SPSS数据处理系统,对所有试验数据进行统计分析。
2 结果与分析
2.1 不同诱导物对丛毛红曲霉固态发酵产MK的影响
2.1.1 蛋氨酸对丛毛红曲霉固态发酵MK产量的影响
蛋氨酸添加量对丛毛红曲霉固态发酵MK产量的影响见图1。
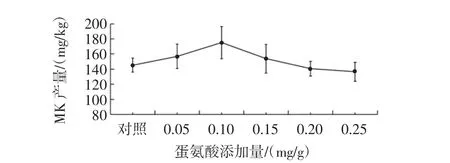
图1 蛋氨酸添加量对丛毛红曲霉固态发酵MK产量的影响Fig.1 Effect of methionine concentration on the production of MK of M.pilosus in SSF
由图1可知,不同添加量的蛋氨酸,丛毛红曲霉固态发酵的MK产量均与对照组没有显著差异。氨基酸是一种有机氮源,在丛毛红曲霉的固态发酵中添加蛋氨酸相当于添加有机氮源,其对丛毛红曲霉的生长发育具有重要意义[30]。但本研究中不同添加量的蛋氨酸,对丛毛红曲霉的MK产量没有显著促进作用,因此,可
不添加蛋氨酸。
2.1.2 谷氨酸对丛毛红曲霉固态发酵MK产量的影响谷氨酸添加量对丛毛红曲霉固态发酵产MK的影响见图2。
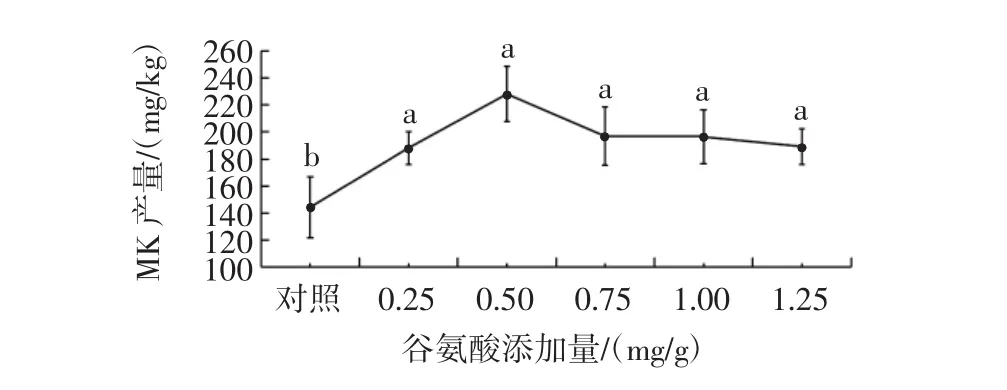
图2 谷氨酸添加量对丛毛红曲霉固态发酵产MK的影响Fig.2 Effect of glutamic acid concentration on the production of MK of M.pilosus in SSF
由图2可知,添加谷氨酸可显著提高丛毛红曲霉固态发酵的MK产量(P<0.05)。当谷氨酸添加量为0.50 mg/g时,MK产量可达227.29 mg/kg,比对照组的MK产量提高了57.9%,因此,丛毛红曲霉固态发酵产MK时,谷氨酸的最适添加量为0.50 mg/g。添加谷氨酸能够显著提高红曲霉的MK产量,其原因可能是谷氨酸能够改变红曲霉的细胞形态,从而增加MK的分泌[25]。此外,Zhang等[31]的研究结果表明,谷氨酸能提高红曲霉MK合成相关基因的表达,从而促进MK的合成。
2.1.3 三水合乙酸钠对丛毛红曲霉固态发酵MK产量的影响
三水合乙酸钠添加量对丛毛红曲霉固态发酵产MK的影响见图3。
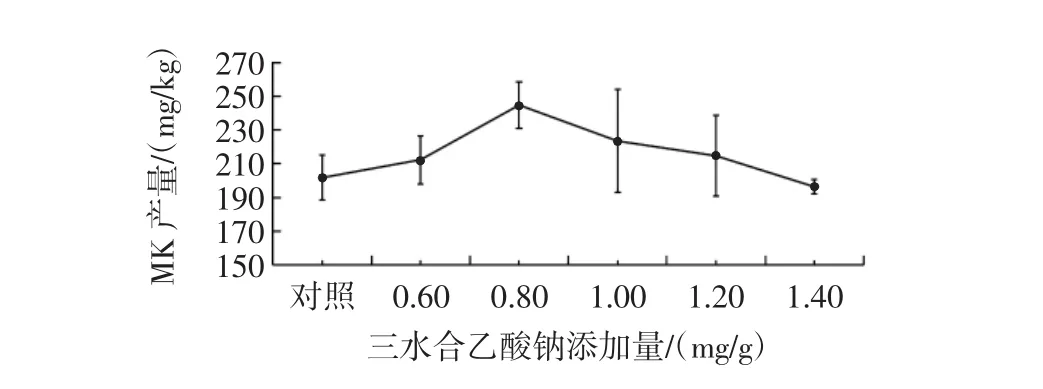
图3 三水合乙酸钠添加量对丛毛红曲霉固态发酵产MK的影响Fig.3 Effect of sodium acetate concentration on the production of MK of M.pilosus in SSF
由图3可知,不同添加量的三水合乙酸钠,丛毛红曲霉固态发酵的MK产量均与对照组没有显著差异。因此,丛毛红曲霉固态发酵产MK时,可不添加三水合乙酸钠。三水合乙酸钠对红曲霉发酵的MK合成有一定的促进作用,但三水合乙酸钠添加量过高会使培养基的pH值升高,从而不利于菌体的生长,进而抑制MK的合成[32]。
2.1.4 二水合柠檬酸钠对丛毛红曲霉固态发酵MK产量的影响
二水合柠檬酸钠添加量对丛毛红曲霉固态发酵产MK的影响见图4。
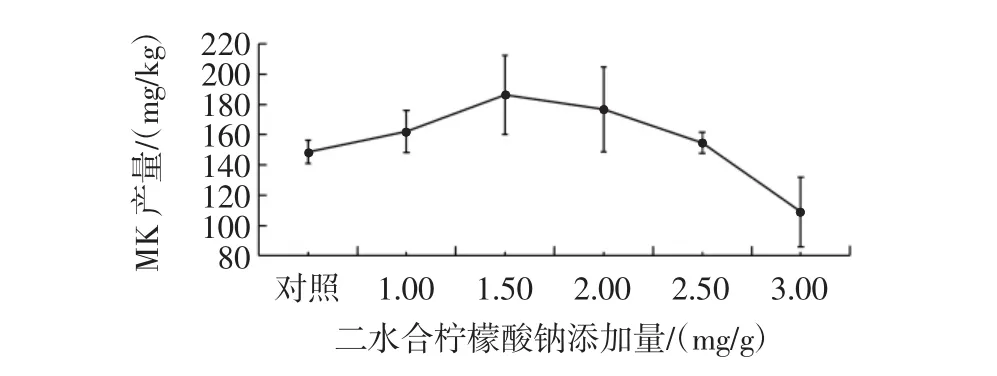
图4 二水合柠檬酸钠添加量对丛毛红曲霉固态发酵产MK的影响Fig.4 Effect of citric acid concentration on the production of MK of M.pilosus in SSF
由图4可知,不同添加量的二水合柠檬酸钠,丛毛红曲霉固态发酵的MK产量均与对照组没有显著差异。二水合柠檬酸钠对红曲霉发酵的MK合成有一定的促进作用,可能是由于二水合柠檬酸钠在水解时会释放碱性离子,使红曲霉发酵环境的pH值稳定在一定范围内,起到了缓冲作用,从而调节菌体细胞的渗透压[33]。但本研究中不同添加量的二水合柠檬酸钠,均未显著提高丛毛红曲霉的MK产量。因此,丛毛红曲霉固态发酵产MK时,可不添加二水合柠檬酸钠。
2.1.5 FeSO4·7H2O对丛毛红曲霉固态发酵MK产量的影响
FeSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响见图5。

图5 FeSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响Fig.5 Effect of FeSO4·7H2O concentration on the production of MK of M.pilosus in SSF
由图5可知,不同添加量的FeSO4·7H2O,丛毛红曲霉固态发酵的MK产量均与对照组没有显著差异。杨东成等[34]研究了3种金属离子对红曲霉发酵产生色素的影响,发现低浓度Fe2+能提高红色素的产量。冯光志等[35]的研究表明,Fe2+会促进某些真菌的菌丝生长,但其添加量超过279.3 mg/kg时反而抑制菌丝的生长。所以,推测适当添加量的Fe2+会促进丛毛红曲霉的菌丝生长,进而促进MK合成。但本研究中不同添加量的FeSO4·7H2O,均未明显提高丛毛红曲霉的MK产量。因此,丛毛红曲霉固态发酵产MK时,可不添加FeSO4·7H2O。
2.1.6 MgSO4·7H2O对丛毛红曲霉固态发酵MK产量的影响
MgSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响见图6。
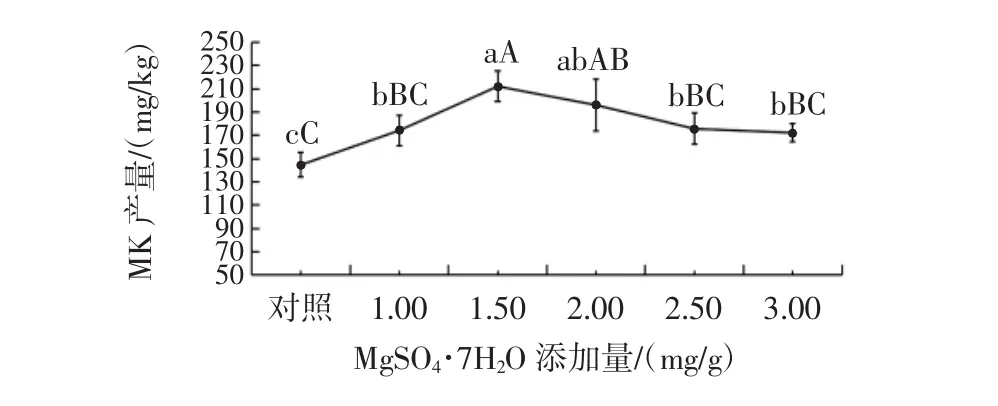
图6 MgSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响Fig.6 Effect of MgSO4·7H2O concentration on the production of MK of M.pilosus in SSF
由图6可知,不同添加量的MgSO4·7H2O,对提高丛毛红曲霉固态发酵的MK产量有显著效果。当MgSO4·7H2O添加量为1.50 mg/g时,MK产量达到最大(212.03 mg/kg),与对照组的差异达到极显著水平(P<0.01),比对照组的MK产量提高了46.5%;当MgSO4·7H2O添加量为0~1.50 mg/g时,丛毛红曲霉的MK产量随MgSO4·7H2O添加量的增加而增加。分析其原因,可能是Mg2+为真菌生长所需的微量元素[36]。Mg2+还能够促进土曲霉洛伐他汀合成前体物质的积累和菌体发育,从而提高洛伐他汀产量[37]。当MgSO4·7H2O添加量大于1.50 mg/g时,丛毛红曲霉MK产量的提高效果随MgSO4·7H2O添加量的增加而下降。分析其原因,可能是丛毛红曲霉生物量的快速积累,导致培养基中的营养物质消耗过快,进而造成MK产量的下降[38]。因此,丛毛红曲霉固态发酵产MK时,MgSO4·7H2O的最适添加量为1.50 mg/g。
2.1.7 ZnSO4·7H2O对丛毛红曲霉固态发酵MK产量的影响
ZnSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响见图7。
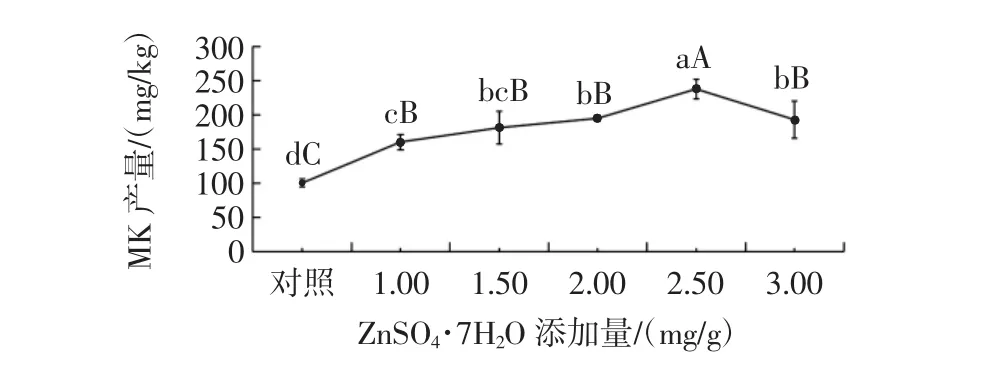
图7 ZnSO4·7H2O添加量对丛毛红曲霉固态发酵产MK的影响Fig.7 Effect of ZnSO4·7H2O concentration on the production of MK of M.pilosus in SSF
由图7可知,不同添加量的ZnSO4·7H2O,对提高丛毛红曲霉固态发酵的MK产量有显著效果。当ZnSO4·7H2O添加量为2.50 mg/g时,MK产量达到最大(237.86 mg/kg),与对照组的差异达到极显著水平(P<0.01),比对照组的MK产量提高了136.2%;随着ZnSO4·7H2O添加量的增加,丛毛红曲霉的MK产量也逐渐增加。分析其原因,可能是Zn2+能够提高丛毛红曲霉的色素产量[39],而色素与MK同为聚酮化合物,因此添加Zn2+对丛毛红曲霉的MK合成也有一定的促进作用,从而提高MK产量。当ZnSO4·7H2O的添加量大于2.50 mg/g时,丛毛红曲霉产MK的增长速率随着ZnSO4·7H2O添加量的增加而下降,可能是较高添加量的ZnSO4·7H2O促进丛毛红曲霉生物量的快速积累,导致营养物质过快消耗,从而影响其代谢产物的合成。因此,丛毛红曲霉固态发酵产MK时,ZnSO4·7H2O的最适添加量为2.50 mg/g。
2.1.8 MnSO4·H2O对丛毛红曲霉固态发酵MK产量的影响
MnSO4·H2O添加量对丛毛红曲霉固态发酵产MK的影响见图8。
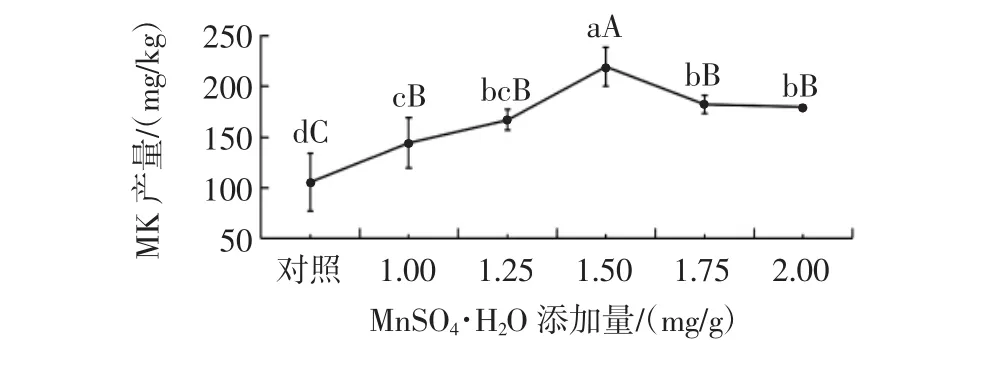
图8 MnSO4·H2O添加量对丛毛红曲霉固态发酵产MK的影响Fig.8 Effect of MnSO4·H2O concentration on the production of MK of M.pilosus in SSF
由图8可知,不同添加量的MnSO4·H2O,对提高丛毛红曲霉固态发酵的MK产量有显著效果。当MnSO4·H2O添加量为1.50 mg/g时,MK产量达到最大(219.29 mg/kg),与对照组的差异达到极显著水平(P<0.01),比对照组的MK产量提高了107.6%;当MnSO4·H2O的添加量为0~1.50mg/g时,随着MnSO4·H2O添加量的升高,丛毛红曲霉的MK产量也逐渐增加。这与Lin等[38]的研究结果一致,推测Mn2+可以通过促进MK生物合成途径中莫纳可林J和2-甲基丁酸前体的积累来促进MK的生成。因此,丛毛红曲霉固态发酵产MK的MnSO4·H2O最佳添加量为1.50 mg/g。
2.1.9 Na2MoO4·2H2O对丛毛红曲霉固态发酵MK产量的影响
Na2MoO4·2H2O添加量对丛毛红曲霉固态发酵产MK的影响见图9。
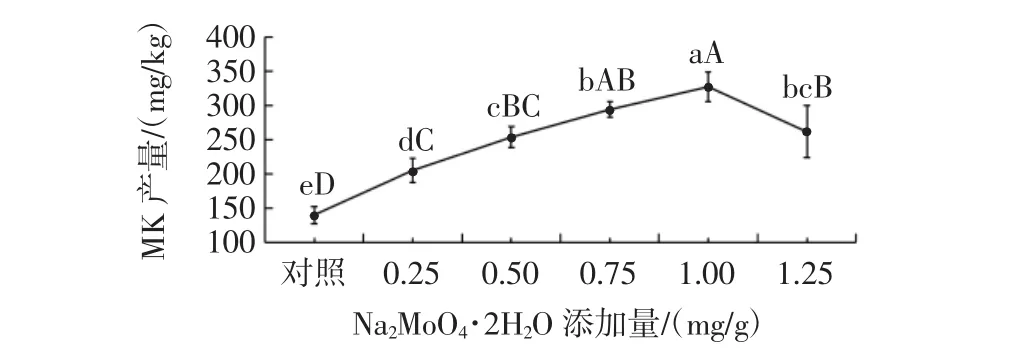
图9 Na2MoO4·2H2O添加量对丛毛红曲霉固态发酵产MK的影响Fig.9 Effect of Na2MoO4·2H2O concentration on the production of MK of M.pilosus in SSF
由图9可知,不同添加量的Na2MoO4·2H2O,对提高丛毛红曲霉固态发酵的MK产量有显著效果。当Na2MoO4·2H2O的添加量为1.00 mg/g时,MK产量达到最大(326.91 mg/kg),与对照组的差异达到极显著水平(P<0.01),比对照组的MK产量提高了133.3%;当Na2MoO4·2H2O添加量小于1.00 mg/g时,随着Na2MoO4·2H2O添加量的增加,丛毛红曲霉的MK产量也逐渐增加。分析其原因,可能是Mo6+具有与Zn2+相似的功能,能够促进聚酮化合物合成反应的进行,进而提高红曲霉的MK产量[39],此外,添加Na2MoO4·2H2O能够减少丛毛红曲霉在发酵过程出现的结块现象,也有助于丛毛红曲霉MK产量的提高。因此,丛毛红曲霉固态发酵产MK时,Na2MoO4·2H2O的最适添加量为1.00 mg/g。
2.1.10 CaCl2对丛毛红曲霉固态发酵MK产量的影响
CaCl2添加量对丛毛红曲霉固态发酵产MK的影响见图10。
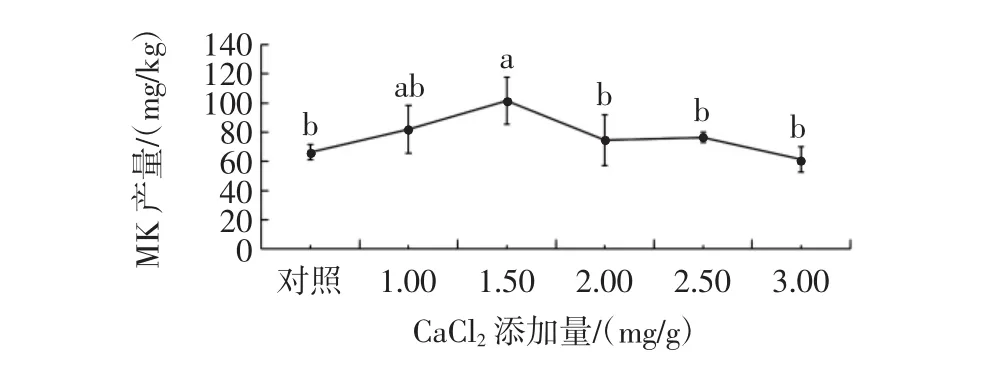
图10 CaCl2添加量对丛毛红曲霉固态发酵产MK的影响Fig.10 Effect of CaCl2concentration on the production of MK of M.pilosus in SSF
由图10可知,添加1.50 mg/g的CaCl2,能显著提高丛毛红曲霉固态发酵的MK产量,比对照组的MK产量提高了53.1%;当CaCl2添加量小于1.50 mg/g时,随着CaCl2添加量的升高,丛毛红曲霉的MK产量也逐渐增加;当添加量高于1.50 mg/g时,MK产量随着CaCl2添加量的增大而减小,且与对照组的MK产量无显著差异(P>0.05)。分析原因可能是较高的CaCl2添加量不利于丛毛红曲霉的生长,进而导致其MK产量下降[28]。因此,丛毛红曲霉固态发酵产MK时,CaCl2的最适添加量为1.50 mg/g。
2.1.11 CoCl2·6H2O对丛毛红曲霉固态发酵MK产量的影响
CoCl2·6H2O添加量对丛毛红曲霉固态产MK的影响见图11。
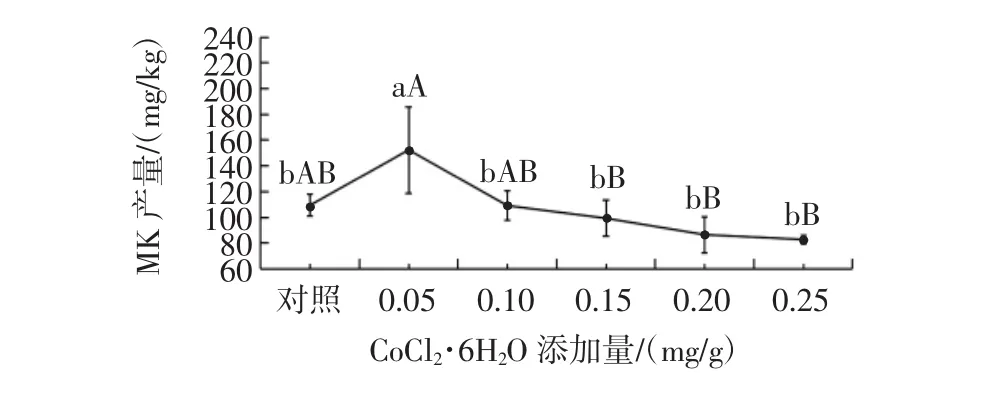
图11 CoCl2·6H2O添加量对丛毛红曲霉固态产MK的影响Fig.11 Effect of CoCl2·6H2O concentration on the production of MK of M.pilosus in SSF
由图11可知,CoCl2·6H2O添加量为0.05 mg/g时,可显著提高丛毛红曲霉固态发酵的MK产量,MK产量可达152.41 mg/kg,比对照组的MK产量提高了39.3%;当CoCl2·6H2O添加量大于0.05 mg/g时,MK产量随CoCl2·6H2O添加量的增加而逐渐减少。分析其原因,适当添加Co2+,对丛毛红曲霉的发酵培养起到了促进作用,会显著促进其菌丝生长和次生代谢产物的合成[35];但CoCl2·6H2O添加量过高时,反而抑制丛毛红曲霉的菌丝生长。因此,丛毛红曲霉固态发酵产MK时,CoCl2·6H2O添加量不宜超过0.05 mg/g。
2.2 固态发酵外源诱导物最优组合的响应面优化结果
2.2.1 响应面优化设计及结果分析
以ZnSO4·7H2O、MnSO4·H2O和Na2MoO4·2H2O 3种诱导物为试验因素,基于Box-Behnken试验设计,以MK产量为响应值,进行二次多项回归方程拟合及分析,试验设计及结果如表2所示。
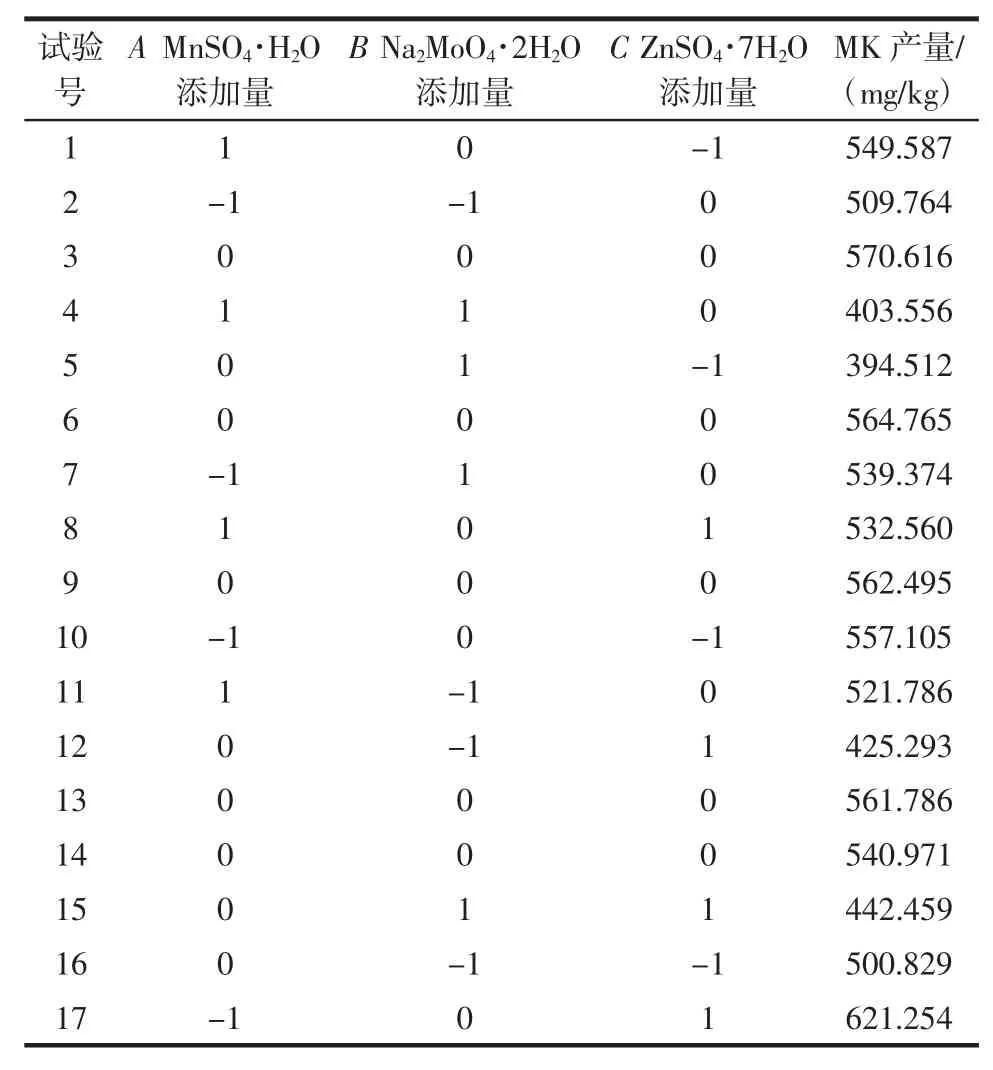
表2 外源诱导物最优组合的响应面优化结果Table 2 The results of response surface optimization for the optimal combination of inducers
对数据进行多项式拟合回归,得出二次多元回归方程:Y=560.13-27.5A-22.22B+2.44C-36.96AB-20.29AC+30.87BC+28.92A2-95.43B2-23.92C2。同时,对回归模型进行方差分析,结果如表3所示。
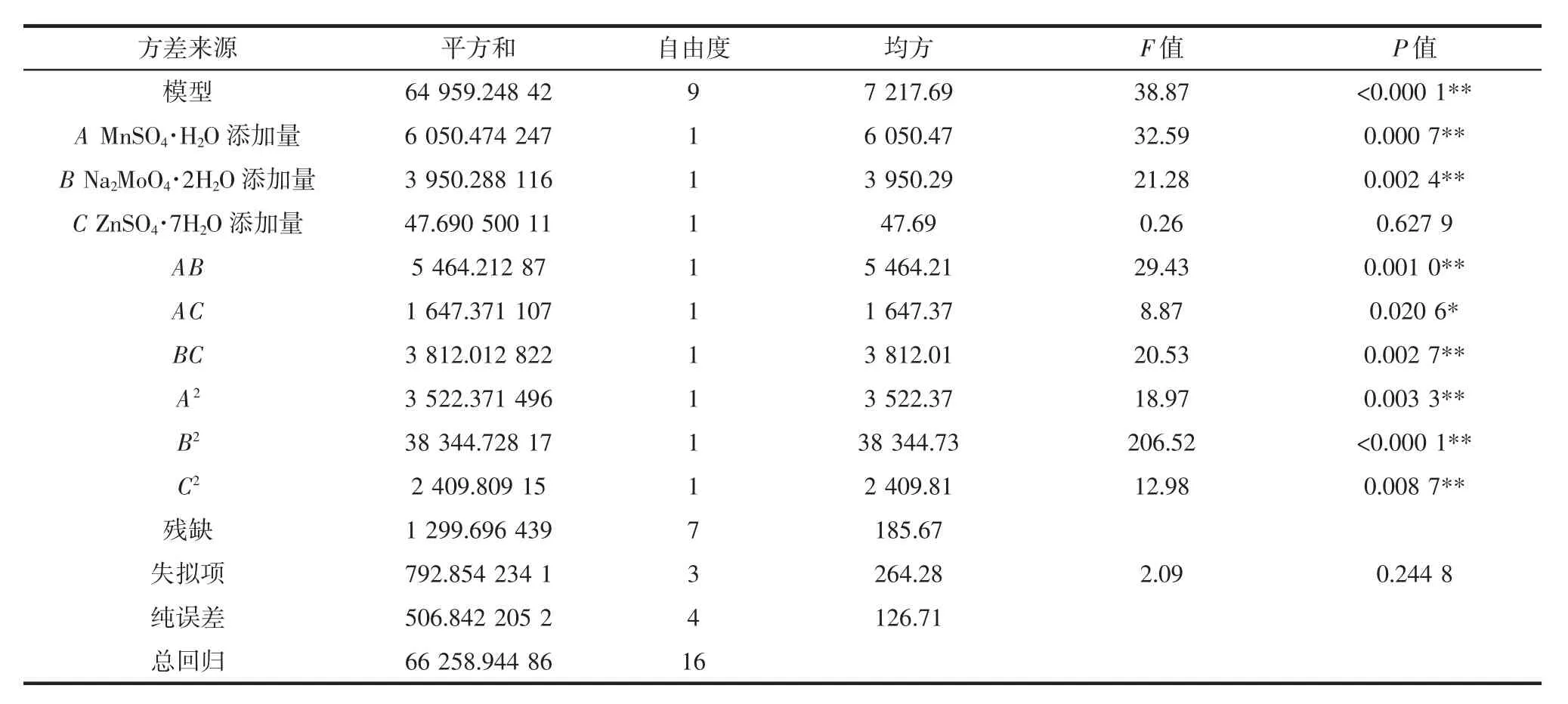
表3 响应面回归模型的方差分析结果Table 3 The variance analysis results of regression model of response surface
由表3可知,拟合方程的P<0.000 1,表明响应面的回归模型达到了极显著水平;失拟项P=0.244 8>0.05,失拟不显著,表明方程的拟合程度较好。因此,上述回归方程可以用于准确分析和预测各因素与MK产量之间的关系。回归模型的确定系数R2=0.980 4,说明该模型能解释98.04%响应值的变化。因此,该模型拟合程度较好,能很好地反映响应值的变化,可以利用此模型对丛毛红曲霉固态发酵的MK产量进行分析和预测。
此外,由回归模型的方差分析结果(表3)可知,方程一次项中的A项、B项,交互项AB、BC项和二次项A2、B2、C2对丛毛红曲霉MK产量的影响达到极显著水平;交互项AC对丛毛红曲霉MK产量的影响达到显著水平。F值的大小能够反映出各因素对MK产量的影响程度,根据F值可知,3种外源诱导物对丛毛红曲霉MK产量的影响的大小顺序为A(MnSO4·H2O)>B(Na2MoO4·2H2O)>C(ZnSO4·7H2O)。
根据回归拟合方程,做每2个因素对MK产量影响程度的响应面三维图,并对3组对比因素(AB、AC与BC)进行响应面模拟分析,结果见图12。
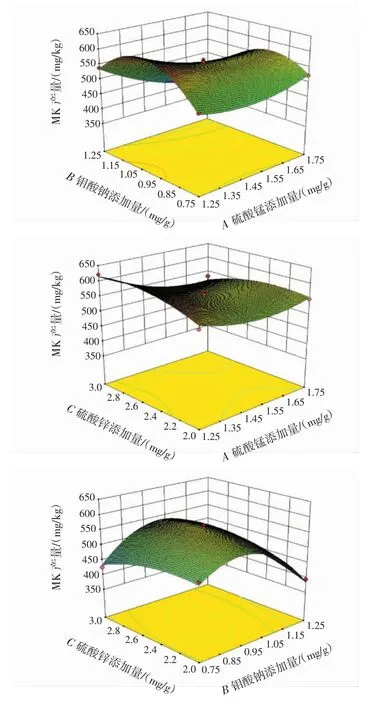
图12 各因素交互作用对MK产量的影响Fig.12 Interactive effects of variables on MK yield
如图12所示,BC图形的曲面向上凸起,表明了在两因素的影响下,存在最大值。AB与AC的两两因素之间交互作用的显著性较弱,而BC的两两因素间交互作用的显著性较强。
2.2.2 外源诱导物最优组合的预测及验证
通过回归模型的预测,当MnSO4·H2O添加量为1.20 mg/g、Na2MoO4·2H2O 添加量为 1.00 mg/g、ZnSO4·7H2O添加量为2.80 mg/g,在此条件下,丛毛红曲霉固态发酵的MK产量预测值为622.25 mg/kg。为验证模型预测的可靠性,根据预测的3种外源诱导物最佳添加量组合,进行3次平行试验,其MK产量平均为631.10 mg/kg,与预测的MK产量无显著差异,说明响应面法优化得到的外源诱导物最优组合的参数可靠。
3 结论
该试验研究了11种外源诱导物对丛毛红曲霉固态发酵MK产量的影响。结果表明,在适当的添加量下,11种外源诱导物对丛毛红曲霉的MK产量都有一定的提高效果,其中,ZnSO4·7H2O、MnSO4·H2O 和Na2MoO4·2H2O 3种诱导物对MK产量的提高效果最显著,分别比对照组提高了1.4倍、1.1倍、1.3倍。响应面优化结果表明,外源诱导物的最优组合为1.20 mg/g MnSO4·H2O、1.00 mg/g Na2MoO4·2H2O 和 2.80 mg/g ZnSO4·7H2O,其 MK 产量可达 631.10 mg/kg,与回归方程预测的MK产量无显著差异。
