大蒜多肽提取工艺的优化及其体外活性的测定
2022-10-18刘锦良沈衡平刘辉范丽霞杨安平叶连宝
刘锦良,沈衡平,刘辉,范丽霞,杨安平,叶连宝*
(1.广东药科大学,广东 广州 510006;2.欧露莲生物科技(广东)有限公司,广东 佛山 528051;3.佛山科学技术学院,广东 佛山 528000)
大蒜为百合科葱属植物蒜(Allium sativum L.)的鳞茎,是日常生活中最常见的药食两用的植物之一。可用于治疗肺结核、食欲不振、消化不良、痢疾、肠炎等疾病[1-2]。大蒜含有丰富的含硫有机化合物[3],此外还含有蛋白质、挥发油和微量元素等[4]。研究表明大蒜具有抗氧化[5]、抗菌[6]、提高机体免疫力[7]、预防和治疗癌症的作用[8]。
多肽一般是指由几个到多个氨基酸通过肽键连接起来的一类具有生物活性的化合物,也是蛋白质水解的中间产物[9]。研究表明,多肽在降血压、抗氧化、降血脂、护肤等方面均具有较好的活性[10]。许新月[11]运用超声辅助酶法制备的杏鲍菇多肽具有血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性,可用于治疗高血压。李文慧等[12]运用酶法提取的葡萄籽多肽具有较好的抗氧化能力。张囡[13]制备的香菇柄多肽对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌均具有抑菌作用。
目前关于大蒜的研究主要集中在蒜氨酸、大蒜素等成分[14-15]。关于大蒜多肽的研究鲜有报道[16]。本试验拟通过酶解法提取大蒜多肽,采用单因素试验、响应面法优化大蒜多肽的提取工艺,并对大蒜多肽的抗氧化能力及其对酪氨酸酶的抑制率进行测定,为进一步开发利用大蒜提供参考。
1 材料与方法
1.1 材料与试剂
大蒜:市售;牛血清白蛋白(bovine serum albumin,BSA)、双缩脲试剂、复合蛋白酶(120 U/mg):上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、酪氨酸酶(500U/mg):上海麦克林生化科技有限公司;无水乙醇、维生素C(vitamin C,VC)、磷酸缓冲盐溶液(phosphate buffered saline,PBS):广东光华科技股份有限公司;总抗氧化能力(T-AOC)试剂盒:南京建成生物工程研究所;硫酸亚铁:安吉豪森药业有限公司;水杨酸:天津市光复精细化工研究所。所有试剂均为分析纯。
1.2 仪器与设备
UNIQUE-R40型超纯水仪:厦门锐思捷水纯化技术有限公司;JJ-2型组织捣碎匀浆机:金坛市医疗仪器厂;DF-101T型集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;DZKW-S-8型恒温水浴锅:北京市永光明医疗仪器有限公司;PHS-3C型实验室pH计:上海锦幻仪器仪表有限公司;TG16-WS型台式高速离心机:湖南湘仪实验室仪器开发有限公司;Varioskan Flash型多功能酶标仪:美国赛默飞世尔科技公司;V-1100D型紫外可见分光光度计:上海美普达仪器有限公司。
1.3 方法
1.3.1 材料处理
参考文献[17]的方法,称取大蒜100.0 g,在微波900 W条件下加热5 min破坏蒜氨酸酶后备用。
1.3.2 标准曲线的绘制
参考文献[18]的方法,精密称取牛血清白蛋白,加入超纯水配制成浓度为10 mg/mL的标准蛋白溶液,然后加入超纯水进行倍半稀释,得到浓度为5.000、2.500、1.250、0.625、0.313 mg/mL 和 0.156 mg/mL 的系列牛血清白蛋白溶液,取上清液,吸取20μL上清液置于96孔板中,加入200 μL双缩脲试剂,在37℃下反应30 min后,在540 nm处测吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,回归方程为y=0.013x-0.001,R2=0.998。
1.3.3 大蒜多肽的提取与测定
取2.0 g微波处理后的大蒜,置于组织捣碎匀浆机内,加入30 mL纯化水,捣碎2 min,制备匀浆,加入1.5%的复合蛋白酶在pH7.0、50℃条件下酶解2.5 h,5 000 r/min离心10 min,吸取20 μL上清液置于96孔板中,加入200 μL双缩脲试剂,在37℃下反应30 min后,在540 nm处测吸光度,根据1.3.2中所得回归方程,计算大蒜多肽提取量。
1.3.4 单因素试验
参考文献[19]的方法,以2.0 g大蒜为基准,料液比1∶10(g/mL)、复合酶添加量 1.5%、pH7.0、50℃和酶解时间2.5 h为基准条件,固定其他因素及相应的水平,分别考察料液比 [1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)]、复合酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、pH 值(6.0、6.5、7.0、7.5、8.0)、温度(40、45、50、55、60 ℃)、酶解时间(1.5、2.0、2.5、3.0、3.5 h)对大蒜多肽提取量的影响。
1.3.5 响应面法优化提取工艺
参考文献[20]的方法,使用Design-Expert 8.0软件程序,根据Box-Behnken中心组合试验设计原理,以大蒜多肽提取量为响应值,通过响应面分析对提取条件进行优化,选择出大蒜多肽提取量最高的提取条件为最佳提取工艺。响应面因素水平见表1。
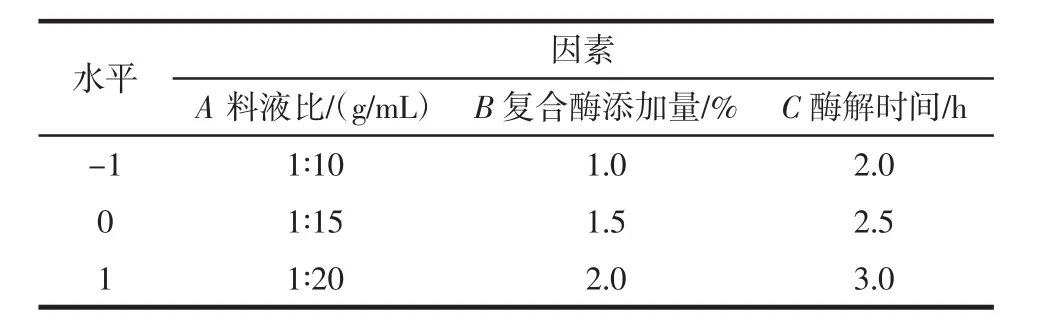
表1 响应面因素水平Table 1 Response surface factor level
1.3.6 大蒜多肽的活性测定
1.3.6.1 大蒜多肽对DPPH自由基清除率的测定
将大蒜多肽用超纯水配制成浓度为2、4、6、8、10 mg/mL的系列溶液,参考文献[21]的方法,略有改动。于96孔板中分别加入100 μL大蒜多肽溶液、100 μL 0.1 mmol/L DPPH溶液,25℃下避光反应30 min,在517 nm处测吸光度,记为A1。用等体积超纯水代替DPPH溶液测定吸光度,记为A2,用等体积超纯水代替大蒜多肽溶液,测定吸光度,记为 A3;维生素 C(VC)作为阳性对照。每组试验重复3次,取平均值。

式中:A1为大蒜多肽液与DPPH混合液的吸光度;A2为大蒜多肽液与超纯水混合液的吸光度;A3为DPPH与超纯水混合液的吸光度。
1.3.6.2 大蒜多肽总抗氧化能力的测定
将大蒜多肽用超纯水配制成浓度为2、4、6、8、10 mg/mL的系列溶液,按照总抗氧化能力测定试剂盒说明书方法,进行总抗氧化能力测定试验。VC作为阳性对照。每组试验重复3次,取平均值。
1.3.6.3 大蒜多肽对羟基自由基清除率的测定
将大蒜多肽用超纯水配制成浓度为2、4、6、8、10 mg/mL的系列溶液,参考文献[22]的方法,取5支试管,分别加入 1 mL 9 mmol/L FeSO4、1 mL 9 mmol/L 水杨酸-乙醇,混匀,再分别加入1 mL不同浓度的大蒜多肽溶液,最后加1 mL 8.8 mmol/L H2O2启动反应,于37℃下反应30 min,以超纯水为参比,在510 nm处测定吸光度。由于大蒜多肽本身有一定的吸光度,以1mL 9 mmol/L FeSO4、1 mL 9 mmol/L水杨酸-乙醇和1 mL不同浓度的大蒜多肽作为待测溶液的本底吸光度。VC作为阳性对照。每组试验重复3次,取平均值。

式中:A1为空白对照液的吸光度;A2为加入大蒜多肽溶液后的吸光度;A3为不加显色剂H2O2的待测溶液本底的吸光度。
1.3.6.4 大蒜多肽对酪氨酸酶抑制率的测定
将大蒜多肽用超纯水配制成浓度为2、4、6、8、10 mg/mL的系列溶液,参考文献[23-24]的方法,略有改动。按照表2加样结束后,于37℃水浴下恒温反应10 min,各加入0.2 mL酪氨酸酶溶液,反应20 min,迅速移入比色皿中,用紫外可见分光光度计在475 nm处测定各体系的吸光度。以熊果苷作为对照。每组试验重复3次,取平均值。

表2 大蒜多肽抑制酪氨酸酶活性的反应体系Table 2 The reaction system of inhibition of garlic peptides on tyrosinase mL

式中:A、B、C、D分别为表中各反应体系反应结束后在475 nm处的吸光度。
1.3.7 数据分析
试验中每组试验重复3次,单因素考察用Graph-Pad Prism 8.0作图,响应面法用Design Expert 8 Box-Behnken分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对大蒜多肽提取量的影响
料液比对大蒜多肽提取量的影响见图1。

图1 料液比对大蒜多肽提取量的影响Fig.1 The effect of soil-liquid ratio on the extraction efficiency of garlic peptides
由图1可知,随着溶剂体积的增加,大蒜多肽提取量先上升后下降。在料液比为 1∶10(g/mL)~1∶15(g/mL)时大蒜多肽提取量升高,在料液比为1∶15(g/mL)到1 ∶30(g/mL)时提取量逐渐下降,当料液比为 1∶15(g/mL)时,大蒜多肽提取量达到最大,这可能是由于当溶剂体积过少时,不利于多肽的彻底溶解,而溶剂体积过多时,其他杂质也会溶出,从而影响多肽的溶出。因此,确定提取大蒜多肽的最佳料液比为1∶15(g/mL)。
2.1.2 复合酶添加量对大蒜多肽提取量的影响
复合酶添加量对大蒜多肽提取量的影响见图2。

图2 复合酶添加量对大蒜多肽提取量的影响Fig.2 The effect of compound proteinase addition on the extraction efficiency of garlic peptides
由图2可知,随着复合酶添加量的增加,大蒜多肽提取量呈现先升高再下降的趋势。在复合酶添加量为0.5%~2.0%时,大蒜多肽提取量迅速增加,而复合酶添加量在2.0%~2.5%时,大蒜多肽提取量开始下降,复合酶添加量为2.0%时,大蒜多肽提取量达到峰值,这是因为随着酶添加量的增加,反应速度加快,而酶添加量继续增加时,由于底物逐渐减少,大蒜多肽提取量呈下降趋势。因此,确定提取大蒜多肽的最佳复合酶添加量为2.0%。
2.1.3 pH值对大蒜多肽提取量的影响
pH值对大蒜多肽提取量的影响见图3。

图3 pH值对大蒜多肽提取量的影响Fig.3 The effect of pH value on the extraction efficiency of garlic peptides
由图3可知,随着pH值的增加,大蒜多肽提取量先上升后下降。在pH值为6.0~7.0时,两者呈正相关,而在pH值为7.0~8.0时,大蒜多肽提取量呈下降趋势,这是因为pH值过高或者过低均会影响酶的活性,从而影响大蒜多肽提取量。因此,确定提取大蒜多肽的最佳pH值为7.0。
2.1.4 温度对大蒜多肽提取量的影响
温度对大蒜多肽提取量的影响见图4。
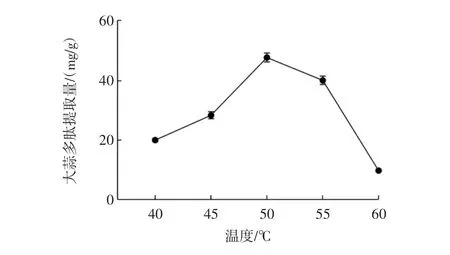
图4 温度对大蒜多肽提取量的影响Fig.4 The effect of temperature on the extraction efficiency of garlic peptides
由图4可知,随着温度的增加,大蒜多肽提取量先升高后降低。在温度为40℃~50℃时,大蒜多肽提取量逐渐升高,而温度继续升高时,大蒜多肽提取量迅速下降,产生这一现象的原因可能是温度过高使酶的活性降低,同时较高的温度破坏了部分浸出的多肽,从而使大蒜多肽提取量有所下降。因此,确定提取大蒜多肽的最佳温度为50℃。
2.1.5 酶解时间对大蒜多肽提取量的影响
酶解时间对大蒜多肽提取量的影响见图5。
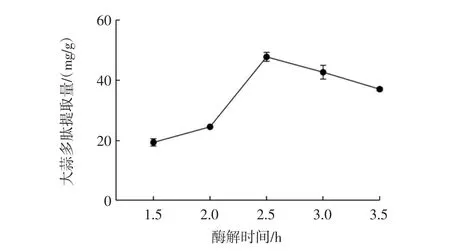
图5 酶解时间对大蒜多肽提取量的影响Fig.5 The effect of enzymatic time on the extraction efficiency of garlic peptides
由图5可知,随着酶解时间的延长,大蒜多肽提取量先升高后下降。酶解时间为1.5 h~2.5 h时,大蒜多肽提取量逐渐升高,2.5 h时达到最大,而继续延长酶解时间,大蒜多肽提取量开始下降,这可能是因为随着酶解时间的延长,热水致使部分多肽分解,导致大蒜多肽提取量有所降低,此外,酶解时间延长还可能会使溶解的杂质增多,从而使多肽的纯度降低。因此,确定提取大蒜多肽的最佳酶解时间为2.5 h。
2.2 响应面试验结果
2.2.1 响应面试验方案及结果
在单因素试验结果的基础上,选择对大蒜多肽的提取量影响较大的料液比(A)、复合酶添加量(B)、酶解时间(C)3个因素,以大蒜多肽的提取量为响应值,根据响应面分析方法,设计三因素三水平试验方案,试验设计方案共17个试验点,12个为分析试验,其余5个为中心试验(用于估算试验误差)。响应面试验设计及结果见表3。

表3 响应面试验设计及结果Table 3 Experiments design and results for response surface analysis
2.2.2 回归方程的建立与方差分析
试验结果进行多元拟合回归,得到以大蒜多肽提取量(Y)为因变量,以料液比(A)、加酶量(B)、酶解时间(C)为自变量的回归方程为Y=37.10-2.35A+2.43B+0.42C-0.73AB-4.13AC+1.03BC-12.21A2-6.01B2-8.01C2。
回归方程方差分析见表4。
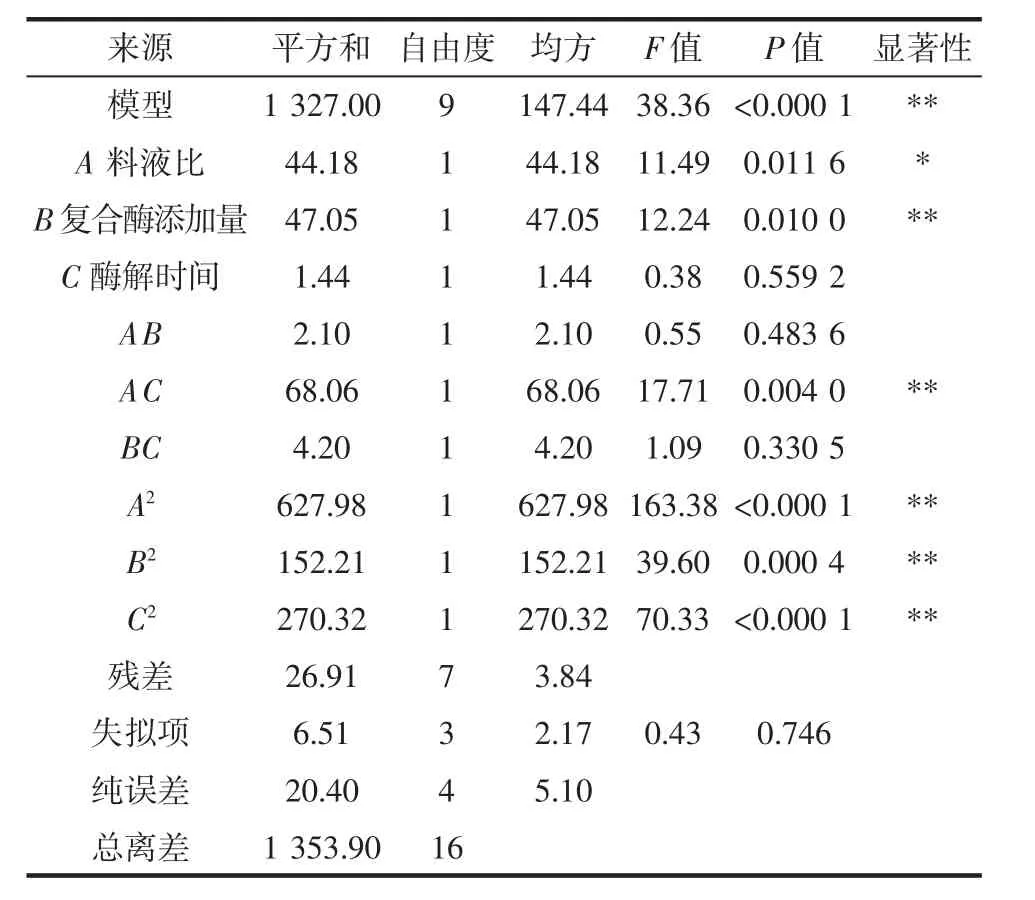
表4 回归方程方差分析Table 4 Analysis of variance of regression equation
由表4可知,回归模型P<0.000 1,水平为极显著,能够正确反映大蒜多肽提取量与各因素之间的关系,失拟项P值为0.746>0.05,表示差异不显著,说明回归模型与实际试验拟合较好,多元相关系数R2=0.980,表明实测值和预测值间有很好的拟合度。由P值可知,A为显著因素,B、AC、A2、B2、C2为极显著,说明料液比、复合酶添加量均对大蒜多肽提取量有较大影响。根据F值大小,可知影响因素的主次顺序为复合酶添加量(B)>料液比(A)>酶解时间(C)。方差分析结果显示,该回归模型可用于大蒜多肽提取试验。
2.2.3 响应面和等高线图结果
各试验因素交互作用的响应面及等高线图见图6。


图6 各试验因素交互作用的响应面和等高线图Fig.6 Response surface and contour plots of interaction of experimental factors
由图6可知,料液比与酶解时间之间的响应面曲面图较陡峭,等高线呈椭圆形,交互作用极显著(P<0.01),对大蒜多肽提取量的影响较大,与表4方差分析结果一致。
2.2.4 最佳工艺的确定及验证试验
根据软件分析,得最优工艺组合为料液比为1 ∶14.43(g/mL)、加酶量为 2.11%、pH 值为 7.0、温度为50℃、酶解时间为2.54 h,预测响应值为37.5 mg/g。为检验响应面法的可靠性,采用最优工艺组合进行试验证明,基于试验操作的可行性,选取料液比为1∶15(g/mL)、复合酶添加量为2.0%、pH值为7.0、温度为50℃、酶解时间为2.5h,试验重复3次,得到的响应值分别为35.5、36.3、35.6 mg/g,平均值为35.8 mg/g,是理论值的 95.5%,十分接近预测值,符合要求。
2.3 大蒜多肽的活性测定
2.3.1 大蒜多肽对DPPH自由基的清除率
大蒜多肽对DPPH自由基的清除率见图7。

图7 大蒜多肽对DPPH自由基的清除率Fig.7 The clearance ratio of garlic peptides on DPPH radical
由图7可知,大蒜多肽和VC对DPPH自由基清除率随着浓度的增加而增强,当大蒜多肽浓度为10 mg/mL时清除率为73.8%,VC浓度为10 mg/mL时清除率为97.1%。大蒜多肽清除DPPH自由基的IC50值为4.54 mg/mL。结果表明,大蒜多肽对DPPH自由基的清除率与VC相比较低,且随着浓度增加,清除率与VC越来越接近。
2.3.2 大蒜多肽的总抗氧化能力
大蒜多肽的总抗氧化能力见图8。

图8 大蒜多肽的总抗氧化能力Fig.8 The total antioxidant capacity of garlic peptides
由图8可知,当大蒜多肽浓度为10 mg/mL时总抗氧化能力为747.6 U/mg;对比VC浓度为10 mg/mL时总抗氧化能力为1 654.3 U/mg。大蒜多肽总抗氧化能力的IC50值为5.86 mg/mL。结果表明,大蒜多肽具有一定的总抗氧化能力,但随着大蒜多肽浓度的增加总抗氧化能力与VC的差距逐渐增大。
2.3.3 大蒜多肽对羟基自由基的清除率
大蒜多肽对羟基自由基的清除率见图9。
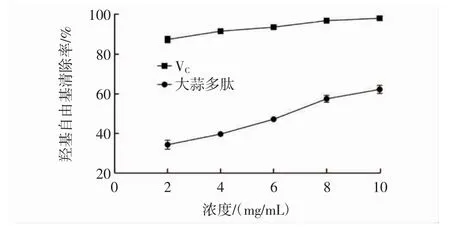
图9 大蒜多肽对羟基自由基的清除率Fig.9 The clearance ratio of garlic peptides on OH·radical
由图9可知,在大蒜多肽浓度为2 mg/mL~10 mg/mL时,羟基自由基的清除率为34.6%~64.5%;当VC浓度为10 mg/mL时清除率为98.1%。大蒜多肽清除羟基自由基的IC50值为5.81 mg/mL。结果表明,大蒜多肽对羟基自由基有一定的清除能力,与VC相比其对羟基自由基清除率较低。
2.3.4 大蒜多肽对酪氨酸酶的抑制率
大蒜多肽对酪氨酸酶的抑制率见图10。
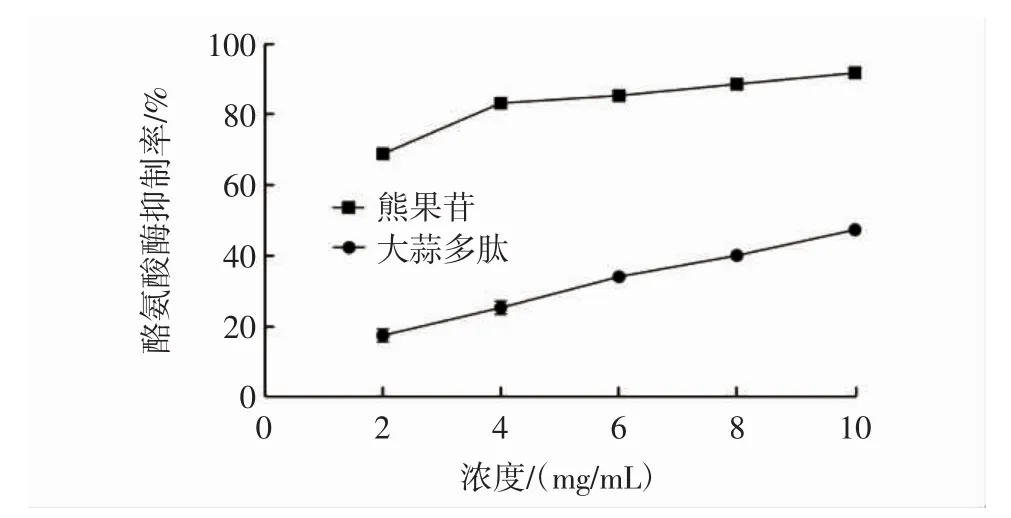
图10 大蒜多肽对酪氨酸酶的抑制率Fig.10 The inhibition ratio of garlic peptides on tyrosinase
由图10可知,当大蒜多肽浓度在2mg/mL~10mg/mL时,其对酪氨酸酶的抑制率在17.6%~48.1%之间;当熊果苷浓度为10 mg/mL时抑制率为90.6%。大蒜多肽抑制酪氨酸酶的IC50值为3.51 mg/mL。结果表明,熊果苷表现出更强的酪氨酸酶抑制能力,但大蒜多肽对酪氨酸酶仍具有一定的抑制能力。
3 结论
采用响应面法优化酶解法提取大蒜多肽的最佳提取条件为料液比1∶15(g/mL)、复合蛋白酶添加量2.0%、pH7.0、50℃、酶解时间2.5 h,提取量为 35.8 mg/g。大蒜多肽清除DPPH自由基、总抗氧化能力和清除羟基自由基的 IC50值分别 4.54、5.86、5.81 mg/mL,抑制酪氨酸酶活性的IC50值为3.51 mg/mL。与其他植物多肽相比,其DPPH自由基清除率高于其它植物多肽。试验结果表明,大蒜多肽具有较好的抗氧化活性,可作为抗氧化剂在食品中广泛应用。
