甘蔗叶多糖提取工艺优化及生物活性研究
2022-10-18陈远菲严德林莫雪婷杨梅苏佳月韦巧艳
陈远菲,严德林,莫雪婷,杨梅,苏佳月,韦巧艳
(广西科技师范学院食品与生化工程学院,广西 来宾 546199)
多糖是生命体的关键元素,广泛分布在植物、藻类、动物和真菌、细菌等微生物中。近年来,植物多糖因其具有免疫调节、抗肿瘤、抗氧化、抗菌、降血脂等特殊的理化性质和较高的生物学功能而备受关注[1-3]。由于天然多糖的得率、生物活性和化学结构受提取方法的影响较大,因此,开发一种高效提取天然植物多糖的方法以提高产率、增强生物活性、降低结构损伤具有重要的意义。热水提取是提取天然多糖的传统方法,但该法存在萃取时间长、萃取温度高、萃取率低、溶剂消耗率高、污染环境等缺点[4]。与传统的提取方法相比,超声辅助提取具有节约溶剂、提高提取率、缩短提取时间、提高多糖质量等优点,已被应用于植物多糖的提取[5-7]。球磨能够破坏植物细胞壁、增加颗粒破碎程度,促进细胞内有效成分的溶出,结合超声作用能够加速反应的进行[8-9]。目前球磨预处理结合超声辅助提取甘蔗叶多糖的研究鲜见报道。本文采用机械球磨法对甘蔗叶进行预处理并结合超声从甘蔗叶中提取水溶性多糖,通过红外光谱探究球磨预处理对甘蔗叶粉末结构的影响以及甘蔗叶多糖的化学结构,并对甘蔗叶多糖进行体外抑菌及抗氧化活性研究,以期为甘蔗叶多糖的生物活性研究和产品开发提供参考。
1 材料与方法
1.1 材料与试剂
甘蔗叶:采集于来宾市周边蔗田,洗净、烘干、粉碎,过60目筛,装袋备用;葡萄糖标准品、1,1-二苯基-2-三硝基苯肼(1,1-dip-henyl-2-picrylhydrazyl,DPPH)、水杨酸、硫酸亚铁(均为分析纯)、ZTC-II天然澄清剂:天津欧博凯化工有限公司;浓硫酸、苯酚、30%过氧化氢溶液(均为分析纯):西陇科学有限公司;无水乙醇、抗坏血酸(均为分析纯):成都市科隆化妆品有限公司;大肠杆菌、金黄色葡萄球菌、营养琼脂干粉培养基:广东环凯微生物有限公司。
1.2 主要仪器
KQ-300DB型超声波清洗仪:昆山市超声仪器有限公司;H3-20K台式高速离心机:力可成仪器设备有限公司;UV1050紫外可见分光光度计:上海天美科学仪器有限公司;FW177中草药粉碎机:天津市泰斯特仪器有限公司;HH-S数显恒温水浴锅:江苏常州金坛医疗仪器厂;IRTracer-100傅里叶变换红外光谱仪:岛津企业管理(中国)有限公司;LM-SJ-5立式球磨机:无锡新洋设备科技有限公司。
1.3 试验方法
1.3.1 标准曲线的测定
称取葡萄糖0.100 g于100 mL容量瓶中,蒸馏水定容;分别吸取 0、0.25、0.50、1.00、1.25、1.50 mL 于 25 mL容量瓶中,蒸馏水定容,再分别吸取上述溶液各1 mL于10 mL比色管中,用蒸馏水补至2 mL,制得0、0.01、0.02、0.04、0.60、0.80 mg/mL浓度的溶液。加入 2%苯酚1.0 mL和浓硫酸5.0 mL摇匀,沸水浴15 min后取出,冷却至室温(25±5)℃,在波长490 nm处测定吸光度[10]。以吸光度A为纵坐标,葡萄糖的质量浓度C(μg/mL)为横坐标,绘制标准曲线,得葡萄糖回归方程为y=10.448 0x+0.006 6(R2=0.999 1)。
1.3.2 甘蔗叶多糖提取量的测定
准确称取2.00 g甘蔗叶粉末,加入适量蒸馏水摇匀,按照设定的试验条件进行提取,提取结束后,离心(3 000 r/min、30 min)、真空抽滤,上清液浓缩后加入3倍体积无水乙醇摇匀,静置1 h,离心(5 000 r/min、5 min),沉淀用40 mL蒸馏水溶解并定容,置于30℃水浴锅中加入ZTC-II型澄清剂(先加入B组分3 mL,反应1 h后加入A组分,每隔30 min搅拌1次)反应2 h后,离心(6 000 r/min、6 min),取上清液 1 mL 加入1 mL蒸馏水、1 mL 2%苯酚及5 mL浓硫酸,摇匀后沸水浴加热15 min,冷却至室温(25±5)℃,在490 nm的波长处测定吸光度。甘蔗叶多糖提取量根据下列公式进行计算[11-12]。
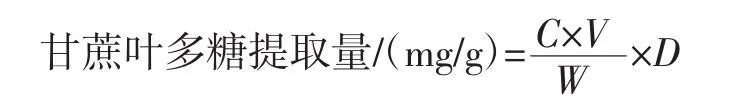
式中:C为按标准曲线方程得到的多糖溶液浓度,mg/mL;V为多糖溶液体积,mL;W 为原料质量,g;D为稀释倍数。
1.3.3 球磨预处理
称取甘蔗叶粉末 80 g,在球磨时间 30、50、70、90、110、130 min,球磨频率 5、10、15、20、25、30 Hz和球料比35 ∶1、40 ∶1、45 ∶1、50 ∶1、55 ∶1、60 ∶1(g/g)条件下进行研磨处理,称取球磨处理后甘蔗叶粉末2.00 g,在液料比 25∶1(mL/g)、45℃下反应 30 min,以甘蔗叶多糖提取量为考察指标,确定最适的预处理条件。
1.3.4 超声辅助提取甘蔗叶多糖的优化试验
准确称取最优预处理的甘蔗叶粉末2.00g到锥形瓶中,置于设定好超声时间(30、50、70、90、110、130 min)、超声功率(120、150、180、210、240、270 W)、超声温度(25、35、45、55、65、75 ℃)的超声反应器中,在液料比为 15 ∶1、20 ∶1、25 ∶1、30 ∶1、35∶1、40 ∶1(mL/g)的条件下进行单因素试验。
1.3.5 响应面优化试验设计
根据Box-Behnken设计原理优化超声辅助提取甘蔗叶多糖的工艺条件,并进行验证试验。试验因素及水平见表1。

表1 响应面试验因素与水平Table 1 Factor level and codes of response surface test design
1.3.6 甘蔗叶多糖的抑菌性能测定
采用纸片扩散法[13]测定甘蔗叶多糖的抑菌活性,滤纸片直径为6 mm,考察多糖浓度为0.08、0.10、0.12、0.14、0.16、0.18 mg/mL时对大肠杆菌及金黄色葡萄球菌的抑菌性能,以无菌生理盐水做空白对照,37℃条件下培养24 h,测量抑菌圈直径大小,抑菌圈直径越大,抑菌能力越强。
1.3.7 体外抗氧化活性测定
将 VC和多糖样品分别配制成 0.20、0.40、0.60、0.80、1.00、1.20 mg/mL 6个浓度梯度溶液,备用。
1.3.7.1 DPPH自由基清除性能测定
参照Yan等[14]方法略作修改,移取2 mL样品溶液与4 mL 0.05 mg/mL DPPH-乙醇溶液充分混匀后,避光反应30 min,以无水乙醇为参比溶液,VC做阳性对照,在517 nm处测其吸光度,结果按下列公式计算。
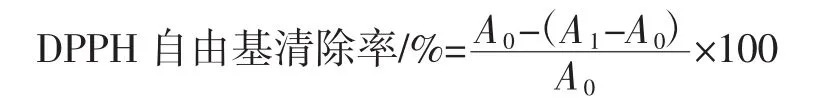
式中:A1为样品清除DPPH自由基后的吸光度;A2为样品本身吸光度(DPPH溶液换成乙醇);A0为空白组的吸光度(样品溶液换成乙醇)。
1.3.7.2 羟基自由基清除试验
参考杨电增等[15]的方法,移取2 mL样品溶液与等体积的9.0 mmol/L水杨酸-乙醇溶液、9.0 mmol/L硫酸亚铁溶液、9.0 mmol/L过氧化氢溶液充分混匀,37℃水浴30 min,以蒸馏水为参照溶液,VC做阳性对照,于510 nm处测其吸光度,结果按下列公式计算。

式中:A1为样品清除羟自由基后的吸光度;A2为样品本身吸光度(过氧化氢溶液换成蒸馏水);A0为空白组的吸光度(样品溶液换成蒸馏水)。
1.3.8 红外光谱分析
将样品(原料甘蔗叶粉和球磨预处理甘蔗叶粉、甘蔗叶多糖)与KBr混匀压片后放入傅里叶红外线光谱分析(Fourier transform infrared spectroscopy,FT-IR)仪中于4 000 cm-1~500 cm-1进行扫描。
1.3.9 数据分析
每组试验均进行3组平行试验,试验结果由平均值±标准差表示。采用Origin9.1和响应面软件进行数据处理及分析。
2 结果与分析
2.1 甘蔗叶球磨活化处理试验结果
2.1.1 球磨时间对甘蔗叶多糖提取量的影响
球磨时间对甘蔗叶多糖提取量的影响见图1。

图1 球磨时间对甘蔗叶多糖提取量的影响Fig.1 The influence of the ball milling time on the extraction amount of sugarcane leaf polysaccharide
由图1可知,甘蔗叶多糖的提取量随球磨时间的延长呈现先增后减的趋势,30 min~70 min时,随着球磨时间延长,多糖提取量增加,这可能是因为甘蔗叶粉末颗粒变小,其细胞破裂程度增加[16],70 min时提取量最大为8.52 mg/g;但球磨时间继续延长,提取量减少,可能是由甘蔗叶粉末磨细过程中粉末出现团聚[17]导致。
2.1.2 球磨频率对甘蔗叶多糖提取量的影响
球磨频率对甘蔗叶多糖提取量的影响见图2。
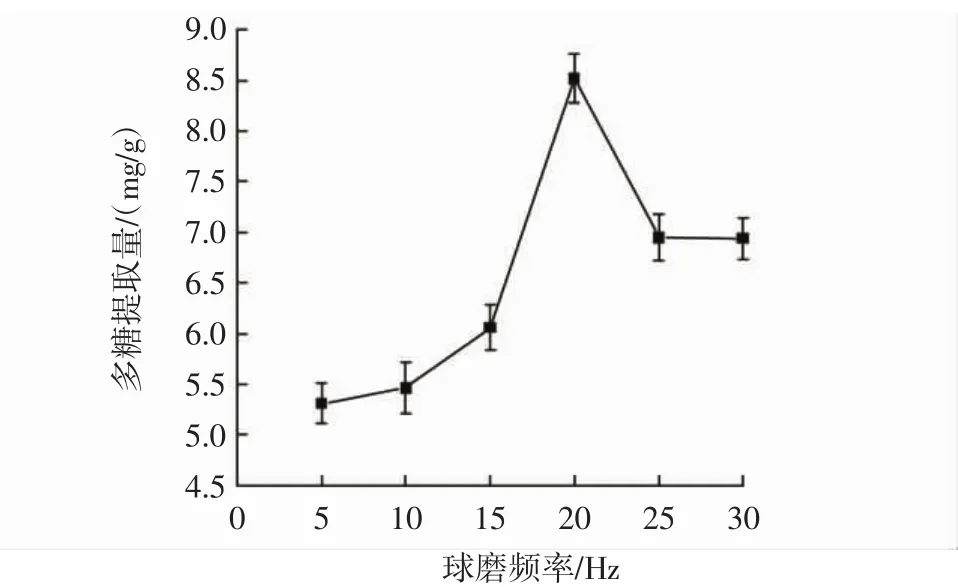
图2 球磨频率对甘蔗叶多糖提取量的影响Fig.2 The influence of the ball milling frequency on the extraction amount of sugarcane leaf polysaccharide
由图2可知,在5 Hz~20 Hz范围内甘蔗叶多糖的提取量随频率的增加而增加,20 Hz时达到最高提取量为8.52 mg/g,其原因可能是随着频率的增加粉末细胞破碎度增加[18],甘蔗叶多糖提取量上升;20 Hz之后,因为转速过大,球磨机内钢珠相互研磨时间过长,导致温度增加,多糖结构发生变化,多糖得率下降[19]。
2.1.3 球料比对甘蔗叶多糖提取量的影响
球料比对甘蔗叶多糖提取量的影响见图3。

图3 球料比对甘蔗叶多糖提取量的影响Fig.3 The influence of ball-to-material ratio on the extraction amount of sugarcane leaf polysaccharide
由图3可知,在球料比 35∶1(g/g)~45∶1(g/g)内,甘蔗叶多糖的提取量随球料比增大而增加,在球料比为45∶1(g/g)时多糖提取量达到最大值。可能是因为随着球料比的增大钢球与甘蔗叶粉末之间的碰撞频率增大,体系的机械能也增大,甘蔗叶粉末的结构受到破坏,其反应活性增强,从而促进多糖的溶出[20]。但当球料比过大时,磨料被挤压在磨球的下方,不能对磨料进行有效研磨[21],从而导致提取量少。
综上可知,机械活化预处理的最佳工艺条件为研磨时间 70 min,研磨功率 20 Hz,球料比 45 ∶1(g/g)。
2.2 超声辅助提取甘蔗叶多糖的单因素试验结果
2.2.1 超声时间对甘蔗叶多糖提取量的影响
超声时间对甘蔗叶多糖提取量的影响见图4。

图4 超声时间对甘蔗叶多糖提取量的影响Fig.4 Effects of ultrasonic time on the extraction amount of polysaccharide from sugarcane leaves
由图4可知,在超声时间30 min~70 min时,甘蔗叶多糖提取量随超声时间延长而增加,然而,在超过70 min之后,甘蔗叶多糖提取量下降。这可能是时间太短,水的提取效率降低导致多糖未能充分溶出,而时间太长,杂质的溶出增加导致多糖的提取量下降[22]。
2.2.2 超声功率对甘蔗叶多糖提取量的影响
超声功率对甘蔗叶多糖提取量的影响见图5。

图5 超声功率对甘蔗叶多糖提取量的影响Fig.5 Effects of ultrasonic power on the extraction amount of polysaccharide from sugarcane leaves
由图5可知,在超声功率120 W~270 W时,甘蔗叶多糖提取量先增后减,在210 W时达到最大值为9.09 mg/g;在超声功率超过210 W后,功率越高,提取量越低,这可能是由非糖物质的溶解造成的[23]。
2.2.3 超声温度对甘蔗叶多糖提取量的影响
提取温度对甘蔗叶多糖提取量的影响见图6。

图6 超声温度对甘蔗叶多糖提取量的影响Fig.6 Effects of ultrasonic temperature on extraction amount of polysaccharide from sugarcane leaves
由图6可知,在超声温度25℃~55℃时,甘蔗叶多糖提取量随超声温度升高而增大,至55℃时达到最高值为9.83 mg/g,之后随着超声温度的升高,提取量反而下降,可能是因为温度过高破坏了甘蔗叶多糖的糖苷结构,多糖降解,从而提取量下降[24]。
2.2.4 液料比对甘蔗叶多糖提取量的影响
液料比对甘蔗叶多糖提取量的影响见图7。

图7 液料比对甘蔗叶多糖提取量的影响Fig.7 Effects of liquid-material ratio on extraction amount of polysaccharide from sugarcane leaves
由图7可知,甘蔗叶多糖提取量在液料比从15 ∶1(mL/g)到 25∶1(mL/g)时明显增大,液料比从25 ∶1(mL/g)到 40∶1(mL/g)时逐渐下降。这可能是提取剂较少时甘蔗叶粉末团聚在一起,水分子不易进入,导致提取量减少[25];但过量的提取剂使超声能量更易于被提取剂吸收,相应的空化气泡对能量的吸收减少,导致细胞壁破裂不完全,降低了甘蔗叶多糖的提取量[26]。
2.3 响应面结果与分析
2.3.1 响应面结果
基于单因素分析,利用响应面优化软件的试验设计原理得到独立变量(液料比、超声温度、超声功率、超声时间)对多糖提取率的影响结果如表2所示。
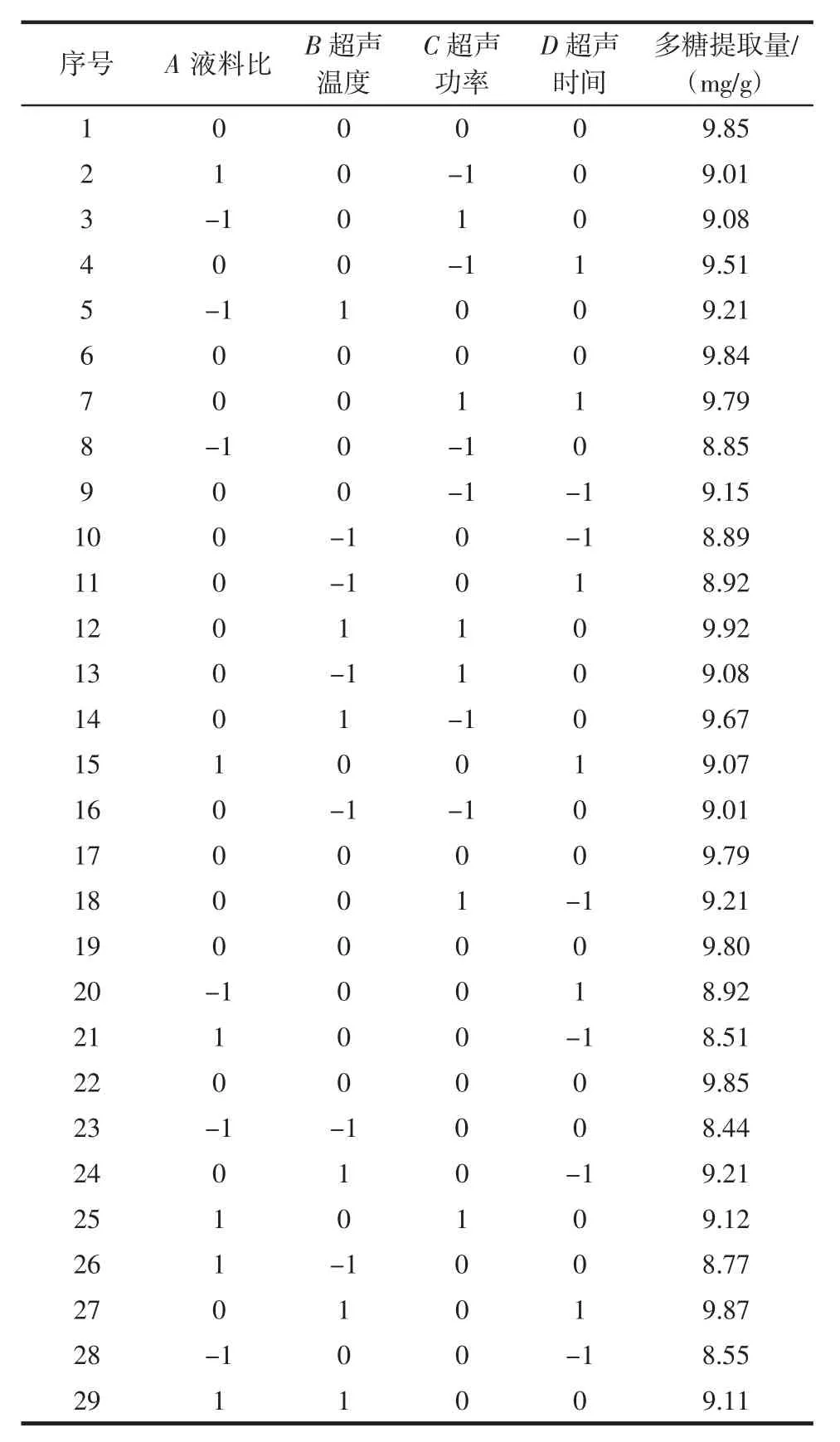
表2 响应面试验设计及响应值Table 2 The Box-Behnken response surface design and corresponding response values
用Design-Expert 8.0.6软件对所得的结果与输入变量之间的试验关系进行拟合,得到回归方程为Y=9.83+0.045A+0.32B+0.083C+0.21D-0.11AB-0.030AC+0.048AD+0.045BC+0.16BD+0.055CD-0.70A2-0.27B2-0.11C2-0.33D2。采用方差分析(ANOVA)来确认预测模型、各参数的显著性以及它们之间相互作用的影响。方差分析结果如表3所示。
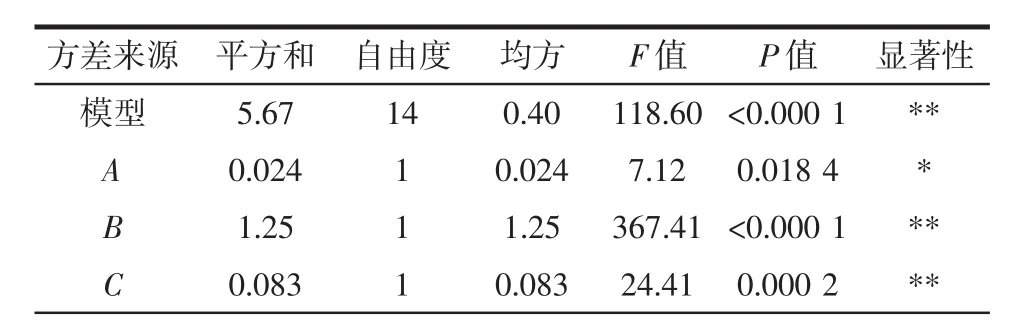
表3 方差分析Table 3 ANOVA analysis of response surface test

续表3 方差分析Continue table 3 ANOVA analysis of response surface test
由表 3 可知,回归模型 F=118.60,P<0.000 1,表明该模型出现误差的概率小于0.01%,回归方程可用于预测甘蔗叶多糖的提取过程;同时该模型的失拟项P=0.060 0>0.05,不显著。模型决定系数R2=0.991 6,R2Adj=0.983 3,表明试验响应值与预测值的相关度高。此外,变异系数(C.V.%=0.63)低显示了高度的可靠性和准确性。因此,可用该回归模型对甘蔗叶多糖的吸光度进行分析和预测。通过各项方差分析的F值判断各因素对响应值的影响程度,F值越大,各因素对甘蔗叶粗多糖提取量的影响越大,反之越小。由方差分析结果可知,4个因素对响应值影响的程度大小为B(超声温度)>D(超声时间)>C(超声功率)>A(液料比)。模型中的一次项(B、C、D)、二次项(A2、B2、C2、D2)以及交互项(AB、BD)的P值均小于0.01为极显著,一次项(A)的P值小于0.05影响显著,其余项影响均不显著。
2.3.2 交互作用分析
响应面图和等高线图见图8~图13。
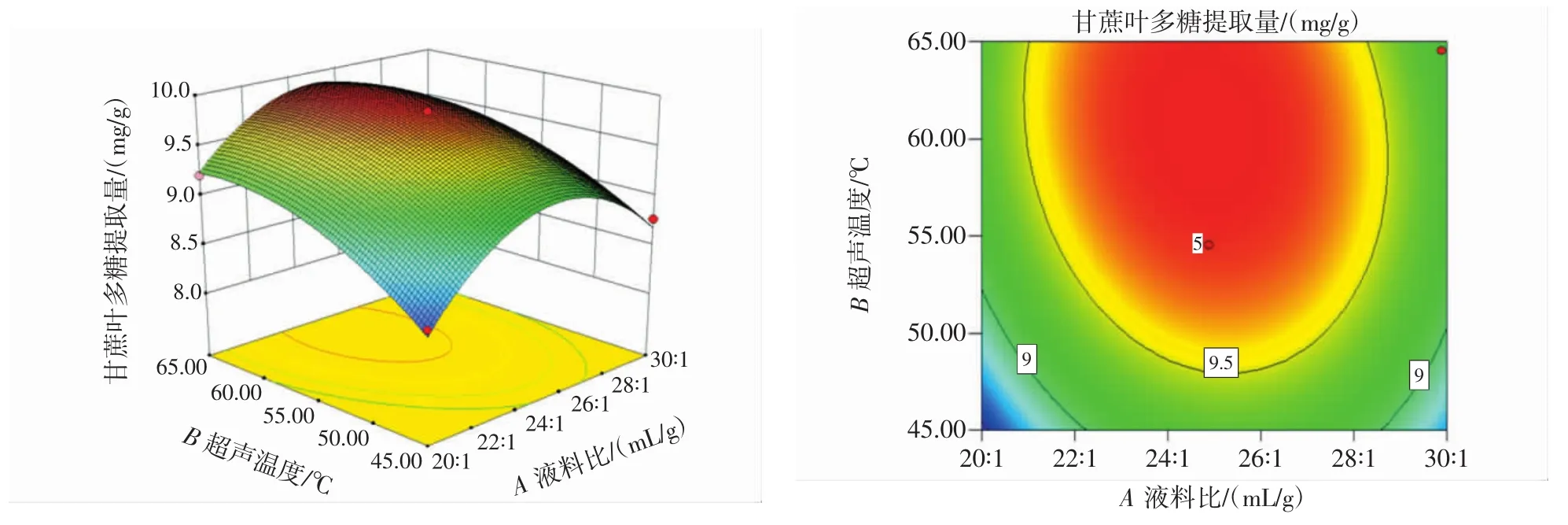
图8 液料比与超声温度的交互影响图Fig.8 Interaction diagram of liquid-material ratio and reaction temperature
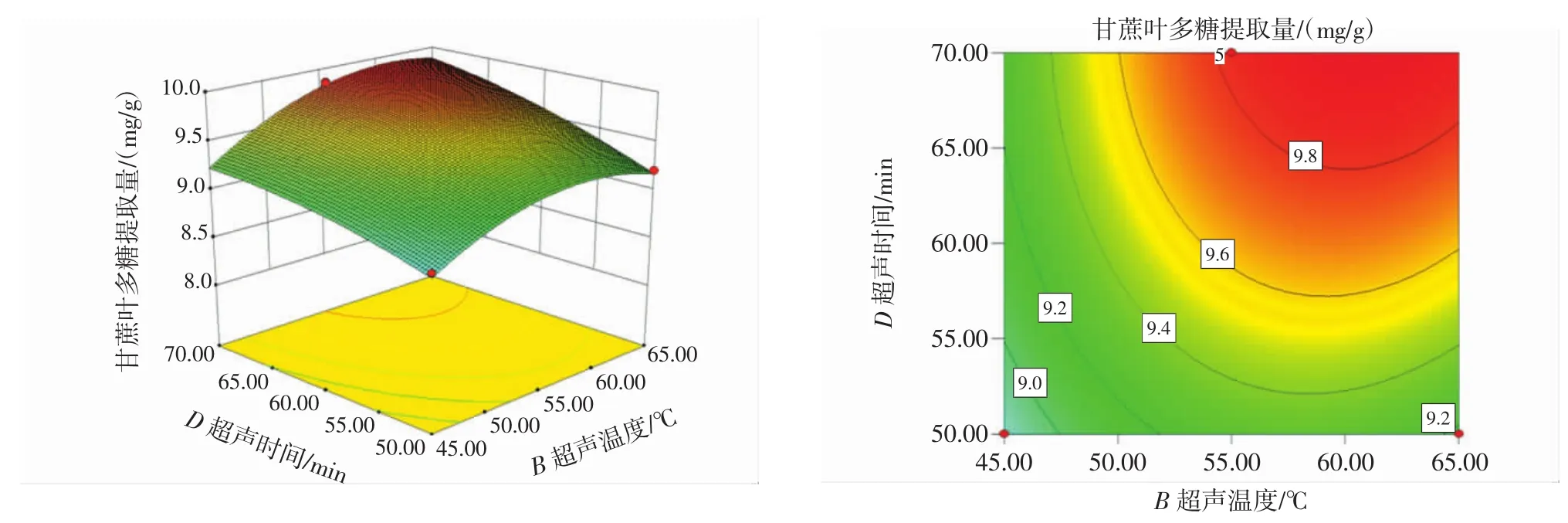
图9 超声温度与超声时间的交互影响图Fig.9 Interaction diagram of ultrasonic temperature and the ultrasonic time

图10 超声功率与液料比的交互影响图Fig.10 Interaction diagram of ultrasonic power and liquid-material ratio

图11 超声时间与液料比的交互影响图Fig.11 Interaction diagram of ultrasonic time and liquid-material ratio

图12 超声功率与超声温度的交互影响图Fig.12 Interaction diagram of ultrasonic power and ultrasonic temperature
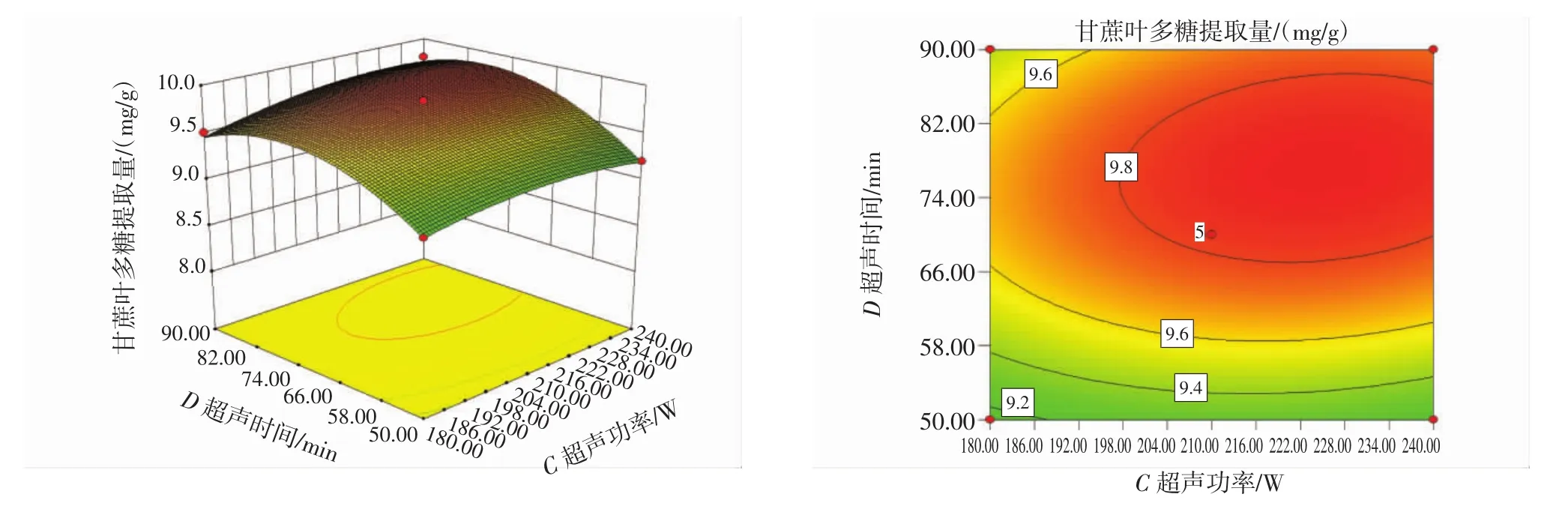
图13 超声时间与超声功率的交互影响图Fig.13 Interaction diagram of ultrasonic time and ultrasonic power
响应面中各因素的影响是交互的,其交互影响程度可以通过等高线的密集度和响应面的坡度来判断,等高线越密集、响应面越陡峭,交互作用越大;等高线间的间距越大,表示交互越小[27]。
由图8~图13可知,液料比与超声温度、超声温度与超声时间等高线呈椭圆形,说明各两因素之间有着极其显著的交互作用。
2.3.3 响应面优化及验证
根据回归方程和响应面分析,最佳提取条件为液料比 24.86 ∶1(mL/g)、超声功率 231.36 W、超声时间65.74 min、超声温度65.31℃,此时甘蔗叶多糖提取量为10.05 mg/g。为了验证模型方程的有效性,在调整后的条件下[液料比 25 ∶1(mL/g)、超声功率 230 W、超声时间66 min、超声温度65℃]进行了验证试验,甘蔗叶多糖的平均提取量为10.10 mg/g,与模型预测值相对误差仅为0.50%,证明该模型可靠,可用于优化甘蔗叶多糖的提取工艺。
2.4 甘蔗叶多糖的抑菌效果
不同浓度的甘蔗叶多糖对2种菌株的抑制效果如图14所示。

图14 甘蔗叶多糖对2种供试菌的抑菌效果Fig.14 Antimicrobial effect of polysaccharide from sugarcane leaves on 2 tested bacteria
抑菌圈直径越大抑菌效果越强,由图14可知,甘蔗叶多糖对2种供试菌(大肠杆菌和金黄色葡萄球菌)的抑菌圈直径均>6.0 mm,且同浓度的多糖溶液对大肠杆菌的抑菌圈直径小于金黄色葡萄球菌,表明甘蔗叶多糖对2种供试菌均具有抑制作用,其抑菌效果随着多糖浓度的增大而增强,且对金黄色葡萄球菌的抑制效果优于大肠杆菌。
图15是甘蔗叶多糖浓度为0.14 mg/mL时对大肠杆菌和金黄色葡萄球菌的抑菌效果图。

图15 2种供试菌的抑菌效果图Fig.15 Antibacterial effect of 2 tested bacteria
由图15可知,甘蔗叶多糖溶液对2种供试菌均具有较好的抑制作用,抑菌圈直径分别是9.27 mm和12.41 mm。
2.5 甘蔗叶多糖的自由基清除效果
甘蔗叶多糖对DPPH·和·OH的清除能力分别如图16、图17所示。

图16 甘蔗叶多糖对DPPH自由基的清除能力Fig.16 DPPH free radical scavenging ability of polysaccharide from sugarcane leaves
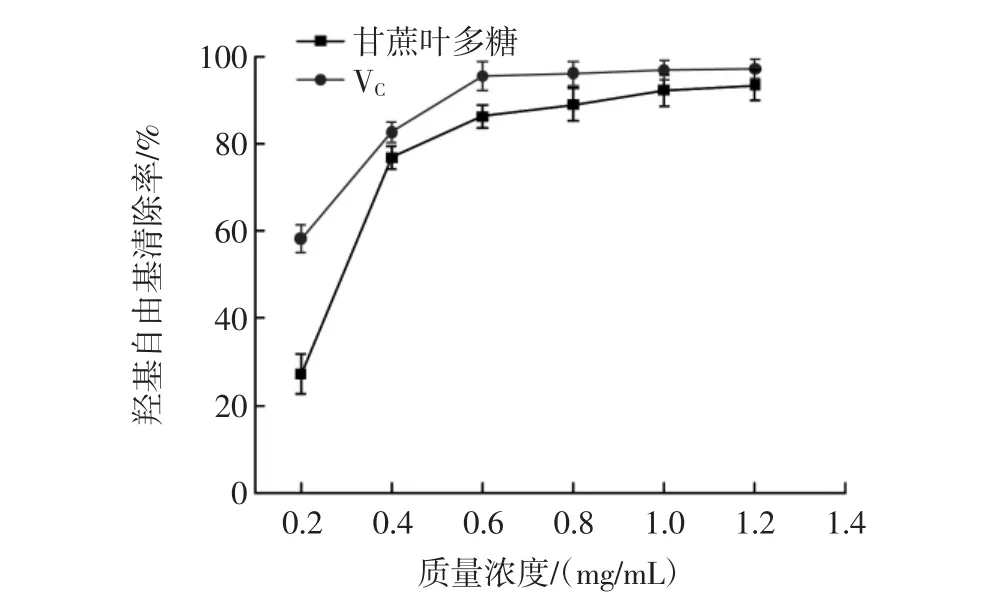
图17 甘蔗叶多糖对羟基自由基的清除能力Fig.17 The hydroxyl radical scavenging ability of polysaccharide from sugarcane leaves
由图16~图17可知,0.2 mg/mL~1.2 mg/mL 质量浓度范围内,甘蔗叶多糖和VC对DPPH·和·OH的清除率均随着浓度的增大而增强,呈良好的剂量依赖效应。当浓度为1.2 mg/mL时,甘蔗叶多糖对DPPH·和·OH的清除率达到最大值,分别为95.20%和93.46%,与VC的清除效率接近,表明其具有做抗氧化剂的潜力。
2.6 FT-IR分析
图18为甘蔗叶粉末经机械球磨预处理前后的红外光谱图。
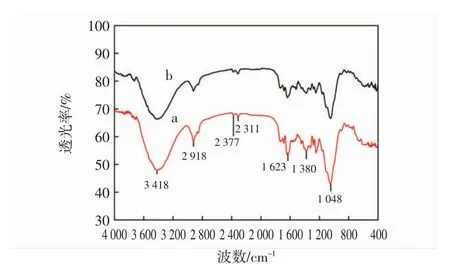
图18 甘蔗叶粉末球磨预处理前后的红外光谱图Fig.18 FT-IR spectra of sugarcane leaves before and after ball milling pretreatment
球磨处理前后甘蔗叶粉末的主要吸收峰基本一致,说明球磨处理后甘蔗叶粉末的主要官能团未发生改变。3 600 cm-1~3 000 cm-1处是分子内O-H的伸缩振动吸收峰[28],由图18可知,球磨预处理原料在此处的吸收峰的谱峰变宽,表明此处形成氢键的羟基增多,部分糖苷键发生了断裂[29]。
图19为甘蔗叶多糖的红外光谱图。
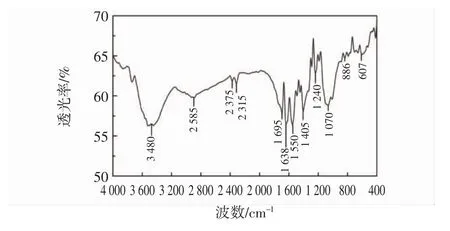
图19 甘蔗叶多糖的红外光谱图Fig.19 FTIR spectra of polysaccharide from sugarcane leaves
由图19可知,3 480 cm-1处为多糖O-H伸缩振动特征峰,1 638 cm-1和1 405 cm-1附近的吸收峰是甘蔗叶多糖结构中C=O的非对称伸缩振动和C-H的边角振动产生[30]。1 070 cm-1和1 241 cm-1的吸收峰表明甘蔗叶多糖中含有吡喃糖环,886 cm-1处出现吸收峰说明甘蔗叶多糖中含有β-糖苷键[31]。
3 结论
本文采用机械活化预处理结合超声辅助提取甘蔗叶粗多糖,研究研磨时间、研磨频率和球料比对甘蔗叶多糖提取量的影响,发现在球磨时间70 min、球磨频率20 Hz、球料比45∶1(g/g)条件下甘蔗叶多糖提取量最大。响应面优化超声法提取甘蔗叶多糖的最佳提取条件为液料比25∶1(mL/g)、超声功率230 W、超声时间66 min、超声温度65℃,此时多糖提取量为10.10 mg/g,较未超声处理提高18.54%,证明超声波能有效提高多糖的提取量。提取的甘蔗叶多糖具有良好的清除DPPH自由基、羟基自由基的能力,但略低于VC;体外抑菌实验结果表明,甘蔗叶多糖对大肠杆菌和金黄色葡萄球菌均具有抑制作用,对金黄色葡萄球菌的抑制效果优于大肠杆菌;红外谱图结果显示,甘蔗叶粉末经球磨处理后其化学结构基本未发生改变,提取的甘蔗叶多糖具有多糖类物质的特征吸收峰。
