反式肉桂酸对β-伴大豆球蛋白抗原性及结构的影响
2022-10-18席冠鹏布冠好常永锋王美月
席冠鹏,布冠好,常永锋,王美月
(河南工业大学粮油食品学院,河南 郑州 450001)
大豆,作为重要的粮食与油料作物,是人们主要的食物来源之一。大豆蛋白是从低温脱脂豆粕中提取的优质植物性蛋白,不仅含有丰富的营养,而且功能特性众多,在食品加工行业的应用极其普遍。随着应用范围的扩大,大豆过敏反应也增多,就婴幼儿而言,全世界对大豆过敏的婴幼儿占总数的1%~6%[1]。大多数情况下,大豆蛋白在人体内会引起由特异性免疫球蛋白 E(immunoglobulin E,IgE)介导的过敏反应,从而引发胃肠道紊乱,哮喘、剥落性皮炎等症状,甚至可以导致昏迷和死亡。β-伴大豆球蛋白既是贮藏蛋白,也是最早被发现和公认的致敏蛋白,约占大豆蛋白总量的30%[2]。有研究表明,β-伴大豆球蛋白的3个亚基(α'、α和β)均具有致敏性[3]。因此,寻找一种有效的方法来降低其过敏性极其重要。
如今,多酚是一类天然生物活性物质,存在广泛,如植物源性食品饮料、化妆品和营养保健品配方等。多酚是具有多个酚羟基的次生代谢物,基本碳架结构为2-苯基苯并吡喃,因此具有多种生物学特性,比如抗氧化、抗肿瘤、抗炎、抗菌等[4]。近年来,大分子与小分子间的相互作用逐渐引起了研究者的兴趣,尤其是作为食品重要成分的蛋白质和多酚。研究表明,多酚的加入可以改变大豆蛋白的结构、功能特性和营养价值[5]。有学者发现,茶多酚与大豆蛋白之间的氢键键合和疏水相互作用改变了大豆蛋白的二级结构,改善了蛋白溶液的溶解度、乳化稳定性等功能性[5]。花青素与大豆分离蛋白的结合诱导了蛋白二级、三级结构的变化,进而改善其稳定性和消化特性[6]。另外表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)可以降低大豆分离蛋白(soybean protein isolate,SPI)的致敏性并提高其抗氧化性[7]。
肉桂酸又称桂皮酸,是从肉桂皮分离出的有机酸,具有杀菌、抗氧化、抗炎等生理活性[8-9],可用于水果防腐保鲜,是无公害的环保防腐剂[10],也可用于蜜饯改善口感风味。Li等[11]发现肉桂酸使β-乳球蛋白的二级结构发生转变,并明显改变蛋白的表面疏水性。张驰等[12]研究不同pH值下反式肉桂酸(trans-cinnamic acid,TCA)对花生蛋白(peanut protein,PP)致敏性的影响。结果表明,TCA-PP复合物在pH11时致敏性明显下降。然而,关于肉桂酸对大豆蛋白过敏原的影响研究较少。因此,本文将探究TCA与β-伴大豆球蛋白的相互作用,并研究蛋白免疫活性及结构特性的变化,为建立有效的大豆蛋白过敏原脱敏方法提供理论依据。
1 材料与方法
1.1 材料与试剂
HRP-羊抗兔 IgG(A6154):美国 Sigma公司;兔抗β-伴大豆球蛋白血清:郑州大学实验动物中心自制;10条β-伴大豆球蛋白表位多克隆抗体(polyclonal antibody,PA):北京华大蛋白质研发中心有限公司;反式肉桂酸、牛血清白蛋白、单组分 3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)显色液:北京索莱宝科技有限公司;凝胶电泳试剂盒:武汉博士德生物工程有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS):上海源叶生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
GL-10000C高速冷冻离心机:上海安亭科学仪器厂;LRH-150F生化培养箱:上海一恒科技有限公司;LGJ-25C冷冻干燥机:北京四环科学仪器厂;DYY-6D型电泳仪:北京市六一仪器厂;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;Cary Eclipse荧光分光光度计:美国Varian公司;WQF-510傅里叶红外光谱仪、Multiskan FC型酶标仪:美国赛默飞世尔仪器有限公司;ZW-A微量振荡器:江苏省金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 β-伴大豆球蛋白的制备
参照Li等[13]的方法制备β-伴大豆球蛋白。
1.3.2 β-伴大豆球蛋白-TCA复合体系的构建
称取0.5 g β-伴大豆球蛋白溶解于50 mL磷酸盐缓冲溶液(pH7.0)备用。称取一定质量TCA溶解于一定体积蒸馏水中,稀释至6个不同浓度。等体积混合β-伴大豆球蛋白和各浓度TCA溶液,使TCA终浓度分别为 4、8、12、16、20、24 mmol/L。混匀后用 2 mol/L NaOH溶液调pH值至9.0,恒温25℃搅拌1 d,使TCA与蛋白发生相互作用。然后使用3 500 kDa透析袋于4℃生化培养箱中透析2 d,每4 h更换去离子水,去除未结合的TCA。最后冷冻干燥,获得复合物。
1.3.3 酶联免疫吸附试验法测定抗原性
采用间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法测定样品抗原性。蛋白样品用包被液(50 mmol/L、pH9.6)稀释至 0.5 μg/mL,酶标板中每孔包被100 μL,样品与兔抗血清(稀释比1∶3 200)1∶1等体积混合,4℃反应12 h。设置空白对照组(仅含有血清)。反应结束后,200 μL/孔加入洗涤液,用微量振荡器洗涤3 min后倾去孔内溶液并拍干,重复4次。洗涤后酶标板加入250 μL/孔封闭液,37℃孵育2 h后洗涤。随后,酶标板中加入100 μL/孔的兔抗血清,37℃孵育1 h后洗涤。洗涤后酶标板加入100 μL/孔的 HRP标记的羊抗兔 IgG(1∶20 000稀释),37℃孵育1 h后洗涤拍干。每孔加入100 μL的单组分TMB显色液,37℃孵育10 min后加入50 μL/孔的终止液(2 mol/L H2SO4)。最后用酶标仪测定450 nm和620 nm处的吸光度(A),吸光度A=A450-A620。样品的IgG结合能力用抑制率表示(%),计算公式如下。
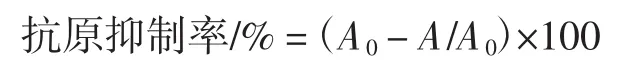
式中:A为样品吸光度;A0为空白对照组吸光度。抑制率越低表明样品的IgG结合能力越低,抗原性越低。
1.3.4 复合物与表位抗体的结合能力
采用间接ELISA法检测TCA对β-伴大豆球蛋白与表位抗体结合能力的影响。首先采用方阵滴定法确定β-伴大豆球蛋白与10个表位抗体的最适反应条件。用50 mmol/L碳酸盐缓冲溶液将β-伴大豆球蛋白稀释至合适浓度,100 μL/孔加入酶标板,4℃ 反应12 h。一定稀释度的表位抗体与样品蛋白溶液等体积混合后4℃反应12 h。后续试验步骤参照1.3.3的方法,抑制率与表位抗体的结合能力成正比。
1.3.5 SDS-PAGE测定分子量分布
参照Luo等[14]的方法对样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.6 紫外吸收光谱分析
样品溶液用磷酸盐缓冲溶液(pH7.4)稀释至0.2 mg/mL,使用紫外分光光度计扫描蛋白溶液。波长范围200 nm~400 nm,狭缝宽度2 nm,波长间隔为1 nm。
1.3.7 红外光谱分析
使用傅里叶变换红外光谱仪对样品进行分析,利用Peak fit 4.12软件拟合并计算样品二级结构的含量。
1.3.8 荧光光谱分析
将样品浓度配制成0.2 mg/mL,在激发波长280nm,发射波长300 nm~500 nm条件下测定其内源荧光。
用磷酸盐缓冲溶液(10 mmol/L、pH7.4)稀释样品至5 mg/mL,再稀释成6个梯度。样品溶液(4 mL)与ANS溶液(80 mmol/L、20 μL)混匀。测定荧光强度(390 nm激发波长及470nm发射波长)来进行表面疏水性测定。用荧光强度对蛋白质量浓度拟合所作曲线的初始斜率表示表面疏水性指数。
1.3.9 数据分析
采用SPSS 2.0和Origin 2021软件进行统计分析及作图,数据用平均值±标准差表示。
2 结果与分析
2.1 TCA对β-伴大豆球蛋白抗原性的影响
不同浓度TCA对β-伴大豆球蛋白复合物的抗原抑制率影响见图1。

图1 TCA不同浓度对β-伴大豆球蛋白抗原性的影响Fig.1 Effects of different amounts of TCA on the antigenicity of β-conglycinin
由图1可知,不同浓度TCA与β-伴大豆球蛋白结合后均降低了蛋白抗原性。β-伴大豆球蛋白在TCA浓度为4 mmol/L时显示出最低的抗原性(46.62%),与未处理蛋白(76.15%)相比,降低了38.78%,且随着TCA浓度的增加,蛋白抗原性并没有进一步降低反而有所升高,这可能是蛋白与TCA结合后,自身结构发生了改变,导致原来在空间内部的抗原表位暴露,抗原性上升。
2.2 TCA对β-伴大豆球蛋白与表位抗体结合能力的影响
不同TCA浓度下β-伴大豆球蛋白与表位抗体的结合能力见图2。


图2 不同TCA浓度下β-伴大豆球蛋白与表位抗体的结合能力Fig.2 The binding ability of β-conglycinin with epitope antibodies at different concentrations of TCA
为进一步研究TCA对β-伴大豆球蛋白抗原表位的影响,使用10种主要线性表位多克隆抗体(polyclonal antibody,PA)来评估蛋白与表位抗体结合能力变化。由图2可知,与未处理β-伴大豆球蛋白相比,与TCA相互作用后β-伴大豆球蛋白与表位多克隆抗体PA-1、PA-6的结合能力增强,而与PA-2、PA-3、PA-4、PA-5、PA-9和PA-10的结合能力受到不同程度的抑制,当TCA浓度为4 mmol/L时,蛋白与PA-2和PA-9的结合能力抑制最为明显。相反,随着TCA浓度的增加,β-伴大豆球蛋白与PA-1的结合能力显著增强。这可能是因为TCA的添加使β-伴大豆球蛋白结构发生变化,其构象表位被破坏,但同时会暴露出新的线性抗原表位。
2.3 复合物的分子量分布
图3为不同浓度TCA与β-伴大豆球蛋白复合物的SDS-PAGE电泳图。

图3 TCA不同浓度复合物的SDS-PAGE图谱Fig.3 SDS-PAGE of complexes with different additions of TCA
SDS-PAGE可以看出蛋白的分子量分布,从图3可以看出,α'亚基(约 71 kDa)和α亚基(约67 kDa)随着TCA浓度的增加,复合物的亚基条带颜色减弱,β亚基(约50 kDa)没有明显变化,而在55 kDa处条带颜色加深。李杨等[15]研究发现,花青素添加浓度较小时,SPI存在两条明显的亚基条带(63 kDa~75 kDa和20 kDa~35 kDa),随着花青素浓度的增加,条带逐渐消失,而出现超高分子质量亚基与色散带,在TCA浓度为1 mg/mL时该现象最明显,超高分子量亚基的出现可能是蛋白质不同亚基之间发生聚合形成大分子亚基;而在Rawel等[16]的试验结果中未观察到碱性多肽亚基(20 kDa)的减少,这可能是因为未对多酚添加质量浓度进行探究。
2.4 TCA对β-伴大豆球蛋白紫外吸收光谱的影响
不同TCA浓度下β-伴大豆球蛋白的紫外吸收光谱见图4。

图4 不同TCA浓度下β-伴大豆球蛋白的紫外吸收光谱Fig.4 Ultraviolet absorption spectra of β-conglycinin at different concentrations of TCA
紫外吸收光谱能够反映蛋白质三级结构的变化[17]。紫外吸收光谱中β-伴大豆球蛋白的最大吸收波长(λx)在 270 nm左右,主要取决于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基的紫外吸收特性。由图4可知,与未处理蛋白相比,TCA的添加并没有使β-伴大豆球蛋白紫外吸收光谱的λx发生明显变化。此外,随着TCA的添加,β-伴大豆球蛋白的吸光度均有增加,这可能是由于复合物蛋白的空间结构打开,芳香族氨基酸暴露出来,Trp、Tyr和Phe的含量增多[18]。
2.5 TCA对β-伴大豆球蛋白红外吸收光谱的影响
不同TCA浓度下β-伴大豆球蛋白的傅里叶红外光谱见图5。

图5 不同TCA浓度下β-伴大豆球蛋白的傅里叶红外光谱Fig.5 Fourier transform infrared spectroscopy of β-conglycinin at different concentrations of TCA
通过傅里叶红外光谱法研究TCA与β-伴大豆球蛋白复合物,并分析对蛋白二级结构的影响。蛋白特征吸收区为酰胺I带(1 700 cm-1~1 600 cm-1)和酰胺II带(1 550 cm-1~1 530 cm-1),主要由 C=O 伸缩振动引起的,可能和N-H弯曲、C-N拉伸有关[19-20]。如图5所示,添加TCA后,β-伴大豆球蛋白的酰胺I、II带位置均未发生偏移,但其吸光度有所变化,可能是蛋白结构改变造成的[21]。复合物二级结构的定量分析结果见图6。

图6 不同TCA浓度下β-伴大豆球蛋白的二级结构含量图Fig.6 Secondary structure content of β-conglycinin at different concentrations of TCA
在β-伴大豆球蛋白中β-折叠是主要的二级结构,添加TCA后,二级结构中β-折叠含量减少,β-转角、无规则卷曲含量增加。在蛋白与多酚的相互作用中,相关蛋白质二级结构的变化规律的结论不一。在花生蛋白与咖啡酸、槲皮素相互作用中,咖啡酸、槲皮素导致花生蛋白中的无规则卷曲含量减少,使花生蛋白质的构象更加致密[12]。这可能是由于多酚与蛋白质复合物的结构变化及两者的结合方式不同,从而导致二级结构发生了不同的变化。
2.6 TCA对β-伴大豆球蛋白荧光光谱的影响
2.6.1 TCA对β-伴大豆球蛋白内源荧光的影响
不同TCA浓度下β-伴大豆球蛋白的荧光光谱见图7。

图7 不同TCA浓度下β-伴大豆球蛋白的荧光光谱Fig.7 Fluorescence spectra of β-conglycinin at different concentrations of TCA
荧光光谱法是研究受体与配体相互作用的常见方法,蛋白质所具有的固有发射荧光主要来自于Trp与Tyr残基[22]。且它们的荧光发射光谱会因处于不同的溶剂条件而发生改变[23]。如图7所示,TCA与β-伴大豆球蛋白结合使得β-伴大豆球蛋白的荧光强度下降,这表明TCA对β-伴大豆球蛋白具有荧光猝灭作用,并且TCA添加浓度越高,β-伴大豆球蛋白的荧光猝灭现象越明显。说明猝灭效果与TCA的浓度有较强的相关性[24]。此外,在复合物中观察到荧光光谱轻微的红移,因此认为TCA能够使蛋白质主肽链得到舒展,空间结构破坏,使得掩埋于蛋白质内部的Trp与Tyr残基暴露出来。
2.6.2 TCA对β-伴大豆球蛋白表面疏水性的影响
图8为不同浓度TCA对β-伴大豆球蛋白表面疏水性的影响。

图8 不同浓度TCA对β-伴大豆球蛋白表面疏水性的影响Fig.8 Surface hydrophobicity of the interaction between different concentrations of TCA and β-conglycinin
由图8可知,TCA浓度越大,表面疏水性越低,在TCA添加浓度为24 mmol/L时急剧下降。这表明β-伴大豆球蛋白中TCA的引入使其表面呈现出亲水性,这也进一步说明TCA与β-伴大豆球蛋白结合使β-伴大豆球蛋白的结构发生了改变。蛋白表面疏水性下降可能是在碱性条件下,TCA被氧化形成醌,醌与蛋白多肽链上的Trp与Tyr残基发生亲核反应,从而减少了蛋白多肽链上的疏水基团,因而呈现出更加亲水的特征[25]。另外,由于TCA的添加改变了β-伴大豆球蛋白的构象,一定程度上使得掩埋于蛋白内部的亲水区域暴露,这可能也是复合蛋白表面疏水性降低的一个原因[26]。同样的结果在豌豆分离蛋白和绿原酸的相互作用中被发现,绿原酸与豌豆分离蛋白的交联使得蛋白的表面疏水性下降[27]。
3 结论
本试验研究碱性条件下不同TCA浓度对β-伴大豆球蛋白免疫特性及结构的影响。结果表明,在碱性条件下TCA降低了蛋白的抗原性,明显改变了蛋白质的二、三级结构及表面疏水性。本研究为大豆蛋白过敏原的脱敏提供方法,为有效降低食品中大豆制品的致敏性提供理论依据。
