吲哚丙酸对葡聚糖硫酸钠诱导急性溃疡性结肠炎小鼠的影响
2022-10-10邱宇轩张苏玥杜欣键
邱宇轩,廖 沙,张苏玥,杜欣键,张 丹,梁 峰
目前溃疡性结肠炎(UC)的治疗药物主要包括类固醇、免疫调节剂等,但临床疗效参差不齐,部分患者后期需要手术干预[1-2]。因此UC治疗新药的研发和应用具有重要意义。吲哚丙酸(IPA)是色氨酸经过肠道菌群代谢后的产物,研究发现其在抗癌[3]、预防糖尿病[4-6]、减轻中枢神经系统炎症反应[7]、预防辐射损伤[8]等方面均有作用。但IPA是否有防治UC的作用尚不清楚。核转录因子κB(NF-κB)在UC的发病过程中起关键作用,活化的NF-κB能促进下游炎性细胞因子基因的转录,进一步放大炎症级联效应。本研究采用葡聚糖硫酸钠(DSS)构建急性UC小鼠模型,通过小鼠疾病活动指数(DAI)、结肠组织病理评分、血清炎性指标、结肠组织炎性因子测定,探讨IPA对急性UC小鼠的防治作用;并通过检测NF-κB信号通路中关键分子NF-κB p65及磷酸化NF-κB p65(p-NF-κB p65)蛋白表达情况,探究IPA是否通过抑制NF-κB p65磷酸化而发挥对急性UC小鼠的保护作用。
1 材料与方法
1.1材料
1.1.1实验动物:SPF级6~8周雄性C57BL/6小鼠60只[北京维通利华公司,实验动物许可证号:SCXK(京)2016-0006],体质量18~21 g。适应性饲养7 d,保证小鼠自由饮食、饮水,饲养环境温度(23±1)℃,相对湿度为50%~60%。
1.1.2主要试剂与仪器:IPA(美国sigma公司),DSS(上海源叶科技有限公司),髓过氧化物酶(MPO)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)酶联免疫吸附试验(ELISA)试剂盒(美国 abcam公司),BCA蛋白浓度测定试剂盒、兔抗GAPDH单克隆抗体、兔抗NF-κB单克隆抗体、兔抗p-NF-κB单克隆抗体、兔二抗(美国Cell Signaling Technology公司)。
1.2实验方法
1.2.1小鼠分组与处理:将小鼠随机分为对照组、DSS模型组(自由饮用3%DSS溶液7 d)和低、中、高剂量IPA组,每组12只。不同剂量IPA组(10、20、40 mg/kg)于DSS造模前2 d开始每日按各组剂量灌胃,直至处死小鼠。各组小鼠均在DSS造模第7日处死。
1.2.2一般情况和DAI:每日定时观察小鼠精神状态、体质量变化、粪便性状及便血情况等,根据体质量下降、大便性状和便血状况评定DAI,见表1。

表1 疾病活动指数评分标准
1.2.3结肠长度:处死小鼠后,打开腹腔,分离结肠系膜,获得盲肠至肛门全长,测量肛门至盲肠末端的长度。
1.2.4病理学评分:处死小鼠后,在距离肛门2 cm处取长约1 cm的结肠组织放于10%甲醛溶液中固定,石蜡包埋后行HE染色,光镜下观察并参照文献[9]行病理学评分。病理学评分为炎性浸润评分和组织损伤评分之和,炎性浸润评分:未见大量炎性细胞浸润计为0分,炎性细胞浸润局限于黏膜层计为1分,炎性细胞浸润黏膜下层计为2分,炎性细胞浸润肠壁全层计为3分;组织损伤评分:肠壁形态正常计为0分,散在的黏膜层损伤计为1分,黏膜层局灶性溃疡计为2分,广泛黏膜层损伤、深达黏膜下层计为3分。
1.2.5ELISA检测血清MPO:取各组小鼠外周血,根据ELISA试剂盒说明书测定MPO含量。
1.2.6ELISA检测结肠组织TNF-α、IL-1β、IL-6及MPO:制备各组小鼠结肠组织匀浆,通过BCA法测定各样本蛋白总量,再用对应的ELISA试剂盒测定各蛋白因子含量。
1.2.7Western blot法检测NF-κB p65、p-NF-κB p65蛋白表达:取各组小鼠结肠组织,加入蛋白裂解液,12 000×g离心20 min取上清液,采用BCA法测定蛋白浓度。10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,将蛋白转至聚偏二氟乙烯膜,室温封闭1 h,一抗4 ℃孵育过夜,TBST洗膜3次,置于二抗中室温孵育1 h。增强化学发光法显影后,采用Eblot凝胶成像系统照相并分析。
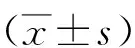
2 结果
2.1各组小鼠DAI、结肠长度及结肠组织病理学评分比较 与对照组比较,DSS模型组DAI、结肠组织病理学评分明显升高,结肠长度明显缩短(P<0.01);与DSS模型组比较,中、高剂量IPA组小鼠DAI降低,IPA各剂量组结肠长度均增加、结肠组织病理学评分降低(P<0.05,P<0.01)。见表2。
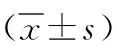
表2 各组小鼠DAI、结肠长度和病理学评分的影响
2.2各组小鼠结肠组织病理学表现 对照组结肠组织各层结构完整,基本无炎性细胞浸润。与对照组比较,DSS模型组在结肠组织各层均有大量炎性细胞浸润,主要为中性粒细胞和淋巴细胞,大部分黏膜结构消失,管壁结构不完整。与DSS模型组比较,IPA各剂量组炎性细胞浸润主要局限在黏膜层,上皮细胞大部分完整。见图1。

图1 各组小鼠结肠组织病理学表现(HE×100)
2.3各组小鼠血清MPO水平比较 血清MPO水平对照组为(160.91±23.08)pg/ml,DSS模型组为(350.82±22.53)pg/ml,低剂量IPA组为(288.11±36.49)pg/ml,中剂量IPA组为(252.33±56.31)pg/ml,高剂量IPA组为(267.55±44.15)pg/ml。DSS模型组MPO水平较对照组显著升高(P<0.05)。与DSS模型组比较,IPA各剂量组血清MPO水平均降低(P<0.05)。
2.4各组小鼠结肠组织TNF-α、IL-1β、IL-6及MPO水平比较 DSS模型组结肠组织TNF-α、IL-1β、IL-6及MPO水平较对照组显著升高(P<0.01)。与DSS模型组比较,IPA各剂量组结肠组织TNF-α、IL-1β、IL-6及MPO水平均降低(P<0.05,P<0.01)。见表3。
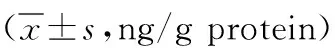
表3 各组小鼠结肠组织TNF-α、IL-1β、IL-6及MPO水平比较
2.5各组小鼠结肠组织NF-κB p65、p-NF-κB p65蛋白含量比较 与对照组比较,DSS模型组p-NF-κB p65/NF-κB p65比值显著升高(P<0.01);与DSS模型组比较,IPA各剂量组p-NF-κB p65/NF-κB p65比值均显著降低(P<0.05)。见图2。

图2 Western blot检测各组小鼠结肠组织NF-κB p65、p-NF-κB p65蛋白表达
3 讨论
本研究发现IPA干预可降低DSS诱导急性UC小鼠模型DAI评分,说明IPA对急性UC小鼠的临床症状有明显改善作用。DSS造模成功后,小鼠结肠组织中TNF-α、IL-6、IL-1β水平均明显升高。IL-1β是早期炎症反应标志物,能进一步引起IL-6、TNF-α等多种炎性因子产生[10]。大量TNF-α破坏细胞紧密连接,增加肠道上皮通透性,促进炎性肠病的发展[11]。而IL-6是单核巨噬细胞所产生的重要促炎细胞因子,可促进中性粒细胞向炎性部位浸润,并使下游转录激活因子3磷酸化,引起组织局部免疫功能失调[12]。本研究IPA各剂量组结肠组织中TNF-α、IL-6、IL-1β表达水平明显降低,表明IPA可以通过抑制促炎细胞因子表达从而减轻结肠的炎症反应。MPO主要由中性粒细胞产生,可间接反映组织炎症严重程度[13]。本研究发现IPA能够降低DSS造模后小鼠血清及结肠组织MPO水平,说明IPA能一定程度减轻UC的局部和全身炎症反应。
从病理结果来看,DSS造模后小鼠结肠黏膜层完整性被破坏,部分肠道腺体消失,同时伴随以中性粒细胞和淋巴细胞为主的大量炎性细胞浸润,并可见隐窝脓肿出现。而当IPA干预后,小鼠结肠黏膜层结构基本恢复完整,炎性细胞浸润明显减少,与MPO减少的结果相一致,同时杯状细胞较DSS造模组明显增加。
NF-κB是参与炎症反应相关基因转录调控的核转录因子,p65和p50亚单位组成的异二聚体是其发挥作用的常见形式。p-NF-κB p65具有显著的促炎特性,可促进多种炎性因子基因的转录,在UC发病中起关键作用。本研究结果发现,IPA干预后p-NF-κB p65比例减低,表明IPA可抑制NF-κB信号通路中NF-κB p65的磷酸化,发挥其对UC的保护作用。
综上,IPA可降低DSS诱导急性UC小鼠结肠组织中炎性细胞因子含量,减少DSS造成的组织损伤,作用机制可能与抑制NF-κB p65磷酸化有关。
