术前超声联合免疫组织化学预测甲状腺乳头状癌颈部中央区淋巴结转移
2022-10-05王福民梁振威邵玉红
王福民,梁振威,陈 蕾,邵玉红
(北京大学第一医院超声医学科,北京 100034)
近年来,甲状腺乳头状癌(papillary thyroid carcinoma, PTC)检出率不断升高[1-2];其进展较慢,但颈部淋巴结转移率较高[3],其中中央区淋巴结转移(central lymph node metastasis, CLNM)较隐匿而难以检出,故术中须常规进行中央区淋巴结清扫,导致神经损伤、甲状旁腺功能减退等并发症发生率增加[4]。术前预测PTC颈部CLNM对选择手术方式至关重要,但既往多仅根据影像学表现制定手术方案。近年研究[5]发现肝细胞癌免疫组织化学(简称免疫组化)检测结果与其进展及预后密切相关。本研究观察术前超声联合免疫组化预测PTC颈部CLNM的价值。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2020年12月153例于北京大学第一医院接受甲状腺癌根治+中央区淋巴结清扫术的PTC患者,男47例、女106例,年龄16~81岁、平均(43.1±11.7)岁;其中19例为多发、134例为单发PTC,对存在多发病灶者也择其最大者纳入研究;根据术后病理示有无颈部CLNM分为CLNM阳性组(n=75)和CLNM阴性组(n=78):CLNM阳性组男27例、女48例,年龄16~81岁、平均(39.7±11.2)岁;CLNM阴性组男20例、女58例,年龄24~68岁、平均(46.4±11.3)岁。纳入标准:①术前经穿刺活检(core needle biopsy, CNB)病理及免疫组化检测诊断PTC;②术前超声资料完整;③此次术前未曾接受甲状腺手术或核素治疗等;④未合并甲状腺以外的其他恶性肿瘤。检查前由患者、家属或监护人签署知情同意书。
1.2 仪器与方法 采用Philips Epiq 7及Aplio i800彩色多普勒超声诊断仪,线阵探头,频率5~12 MHz。嘱患者仰卧、充分暴露颈部,对双侧甲状腺进行多切面扫查,记录病灶最大径、回声(与颈前肌对比)、边缘、微钙化、纵横比及与被膜的关系;扫查颈部淋巴结,观察有无皮髓质结构不清、内部微钙化及皮质不均匀增厚等。
1.3 CNB 嘱患者仰卧、充分暴露颈部,采用Aplio i500彩色多普勒超声诊断仪(线阵探头,频率7~12 MHz)扫查颈部拟穿刺病灶周围结构,并规划进针路径。常规消毒、铺巾,于拟穿刺处注射2%利多卡因进行局部麻醉;于超声引导下采用18G穿刺针穿刺目标病灶,到达病灶边缘后扣动扳机,确认穿刺针位于病灶内之后取出穿刺针;重复取材,取出2~3条组织条,放入10%甲醛溶液中固定并送检。嘱患者压迫穿刺点30 min,无不良反应即可离开。
1.4 统计学分析 采用SPSS 21.0统计分析软件。采用χ2检验比较计数资料。建立logistic模型,行Hosmer-Lemeshow检验,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),并以DeLong检验进行比较。P<0.05为差异有统计学意义。
2 结果
组间患者年龄、病灶最大径、微钙化、纵横比、紧邻被膜及HBME-1表达水平差异均有统计学意义(P均<0.05),见表1及图1、2。
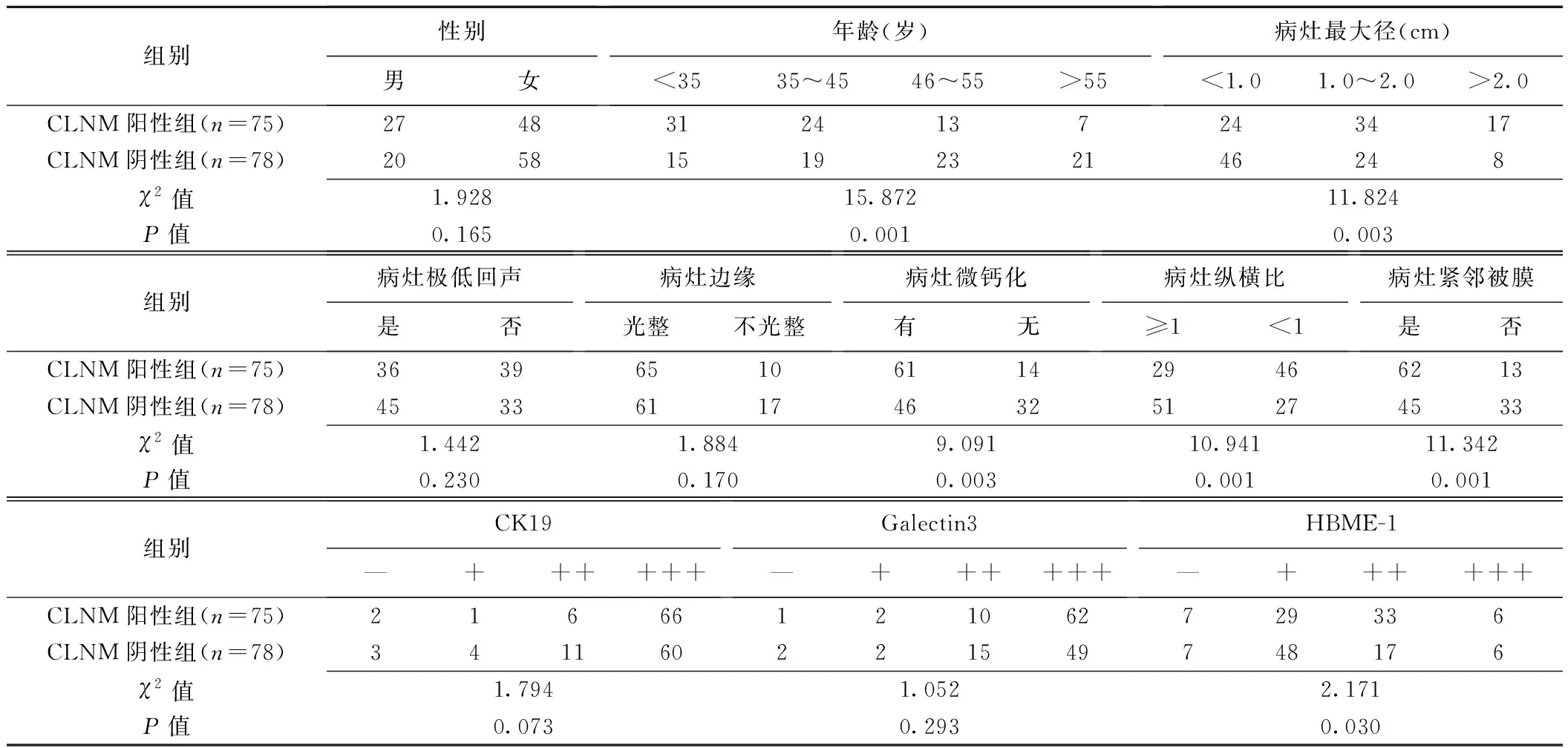
表1 颈部CLNM与无CLNM的PTC患者常规超声及免疫组化结果对比(例)
因病灶纵横比系根据其最大径计算得出,且二者组间差异均有统计学意义,故将纵横比除外,而将包括最大径在内的其他组间差异有统计学意义的因素纳入logistic回归分析,结果显示PTC患者年龄≤45岁、病灶最大径>2.0 cm、微钙化、紧邻被膜及HBMI-1(++/+++)均为颈部CLNM的危险因素(表2);据此建立logistic模型1,Hosmer-Lemeshow检验示χ2=8.482、P=0.388,其用于预测PTC颈部CLNM的AUC为0.823[95%CI(0.785,0.888)](图3);针对除HBMI-1(++/+++)之外的上述因素建立的logistic模型2预测PTC颈部CLNM的AUC为0.802[95%CI(0.734,0.871)];2个模型的AUC差异无统计学意义(Z=1.479,P=0.139),但模型1的AUC略大于模型2。
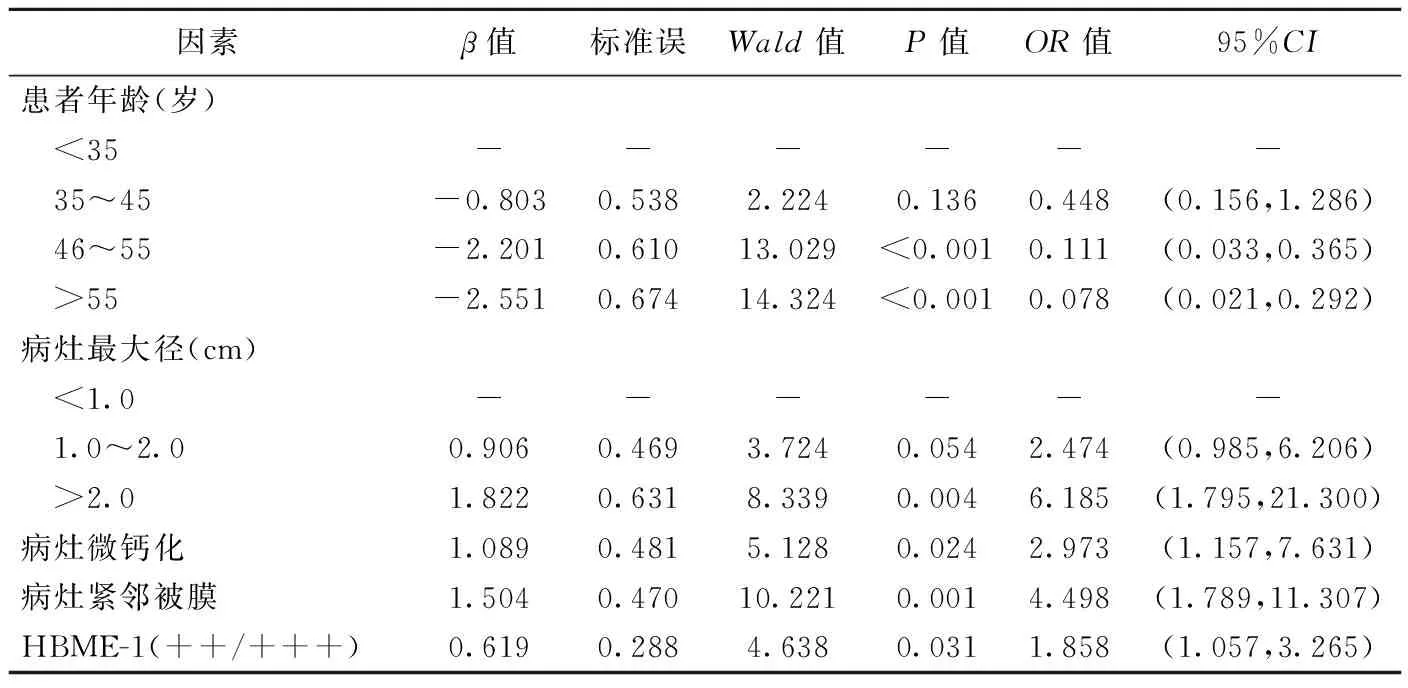
表2 PTC颈部CLNM的多因素logistic回归分析结果
3 讨论
高频超声为检出PTC的主要手段,但对颈部淋巴结转移,尤其颈部中央区淋巴结转移的敏感度(10.5%~38.0%)较低[6]。本研究综合分析PTC患者术前超声表现及免疫组化结果,旨在为临床制定治疗计划提供参考,减少不必要的手术损伤。
本研究logistic分析结果显示,46~55岁及>55岁PTC患者发生颈部CLNM的风险分别为<35岁者的0.111倍和0.078倍,而35~45岁与<35岁PTC患者发生颈部CLNM风险的差异无统计学意义,与既往研究[7-8]结果类似; 最大径>2.0 cm的PTC更易出现颈部CLNM,可能原因在于病灶大小代表其生长速度及发病时间,较大病灶生长速度快、患者发病时间长,更易发生颈部CLNM;病灶微钙化及紧邻被膜亦为PTC颈部CLNM的危险因素,与既往研究[9-10]结果类似,微钙化为细胞供血不足、坏死后钙盐沉积所致,提示病灶生长较快、侵袭性强,更易发生淋巴结转移,而紧邻被膜病灶更易突破被膜并通过周围组织内的淋巴管发生转移。SUN等[11]认为男性为PTC颈部CLNM的危险因素(OR=1.974);而本研究中CLNM阳性组与CNLM阴性组患者性别差异无统计学意义,有待进一步观察。另外,既往研究[12]认为病灶纵横比≥1为PTC颈部CLNM的危险因素,但该研究仅分析了甲状腺微小乳头状癌。本研究CNLM阴性组纵横比≥1病灶占比明显高于CLNM阳性组。
免疫组化结果为评价肝细胞癌、直肠癌及乳腺癌等恶性肿瘤复发及转移的重要参数[5],但目前少见将其用于PTC颈部淋巴结转移的相关研究。HBME-1是间皮细胞膜抗原成分,临床常用于诊断胰腺癌、乳腺癌及间皮细胞癌等,近年来亦用于辅助鉴别诊断甲状腺恶性肿瘤[13]。DENCIC等[14]发现HBME-1表达水平与PTC临床分期相关;有学者[12]提出Ki-67及p53等免疫组化指标亦与PTC患者颈部淋巴结转移相关。本研究结果显示,CLNM阳性与CNLM阴性患者HBME-1表达水平存在显著差异, HBMI-1(++/+++)为PTC颈部CLNM的危险因素。
本研究的主要局限性:①为回顾性研究;②纳入免疫组化指标有限,部分患者无Ki-67及p53等反映细胞增殖及转化的相关指标检测结果;③未分析患者预后。
综上所述,术前超声联合免疫组化可预测PTC患者颈部CLNM;患者年龄≤45岁、病灶最大径>2.0 cm、微钙化、紧邻被膜及HBMI-1(++/+++)为PTC颈部CLNM的危险因素。