基于网络药理及分子对接分析《普济方》痤疮外治古方特色角药作用机制
2022-09-29张益生邓诗航张君冬李宗友宋坪
张益生,邓诗航,张君冬,李宗友,宋坪
1.中国中医科学院中医药信息研究所,北京 100700;2.中国中医科学院广安门医院,北京 100053;3.国家中医药管理局监测统计中心,北京100027
痤疮为临床常见的损美性皮肤病,以黑白粉刺、丘疹、脓疱为主要临床表现,多发于青春期。西医学认为,毛囊、皮脂腺等皮肤附属器易在激素影响下发生皮脂腺发育、分泌增加,毛囊分化、角化过度,痤疮丙酸杆菌定殖、炎症及宿主免疫反应,故治疗以对抗雄激素作用、抑制皮脂腺活性、改善角化过度、缓解炎症反应,但疗效及安全性存在较大争议。中医古籍所载痤疮方药多作外治之用。明代皮外科发展迅速,至清代颠覆了“详于寒而略于温”的主流学术思想,痤疮外治法亦从多用温热向寒凉过渡。《普济方》收载美容方达1 426首,其痤疮外治遵《素问·生气通天论篇》“劳汗当风,寒薄为皶,郁乃痤”病机,运用辛温风药发越郁遏不正之气,与后世苦寒清解之法有别。前期研究将《普济方》87首痤疮外治古方共164味药聚为3类,分别与其所载白蔹膏方(白蔹、白石脂、杏仁)、白芷膏方(白芷、白附子、川芎、防风、丁香、芜荑、木兰皮、细辛、藁本、零陵香、松花粉、麝香、熊油)、疗年少气冲面生疱疮方(猪脂、铅粉、水银)相仿,分别为治疗痤疮体虚感邪证、外感风热证、血热郁滞证的代表方剂。风药指“味辛性轻之品”,其性轻扬升散,具生长、升发、条达、舒畅特性,可破痤疮怫郁之格。白芷、川芎、白附子三风药关联性居首,为《普济方》痤疮外治古方的特色角药。本研究运用网络药理学方法、分子对接技术分析特色角药治疗痤疮的作用机制,以期挖掘古方精粹,为其临床应用提供参考。
1 资料与方法
1.1 药物有效成分及其靶点获取
通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)、TCMID(http://www.megabionet.org/tcmid/),分别以“白芷”“川芎”“白附子”为检索词进行检索,获得特色角药化学成分,并以类药性(DL)≥0.18为条件筛选有效成分,通过TCMSP预测有效成分作用靶点,利用UniProt数据库(https://www.uniprot.org/)注释靶点基因,得到对应的蛋白质全称及其标准化缩写。
1.2 疾病靶点获取
以“acne”为检索词,分别检索DisGeNET(https://www.disgenet.org/)、DrugBank(https://go.drugbank.com/)、GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)数据库,以物种“Homo sapiens”为筛选条件,获取痤疮疾病靶点。
1.3 特色角药治疗痤疮潜在靶点获取
运用R语言绘制韦恩图,对特色角药有效成分作用靶点及痤疮靶点进行比对,获得交集靶点,即特色角药治疗痤疮的潜在靶点。
1.4 特色角药调控网络构建
将特色角药有效成分靶点导入Cytoscape3.8.2 软件,实现特色角药调控网络的拓扑结构化,按药物-化合物-靶点分布构象进行布局,设置节点大小按连接度(Degree)做连续映射。基于节点大小及Network-Analyser功能展示的节点信息,找出特色角药的关键化合物及其作用靶点。
1.5 GO-BP和KEGG通路富集分析
运用R 语言,通过Bioconductor 数据库(http://www.bioconductor.org/)对交集靶点进行GO-BP及KEGG通路富集分析。选取<0.05的条目,分别绘制GO-BP及KEGG通路富集结果条形图,找出交集靶点所涉及的主要生物学过程及通路。
1.6 蛋白相互作用网络构建及关键靶点筛选
通过STRING(https://www.string-db.org/)数据库对交集靶点进行蛋白相互作用(PPI)网络分析,以物种“Homo sapiens”、最低相互作用得分≥0.4为筛选条件,以tsv格式导出数据,导入Cytoscape3.8.2,构建PPI网络,保留Degree≥5的节点。设置节点大小按Degree值做连续映射,进行PPI分析。利用MCODE插件对PPI网络进行聚类,对网络中最密集、最重要的关键靶点进行识别,以Degree Cutoff=8、Node Score Cutoff=0.2、K-Core=2、Max.Depth=100 为筛选参数,获得关键靶点。
1.7 药物-化合物-关键靶点-通路网络构建
利用Cytoscape3.8.2软件构建拓扑网络,按药物-化合物-关键靶点-通路的节点分布构象对网络进行布局,删除与关键靶点无关的化合物、靶点、通路节点,设置节点大小按照Degree值做连续映射。基于节点间的边及节点大小,找出特色角药的主要调控途径。
1.8 分子对接分析
从蛋白晶体结构数据库(http://www.rcsb.org)下载关键靶点的三维结构,通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)及ZINC(http://zinc.docking.org/)数据库下载特色角药调控网络中Degree值居前4位的4个化合物的三维结构。通过AutoDock Tools 1.5.6 软件对受体和配体进行常规处理,借助Autogrid4 获得活性位点,进行分子对接。使用Lamarckian(拉马克)遗传算法进行分子对接计算,根据结合自由能评估最终对接结构,靶蛋白受体与化合物配体之间的结合自由能越小,则二者结合亲和能力越强。对接结果采用PyMOL2.4.1进行可视化处理。
2 结果
2.1 特色角药有效成分筛选及其靶点预测
分别检索到白芷、川芎、白附子有效成分37、32、7个,剔除重复后获得58个有效成分。分别预测到靶点67、68、46个,剔除重复后得到103个靶点。
2.2 特色角药治疗痤疮潜在靶点
检索并去除重复后得到痤疮疾病靶点1 273个。药物与疾病的交集靶点共23个,即特色角药治疗痤疮的潜在靶点,见表1。

表1 特色角药与痤疮交集靶点
2.3 特色角药调控网络
特色角药调控网络见图1。该网络包含63个节点和157条边。化合物节点中,Myricanone(杨梅酮)、Marmesin(异紫花前胡内酯)、Beta-sitosterol(β-谷甾醇)、Prangenidin(别欧前胡素)Degree值居前列。靶点节点中,PTGS2(前列腺素G/H合成酶2)、PTGS1(前列腺素G/H合成酶1)、RXRA(视黄酸受体RXR-α)、PIK3CG(磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基,γ亚型)Degree值居前列,见表2。

图1 特色角药治疗痤疮调控网络

表2 特色角药治疗痤疮调控网络中的化合物及靶点关键节点
2.4 GO-BP和KEGG通路富集分析结果
GO-BP富集分析显示,特色角药治疗痤疮主要与核受体活性、类固醇激素受体活性、配体激活转录因子活性、类固醇结合、转录共激活剂结合、核受体结合、雌激素受体结合、激素类核受体结合、转录辅因子结合、DNA作用的转录因子结合等生物学过程相关。KEGG通路富集分析显示,特色角药治疗痤疮主要与5类通路相关。①有机系统通路:雌激素信号通路、甲状腺激素信号通路、脂肪细胞中的脂类分解调节、甲状旁腺素合成-分泌-作用、胆碱能突触、血小板激活;②代谢通路:脂质和动脉粥样硬化、半乳糖代谢;③人类疾病通路:小细胞肺癌、甲状腺癌、化学致癌、内分泌抵抗、糖尿病并发症中的晚期糖基化终产物及其受体信号通路;④环境信息处理通路:核因子κB信号通路;⑤细胞进程通路:卵母细胞成熟分裂。见图2、图3。
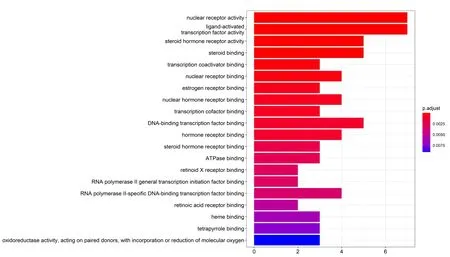
图2 特色角药治疗痤疮潜在靶点GO-BP富集分析

图3 特色角药治疗痤疮潜在靶点KEGG通路富集分析
2.5 蛋白相互作用网络及关键靶点
PPI 网络见图4A。该网络包含22个节点和56条边,节点越大表明其在网络的作用越重要。关键靶点见图4B。PPI网络中,AR(雄激素受体)、ESR1(雌激素受体)、NR3C1(糖皮质激素受体)、PTGS2、PPARG(过氧化物酶体增殖物激活受体)、PGR(孕酮受体)的Degree值居前列,见表3。MCODE聚类可知,关键靶点包括AR、ESR1、PTGS2、PGR。

表3 特色角药治疗痤疮PPI网络关键靶点(Degree≥5)

图4 特色角药治疗痤疮PPI网络及关键靶点
2.6 药物-化合物-关键靶点-通路网络
药物-化合物-关键靶点-通路网络见图5。该网络包含44个节点和87条边,节点越大表明其在网络中的作用越重要。从4个关键靶点PTGS2、PGR、ESR1、AR与通路间的关联来看,特色角药治疗痤疮的核心功能可能通过PTGS2调控核因子-κB信号通路、脂肪细胞中的脂类分解调节、血清素激活的神经突触、化学致癌等通路,以及PGR、ESR1、AR调控雌激素信号通路、内分泌抵抗、甲状腺激素信号通路发挥作用。PTGS2与PGR、ESR1、AR所调控的通路相互独立,可按此将核心功能分为2类。

图5 特色角药治疗痤疮药物-化合物-关键靶点-通路网络
2.7 分子对接
一般来说,配体与受体结合能越小,结合亲和力越强,结构越稳定。在AutoDock环境下,结合能<-4.5 kcal/mol表明配体分子和受体蛋白具有结合活性,结合能<-5 kcal/mol表明配体与受体结合活性较佳。将4个关键化合物与关键靶点进行分子对接,特色角药的关键化合物在与关键靶点对接过程中均进入了活性位点,表明化合物配体与靶蛋白受体之间具有较强的结合亲和能力。其中结合亲和能力最强的为β-谷甾醇与AR、杨梅酮与AR、β-谷甾醇与PGR、别欧前胡素与PTGS2。见表4。

表4 特色角药关键化合物与关键靶点分子对接结合能(kcal/mol)
2.7.1 关键化合物与前列腺素G/H合成酶2相互作用分析
杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素与PTGS2对接结果表明,4个化合物与PTGS2均存在较强的结合作用,结合亲和能力为别欧前胡素>异紫花前胡内酯>杨梅酮>β-谷甾醇。潜在的结合位点主要 有ARG-44、HIS-39、TRP-387、HIS-386、ASN-382、ASN-43、GLN-42、HIS-39、TYR-130等氨基酸残基。4个化合物均可与氨基酸形成多个氢键,且氢键距离较短,平均为2.2Å(见图6),表明化合物与蛋白口袋结合亲和能力较佳。另外化合物之间相似性也较高,结合能也相近。推测4个化合物均可与PTGS2蛋白结合形成稳定复合物。

图6 关键化合物与PTGS2分子对接模式
2.7.2 关键化合物与雄激素受体相互作用分析
杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素与AR对接结果表明,4个化合物与AR均存在较强结合作用,结合亲和能力为β-谷甾醇>杨梅酮>异紫花前胡内酯>别欧前胡素。潜在的结合位点主要有VAL-685、GLN-711、GLY-683等氨基酸残基,4个化合物均可与氨基酸形成至少1个氢键,且氢键距离较短,平均为2.2Å(见图7),表明化合物与蛋白口袋结合能力较佳。化合物之间相似性较高,结合能相近。

图7 关键化合物与AR分子对接模式
2.7.3 关键化合物与雌激素受体相互作用分析
杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素与ESR1对接结果表明,4个化合物与ESR1均存在较佳结合作用,结合亲和能力为别欧前胡素>异紫花前胡内酯>杨梅酮>β-谷甾醇。潜在的结合位点包括VAL-280、GLU-305、HIS-475、GLY-472等氨基酸残基。4个化合物均含有多个活性基团(酚羟基及羰基),均可与氨基酸形成多个氢键,且氢键距离较短,平均为2.2Å(见图8)。这些氢键的存在表明4个化合物能够很好匹配ESR1的活性口袋,可有效提高化合物在口袋中的稳定性,从而发挥治疗作用。

图8 关键化合物与ESR1分子对接模式
2.7.4 关键化合物与孕酮受体相互作用分析
杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素与PGR 对接结果表明,4 个化合物和视黄酸受体RXR-α均存在较佳的结合作用,结合亲和能力为β-谷甾醇>别欧前胡素>异紫花前胡内酯>杨梅酮。潜在结合位点包括ASN-719、ARG-766、GLN-725、GLN-815等氨基酸残基。其中,异紫花前胡内酯与PGR的活性残基形成4个氢键,多于另外3个化合物,说明该化合物与蛋白口袋结合较强(见图9)。这些氢键及其他相互作用的存在说明4个化合物均能够很好地匹配PGR的活性口袋,使化合物发挥治疗作用。

图9 关键化合物与PGR分子对接模式
3 讨论
痤疮为较为典型的激素介导性疾病。皮脂腺的形成受类固醇激素(如肾上腺皮质激素、性激素)、肽类激素(如促甲状腺激素释放激素、胰岛素样生长因子、促性腺激素释放激素)、氨基酸类激素(如甲状腺激素)调控。激素水平紊乱时,局部皮脂腺发育及分泌增加、毛囊分化异常及角化过度。毛囊微环境发生变化,痤疮丙酸杆菌定殖、炎症和宿主免疫反应连续发生。本研究利用现代生物信息学技术,对《普济方》痤疮外治古方特色角药的潜在作用机制进行分析,发现其具有独特的激素调节作用,同时还可发挥抗炎、免疫调节、脂代谢调节、抗增殖等功效。
本研究首先构建了特色角药治疗痤疮的调控网络,可见特色角药调控痤疮具有多成分、多靶点、成分与靶点相互作用密切的特点。拓扑学分析可知,特色角药主要有效成分别欧前胡素、β-谷甾醇、杨梅酮、异紫花前胡内酯等可作用于PTGS2、PTGS1、PIK3CG、RXRA等核心靶点发挥治疗作用。
杨梅酮具有基于5a-还原酶抑制的抗雄激素活性。β-谷甾醇可下调PI3K(磷脂酰肌醇3激酶)和Akt(丝氨酸/苏氨酸蛋白激酶)基因表达,诱导脂肪溶解。杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素均具有明确的诱导细胞凋亡、抗炎作用。杨梅酮、异紫花前胡内酯具有显著抗菌活性。从有效成分角度,特色角药可干预痤疮激素紊乱至炎症发生间各个发病环节,实现全环节调控。
对23个交集靶点进行GO和KEGG富集分析。GO富集分析结果显示,特色角药参与到核受体活性、类固醇激素受体活性、配体激活转录因子活性、类固醇结合等生物学过程中,主要影响以类固醇激素受体为主的核受体活性及其与配体结合过程,或干预转录因子活性,干扰转录共激活剂、转录辅因子等转录关键因子的结合过程,最终影响靶基因的表达。除覆盖雄激素受体、雌激素受体、孕酮受体等性激素受体及糖皮质激素受体等甾体激素受体的类固醇受体家族外,核受体家族还包括甲状腺激素受体(TR)、视黄酸受体RXR-α、过氧化物酶体增殖物激活受体等非类固醇受体家族。KEGG富集分析亦将药物的调控作用途径指向有机系统通路,特别是以雌激素信号通路为代表的类固醇类性激素的信号调控通路。KEGG结果提示,特色角药亦可作用于脂肪细胞中的脂类分解调节、核因子κB信号通路等通路,影响皮脂溶解、参与炎症及免疫反应。多种肿瘤相关疾病通路及卵母细胞成熟分裂通路亦出现于富集结果之中,提示特色角药可降低细胞增殖水平,改善毛囊、皮脂腺导管的角化过度。通过GO和KEGG富集分析可知,特色角药可通过影响靶基因表达实现以调节毛囊、皮脂腺局部激素微环境为主的痤疮全环节调控的目的。
对23个交集靶点进行PPI分析,并利用MCODE进行聚类,结果显示靶点AR、ESR1、PGR、PTGS2相互作用密切,形成了一以性激素受体为主的靶基因群。药物-化合物-关键靶点-通路网络显示,靶点AR、ESR1、PGR相互作用密切,共同作用于雌激素信号通路、内分泌抵抗、甲状腺激素信号通路,推测特色角药通过调控上述基因表达,影响相应的激素受体数量,调节雄激素及雌、孕激素水平。3种激素之间发生协同、拮抗作用,雄激素的优势地位发生变化。PTGS2主要参与前列腺素的生物合成,为介导炎症反应及细胞有丝分裂的关键酶,其与上述3个靶点相互独立,作用于介导炎症潜伏、诱导、应答、消退各阶段分子调节过程、调控细胞凋亡、周期调控、细胞分化的核因子κB信号通路,并可调节脂肪细胞的分解过程,推测特色角药可通过发挥抗炎、免疫调节、脂代谢调节、抗增殖作用减缓痤疮进程。
分子对接结果表明,特色角药4个关键化合物与4个靶蛋白均存在较佳的结合作用,它们可能是特色角药治疗痤疮的潜在活性成分。其中β-谷甾醇与AR结合所需的能量最低,结合性最强。4个化合物均有着较多的氢键受体与氢键供体,这有利于与靶蛋白形成稳定的氢键,从而使小分子化合物能够稳定地结合在蛋白的活性位点。进一步研究发现,杨梅酮、异紫花前胡内酯、β-谷甾醇、别欧前胡素与每个靶蛋白的结合模式基本相似,这也间接表明了分子对接技术的稳定性。另外,4个化合物与蛋白活性残基还存在疏水相互作用和范德华力以及形成共轭结构。因此,这些作用力可以有效地使小分子固定在活性中心,有利于提高化合物在蛋白活性口袋的稳定性。
本研究结果表明,《普济方》痤疮外治古方的特色角药可能具有抗雄、抗炎、免疫调节、脂代谢调节、抗增殖作用,呈现多成分、多靶点、多通路、全环节的调控特点,推测其应具有良好的控油、消炎、消痤的临床疗效。
异紫花前胡内酯、别欧前胡素、Alloimperatorine(别欧前胡素,与Prangenidin 同物异名,PubChem CID:69502)、杨梅酮作用于雄激素受体、雌激素受体、孕酮受体频次较高,在激素调节中起到关键性作用。异紫花前胡内酯、别欧前胡素来自白芷,杨梅酮来自川芎,3种成分均可作用于前列腺素G/H合成酶2。将异紫花前胡内酯、别欧前胡素、杨梅酮等关键成分引入痤疮外用制剂时,应对可能造成安全隐患的药物或成分予以剔除或替换。在保留古方特色的同时,形成疗效可靠、成分安全稳定的配方。
