基于网络药理学和实验验证探讨薏苡附子败酱散治疗溃疡性结肠炎作用机制
2022-09-29陈丽萍季蓉缪志伟
陈丽萍,季蓉,缪志伟
张家港市中医医院,江苏 张家港215600
溃疡性结肠炎(ulcerative colitis,UC)以反复发作的腹痛、腹泻、里急后重、黏液脓血便为主要临床表现。近年来,全球UC发病率逐渐升高,东亚地区平均年发病率约1.14/10万人。UC发病原因及机制复杂,可能与感染、遗传、吸烟、饮食、药物等因素有关。目前西医治疗UC采用氨基水杨酸制剂、糖皮质激素、免疫抑制剂、微生态制剂及生物制剂等,效果确切,但长期使用不良反应大、易形成药物依赖、价格高昂,限制其临床应用。
UC可归属中医学“痢疾”“肠痈”范畴,病机为脾虚湿盛,寒热互结,脾虚、湿盛两者相互影响,互为因果,湿郁日久可蕴毒化热,壅滞肠腑,与气血搏结,血败肉腐成脓。该病病机复杂,为本虚标实、寒热错杂之证,治疗颇为棘手。薏苡附子败酱散出自《金匮要略》,由薏苡仁、附子、败酱草组成,功效温阳健脾、清热祛湿。研究显示,薏苡附子败酱散联合西药治疗UC效果优于单纯西药。薏苡附子败酱散能通过修复肠黏膜、抗氧化应激治疗UC。目前对于该方治疗UC的具体机制研究较少,药效作用物质基础阐释尚不全面。网络药理学通过构建药物-疾病-靶点网络,综合分析药物成分及作用机制,既能宏观分析药物的作用,又可独立呈现某种特定疾病相关的靶点及通路,其系统性和整体性的研究思路与中医药整体观及辨证论治的原则高度吻合。本研究利用网络药理学研究方法,探究薏苡附子败酱散治疗UC的作用机制,并通过实验进行初步验证,为进一步揭示该方的药理作用和药效物质提供依据。
1 资料与方法
1.1 药物有效成分及靶点预测
利用TCMSP 数据库(https://old.tcmsp-e.com/tcmsp.php),以“薏苡仁”“附子”“败酱草”为关键词进行检索,对口服生物利用度(OB)>30%和类药性(DL)>0.18的化学成分进行筛选,并获得相关靶点。通过中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/TCMIP/index.php/Home/Index/index.html)检索“薏苡仁”“附子”的化学成分,将其成分结构式导入SwissADME平台(http://www.swissadme.ch/),筛选胃肠道吸收值(GA)为“High”及DL包含至少2个“YES”的活性成分,将筛选得到的有效成分通过TCMIP 及SwissTargrtPrediction 数据库(http://www.swisstargetprediction.ch/)获取相关靶基因(probability>0),剔除重复项,得到薏苡附子败酱散活性成分对应的靶基因,利用UniProt数据库(https://sparql.uniprot.org/)规范靶基因命名。
1.2 疾病相关靶点及共同靶点获取
通过GeneCards(https://www.genecards.org)、OMIM(https://omim.org/)、DrugBank(https://go.drugbank.com/)数据库,以“Ulcerative Colitis”为检索词进行检索,获得UC相关靶基因并删除重复项,将其与薏苡附子败酱散有效成分对应的靶点基因映射,共同基因即薏苡附子败酱散治疗UC的靶基因。
1.3 药物-成分-靶点-疾病网络构建
将药物活性成分及药物与疾病共同基因数据导入Cytoscape3.7.2软件,构建药物-成分-靶点-疾病网络图。
1.4 蛋白相互作用网络构建
在STRING数据库(https://string-db.org/)中选择“multiple proteins”(多蛋白),导入药物与疾病共同靶基因名,物种(species)选择“Homo sapiens”(人类)进行检索,得到蛋白相互作用(PPI)网络,设置最低互作分数为“high confidence(0.7)”,导出TSV 文件,使用R语言计算核心靶点交互次数并进行排序,制作柱形图。
1.5 GO和KEGG通路富集分析
使用OmicShare(基迪奥)在线平台(https://www.omicshare.com/)对薏苡附子败酱散治疗UC核心靶点进行GO功能富集分析,得到二级分类柱状图,使用R语言进行KEGG通路富集分析,根据调整后的值进行排序,选择前20项分别制作柱形图。
1.6 实验验证
1.6.1 动物、试药与仪器
C57BL/6小鼠,SPF级,雄性,40只,体质量18~20 g,购自苏州新药研究中心有限公司,动物生产许可证号SYXK(苏)2017-0001。饲养于温度(24±1)℃、湿度40%~60%环境,自然昼夜节律,自由摄食饮水。动物实验由张家港市中医医院医学伦理委员会审核通过(AF-SOP-38-1.0)。
薏苡仁、黑顺片、败酱草,购自北京同仁堂药店。将薏苡仁30 g、黑顺片6 g、败酱草15 g浸泡30 min,以10倍量水将黑顺片先煎30 min,加入其他药物,再煎30 min,纱布过滤,取滤液,再加8倍量水将所有药物煎煮30 min后过滤。2次滤液合并,凝缩成1.05 g/mL的药液,置于4 ℃冰箱保存备用。柳氮磺吡啶肠溶片(批号09180811),上海信谊天平药业有限公司。将柳氮磺吡啶肠溶片研磨成粉末状,溶解于含0.5%CMC-Na的蒸馏水中,即得终浓度为10 mg/mL的药液。葡聚糖硫酸钠(MW 36 000~5 000,批号S0221,MP 公司),表皮生长因子受体(EGFR)一抗(批号ab52894,Abcam公司),p-AKT一抗(批号4060S,CST公司),AKT一抗(批号4691S,CST公司),GAPDH一抗(批号ab9485,Abcam公司),半胱氨酸天冬氨酸蛋白酶3(Caspase3)一抗(批号9662S,CST 公司),Alexa Fluor488偶联二抗(批号ab150077,Abcam公司),山羊抗兔IgG H&L(批号ab205718,Abcam公司)。
CUT 4062 石蜡切片机(德国SLEE 公司),URFL-T荧光显微镜(日本Olympus公司),LAS 500凝胶成像分析系统(GE Healthcare Bio-Sciences公司),PO Box 998 酶标仪(BioTek 公司),Fresco21 高速冷冻离心机(ThermoFisher Scientific 公司),Mini PROTEANTetra Cell蛋白电泳仪(Bio-Rad公司)。
1.6.2 分组、造模、给药及取材
将小鼠随机分为正常组、模型组、柳氮磺吡啶组、薏苡附子败酱散组,每组10只。适应性喂养3 d后,模型组、柳氮磺吡啶组、薏苡附子败酱散组予2.5%葡聚糖硫酸钠自由饮用,7 d后替换为蒸馏水,正常组予蒸馏水自由饮用。根据药物等效剂量换算,柳氮磺吡啶组每日予100 mg/kg柳氮磺吡啶肠溶片药液灌胃,薏苡附子败酱散组每日予10.5 g/kg薏苡附子败酱散药液灌胃,正常组与模型组每日予蒸馏水灌胃,灌胃体积均为0.2 mL,连续10 d。给药结束后颈椎脱臼处死小鼠,剖取结肠,用PBS冲洗干净,取远端结肠组织。
1.6.3 结肠HE染色及病理评分
取结肠组织,多聚甲醛固定,石蜡切片后行HE染色,光镜下观察肠黏膜形态、腺体结构及炎细胞浸润情况等病理变化。参照Dieleman标准对结肠组织进行病理评分,组织学损伤程度用炎症、病变深度、隐窝破坏评分与病变范围评分之和表示。
1.6.4 免疫荧光染色
取结肠组织石蜡切片,在100 ℃柠檬酸钠中浸泡20 min,PBS洗玻片,5 min×3次,置于0.2%Triton穿孔2 min,放入5%牛血清中封闭1 h,加入Caspase3一抗(1∶1 000),4 ℃过夜,PBS洗玻片,5 min×3次,于黑暗中敷相应的荧光二抗(1∶500)50 min,PBS洗5 min×3次,加DAPI封片剂封片,荧光显微镜观察。
1.6.5 蛋白印迹法
取30 mg结肠组织,加入适量裂解液、蛋白酶抑制剂和去磷酸化酶抑制剂,于研磨机中研碎后,4 ℃、12 000×离心10 min 后取上清,定量后加入loading buffer,100 ℃加热5 min,8%SDS-PAGE,400 mA恒流转膜1 h,封闭液中封闭1 h,分别加入EGFR一抗(1∶5 000)、p-AKT一抗(1∶1 000)、AKT一抗(1∶1 000)、GAPDH一抗(1∶2 500),4 ℃过夜,TBST洗8 min×3次,二抗(1∶5 000)室温孵育1 h,TBST洗8 min×3次,ECL显影,计算EGFR、p-AKT、AKT表达量。
1.6.6 统计学方法
2 结果
2.1 薏苡附子败酱散活性成分和潜在靶点
基于TCMSP、TCMIP数据库及SwissADME平台检索并筛选出薏苡附子败酱散活性成分66种,其中薏苡仁成分10种、附子成分43种、败酱草成分13种。通过TCMSP、TCMIP、SwissTargrtPrediction 数据库进行靶点预测,使用UniProt数据库规范命名并排除重复靶点,共获得193个靶点。
2.2 溃疡性结肠炎相关基因
使用GeneCards、OMIM、DrugBank数据库检索获得UC相关基因4 215个,将其与薏苡附子败酱散活性成分对应的靶基因进行比对,得到100个共同靶点。
2.3 药物-成分-靶点-疾病网络
将药物活性成分和共同靶点导入Cytoscape3.7.2软件,药物-成分-靶点-疾病网络见图1。该网络包括100个靶点及薏苡附子败酱散与这些基因相关的32个有效成分,见表1。
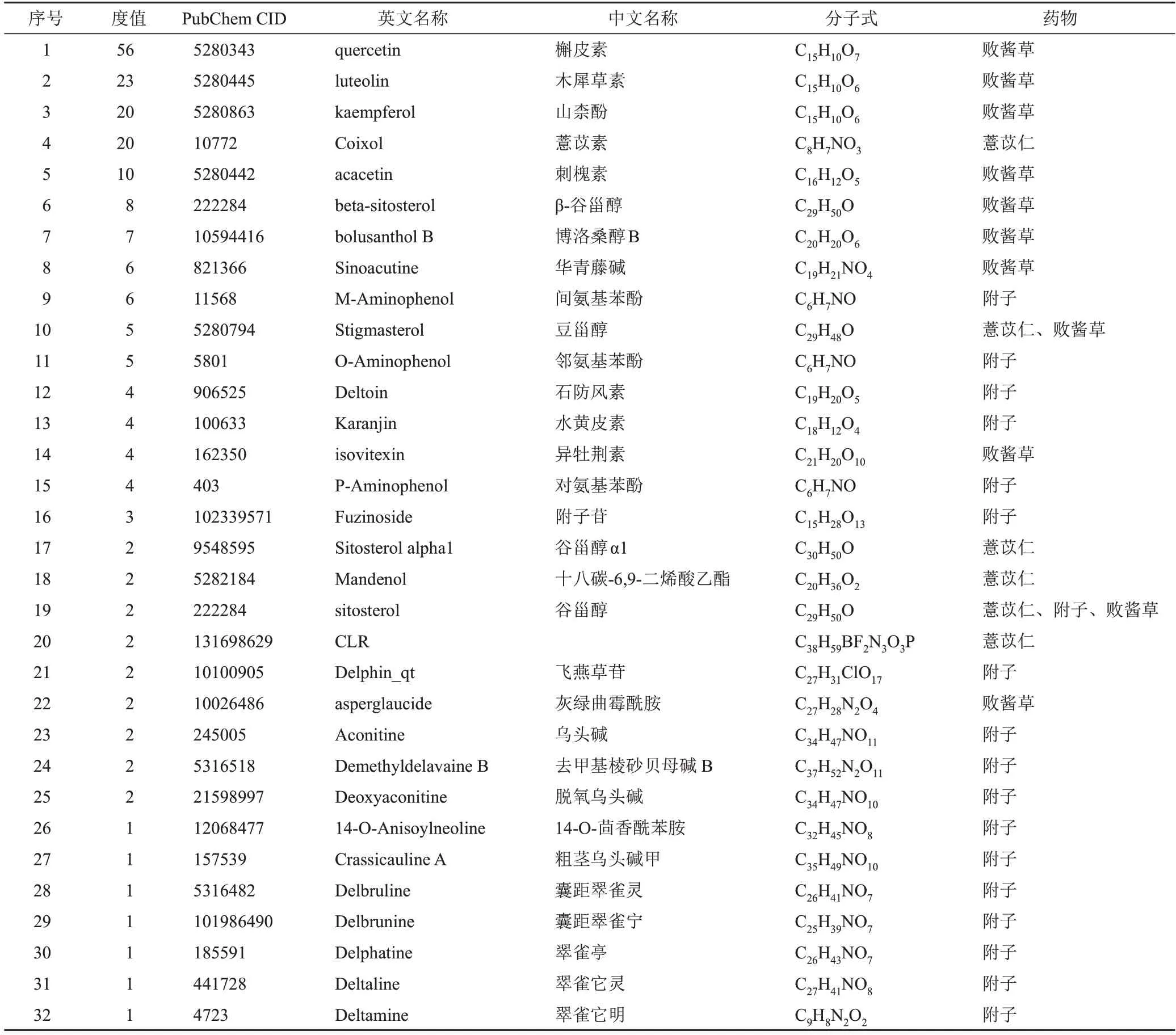
表1 薏苡附子败酱散有效成分
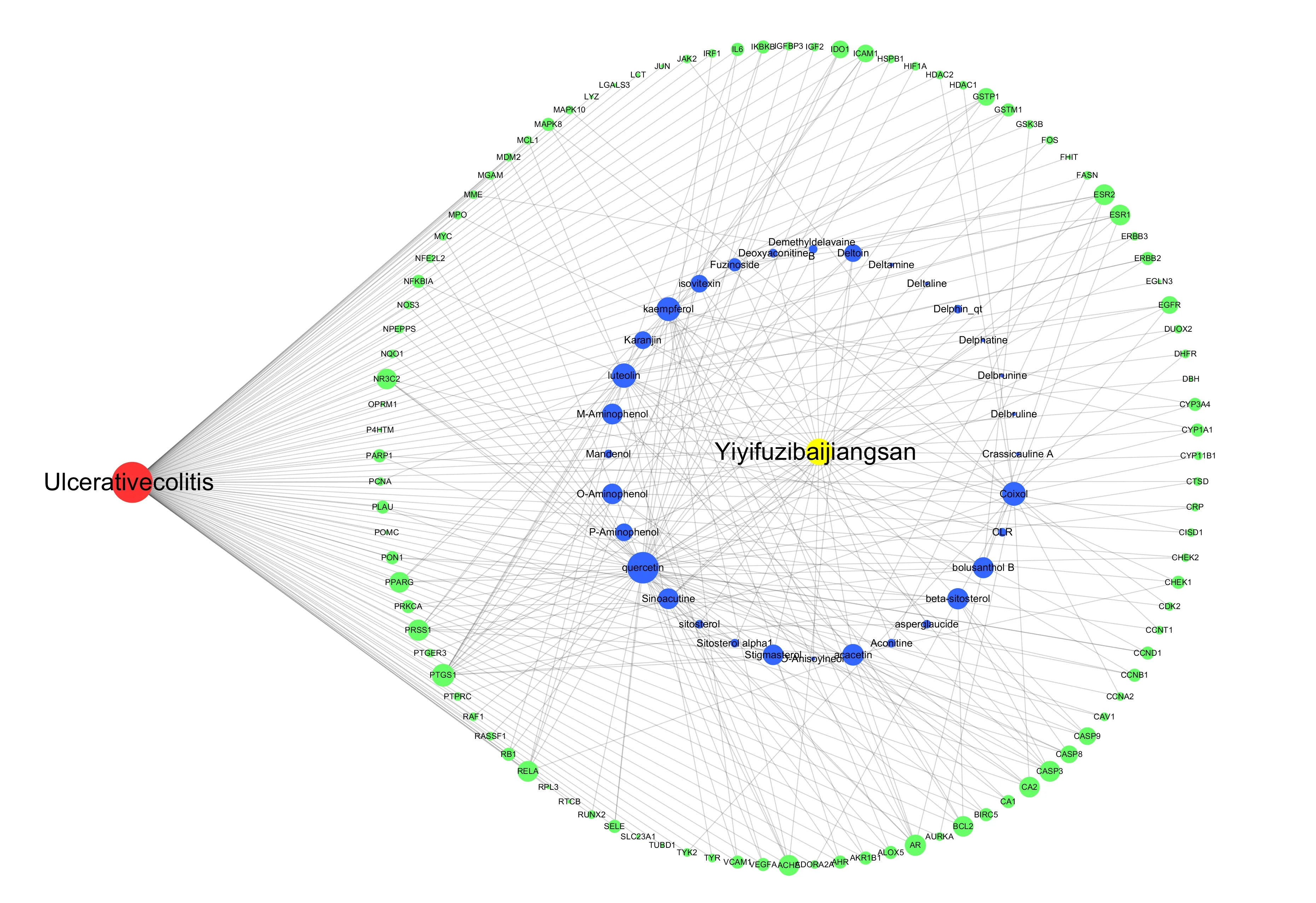
图1 薏苡附子败酱散治疗UC药物-成分-靶点-疾病网络
2.4 共同靶点相互作用网络
将药物与疾病的共同靶点100个导入STRING数据库进行分析和可视化处理,得到薏苡附子败酱散治疗UC靶点PPI网络,结果见图2。使用R语言计算靶点的交互次数,选取排名前30位的靶点作为薏苡附子败酱散治疗UC的核心靶点,制作条形图,结果见图3。可以看出,核心靶点包括JUN、MYC、ESR1、CCND1、EGFR、RELA(NF-κB)、CASP3、HIF1A、IL-6、HDAC1等。
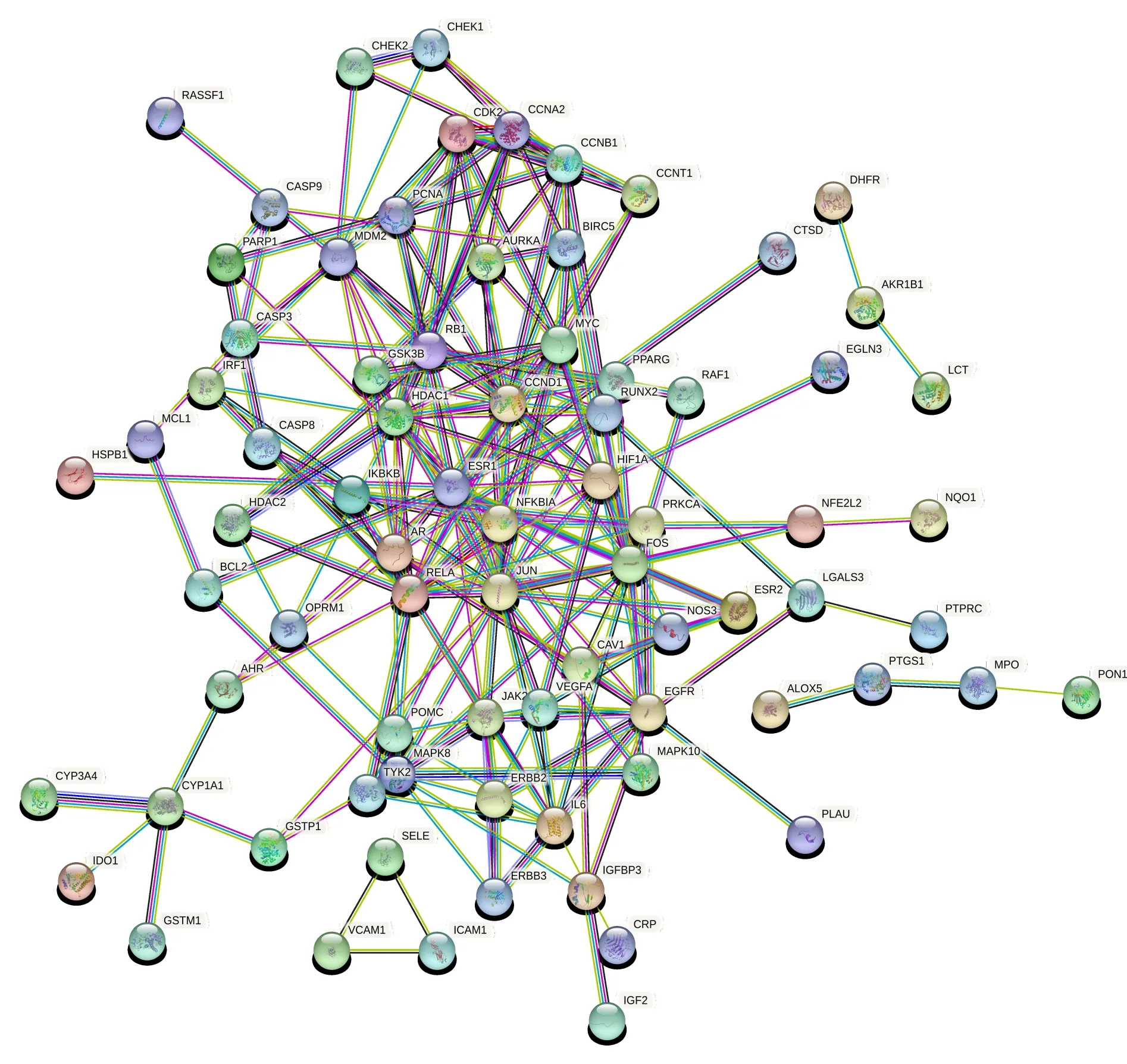
图2 薏苡附子败酱散治疗UC靶点PPI网络
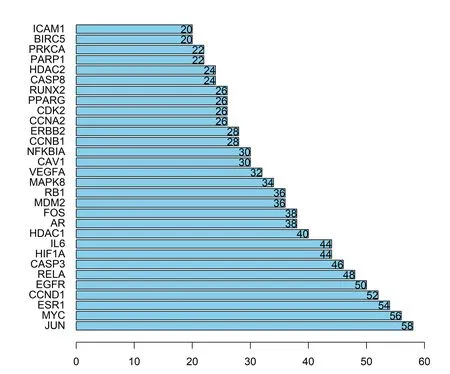
图3 薏苡附子败酱散治疗UC核心靶点
2.5 GO和KEGG通路富集分析结果
对薏苡附子败酱散治疗UC核心靶点进行GO功能富集分析,得到二级分类柱状图,见图4。生物过程(Biological Process)主要富集条目为细胞进程、代谢过程、生物调节、刺激反应等,分子功能(Molecular Function)主要富集条目为连接、催化活性、分子功能调控等,细胞组分(Cellular Component)主要富集条目为细胞、细胞组分、细胞器等。使用R 软件进行KEGG通路富集分析,根据调整后的值进行排序,排名前20位的通路见图5。薏苡附子败酱散治疗UC的药理作用可能涉及肝炎、病毒感染、癌症、AGE-RAGE、细胞凋亡、TNF、p53、PI3K/Akt等信号通路。
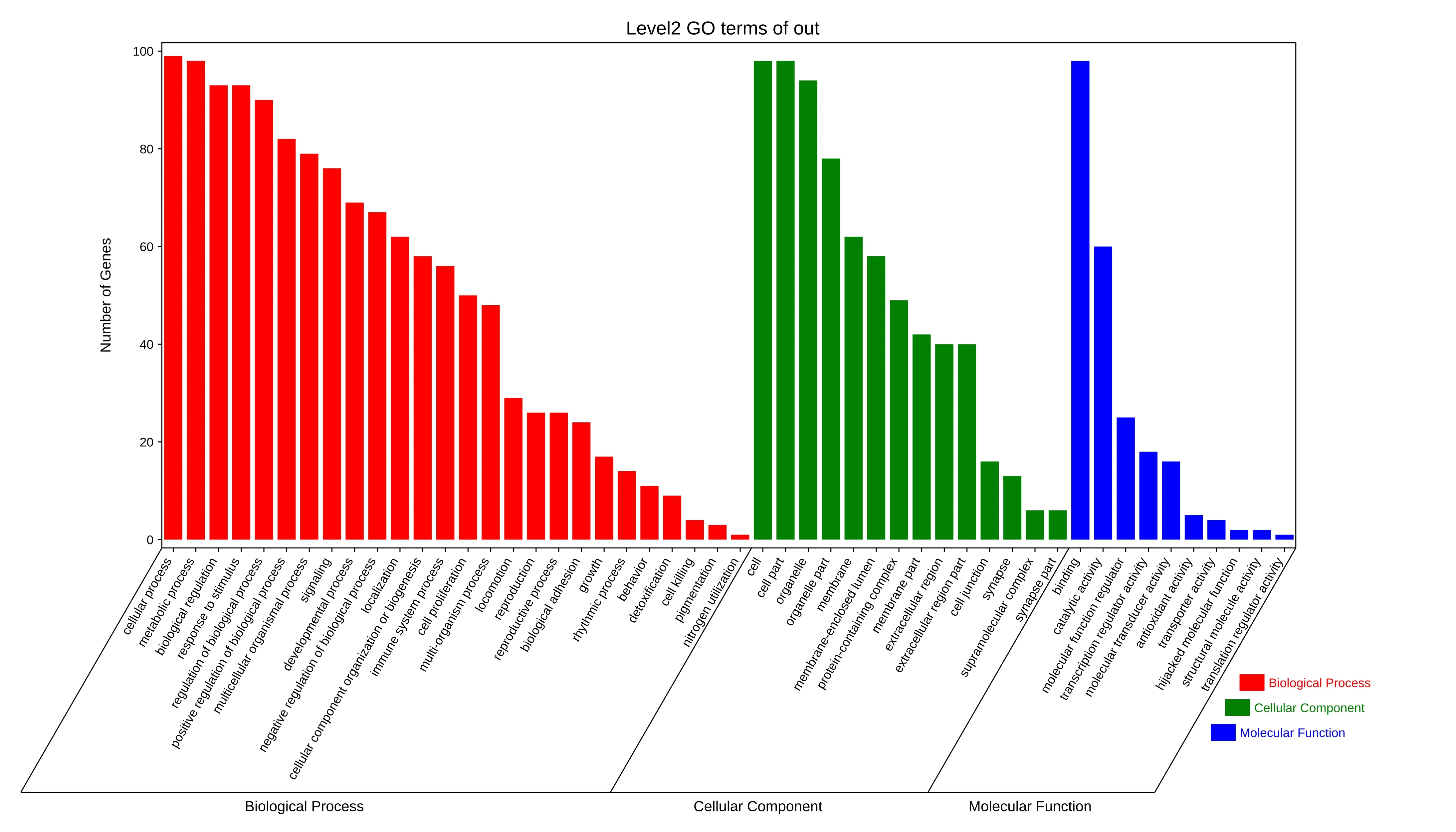
图4 薏苡附子败酱散治疗UC核心靶点GO富集分析
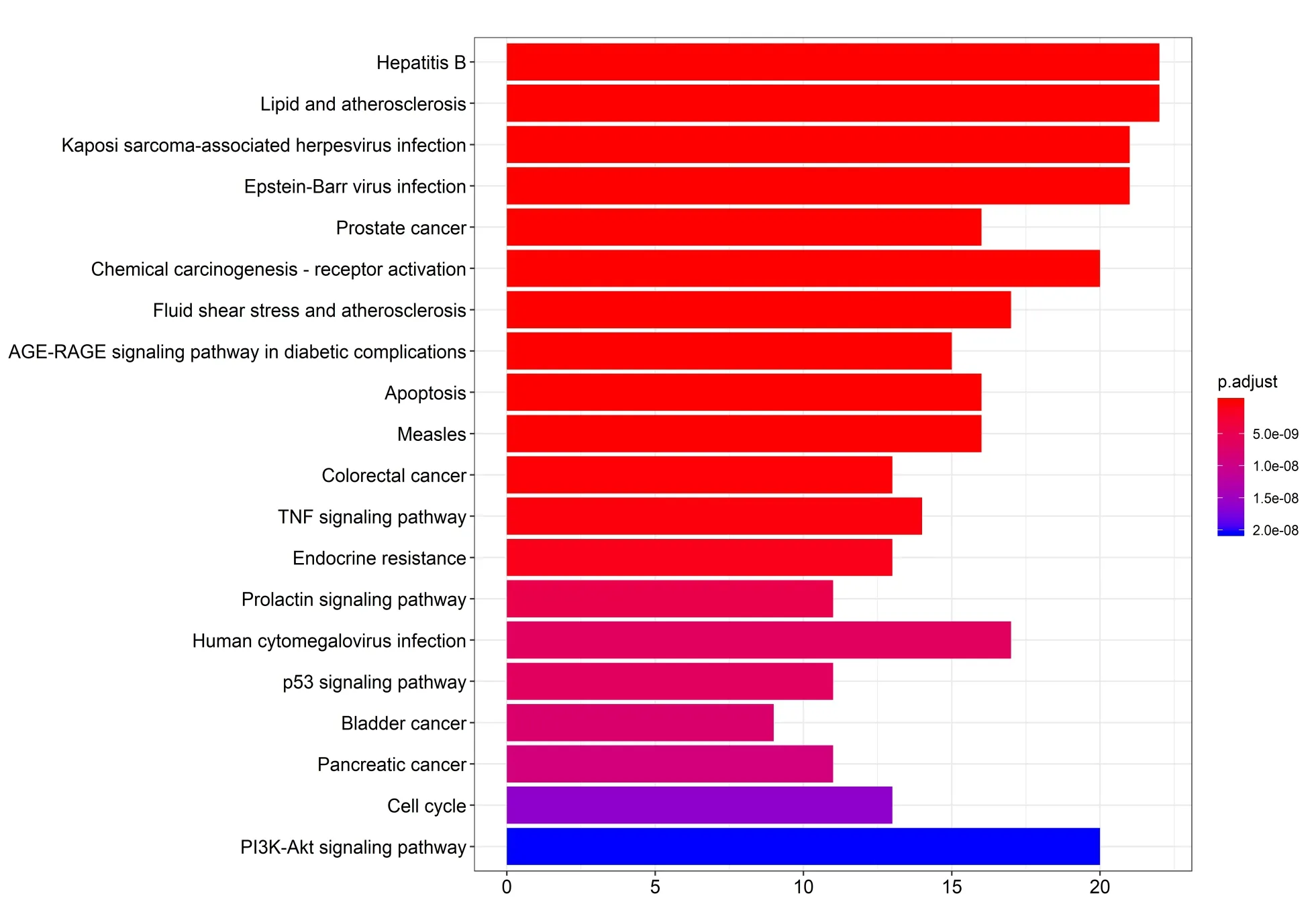
图5 薏苡附子败酱散治疗UC核心靶点KEGG富集分析
2.6 靶点验证
2.6.1 薏苡附子败酱散对模型小鼠结肠组织病理形态的影响
模型组结肠黏膜不完整,大部分腺体被破坏,结构紊乱,大量炎性细胞浸润,可见黏膜下水肿及多灶性溃疡形成。柳氮磺吡啶组有部分腺体被破坏,黏膜结构尚完整,炎性细胞浸润情况较模型组改善。薏苡附子败酱散组黏膜结构接近正常,腺体破坏较少,炎性细胞浸润情况显著改善。组织病理评分模型组明显高于正常组(<0.01),柳氮磺吡啶组和薏苡附子败酱散组均低于模型组(<0.01),见图6。
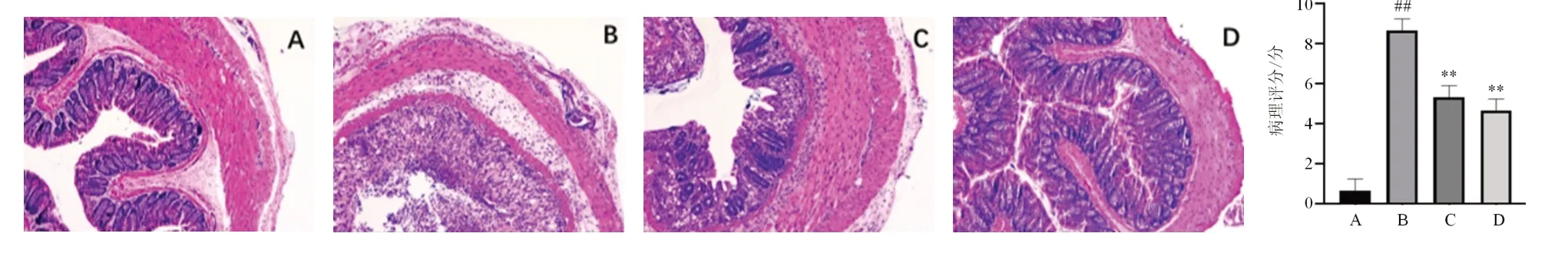
图6 各组小鼠结肠组织病理形态(HE染色,×100)及病理评分(,每组10只)
2.6.2 薏苡附子败酱散对模型小鼠结肠组织EGFR、p-AKT表达的影响
Western blot 实验结果显示,模型组结肠组织EGFR、p-AKT 的表达水平较正常组显著升高(<0.01),柳氮磺吡啶组和薏苡附子败酱散组较模型组显著降低(<0.01),见图7、表2。
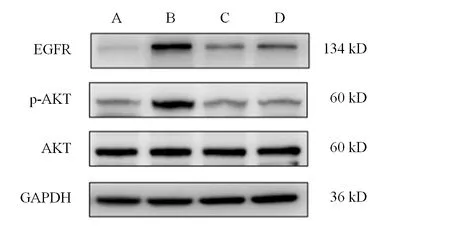
图7 各组小鼠结肠组织p-AKT及EGFR表达免疫印迹
表2 各组小鼠结肠组织p-AKT及EGFR表达比较()
2.6.3 薏苡附子败酱散对模型小鼠结肠组织Caspase3表达的影响
免疫荧光染色结果显示,模型组小鼠结肠组织Caspase3的荧光强度较正常组明显增强,经柳氮磺吡啶及薏苡附子败酱散治疗后,Caspase3的荧光强度均有不同程度减弱,见图8。
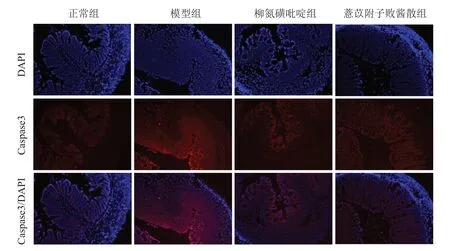
图8 各组小鼠结肠组织Caspase3表达(免疫荧光染色,×100)
3 讨论
薏苡附子败酱散出自《金匮要略·疮痈肠痈浸淫病脉证并治》“肠痈之为病,其身甲错,腹皮急,按之濡,如肿状,腹无积聚,身无热,脉数,此为肠内有痈脓,薏苡附子败酱散主之”。其组方精炼,具有温阳健脾、清热祛湿功效,临床常用于UC的治疗。现代药理学研究表明,薏苡附子败酱散具有良好的调节免疫、镇痛消炎、抗氧化、抗肿瘤的疗效。另有研究发现,薏苡附子败酱散能够通过上调核因子E2 相关因子2(Nrf2)及其下游抗氧化蛋白血红素氧合酶1(HO-1)表达、增加Nrf2 mRNA表达从而达到治疗UC目的。以上研究在一定程度上揭示了薏苡附子败酱散治疗UC的相关机制。本研究基于多成分、多靶点作用的研究思路,应用网络药理学方法对薏苡附子败酱散的有效成分进行筛选,预测其治疗UC的关键靶点和信号通路,并采用动物实验对关键靶点及相关通路进行验证,为薏苡附子败酱散治疗UC的机制研究奠定相关基础。
本研究筛选出薏苡附子败酱散治疗UC活性成分32个,其中对应靶点较多的活性成分有槲皮黄素、木犀草素、山柰酚、薏苡素、刺槐素、β-谷甾醇等,其中大多数均具有良好的口服生物利用度及类药性。有研究表明,败酱草含有多种黄酮类化合物,经水解后其苷元主要是槲皮素与山柰酚,由于产地、批次的差异,槲皮素与山柰酚的含量分别在0.061~1.046 mg/g 与0.045~0.701 mg/g。张珊珊等通过构建体内外腹泻模型发现败酱草中提取的总黄酮可以抑制肠蠕动,具有潜在的抗腹泻活性。槲皮素能通过AhR调控的炎症机制修复肠炎小鼠缺失的上皮结构,缓解肠炎小鼠症状。薏苡素最早从薏苡根提取,黄克俊等用浸泡超声法进行前处理,采用高效液相法测定薏苡素在薏苡仁中的含量为0.8 mg/100 g。薏苡素具有抗炎特性,能抑制NF-κB、MAPK信号通路及NLRP3炎性小体,下调IL-1β、IL-6、IL-18、TNF-α 等炎性因子表达。β-谷甾醇存在于败酱草中,彭金咏等从6 kg白花败酱草粗粉中提取到β-谷甾醇50 mg。有研究表明,β-谷甾醇能抑制肿瘤细胞的增殖与分化,诱导肿瘤细胞的凋亡。同时,其具有良好的抗炎活性,能有效改善葡聚糖硫酸钠诱导的小鼠肠炎,降低结肠组织中炎症因子如IL-1β、IL-6、MCP-1 及COX-2 的mRNA表达。因此,推测槲皮素、山柰酚、薏苡素、β-谷甾醇可能为薏苡附子败酱散治疗UC的关键成分。
药物活性成分相关靶基因与UC相关靶基因取交集得到100个共同靶点,即薏苡附子败酱散治疗UC的靶点。基于STRING数据库构建薏苡附子败酱散治疗UC靶点PPI 网络,筛选出的核心基因有JUN、MYC、ESR1、CCND1、EGFR、RELA(NF-κB)、CASP3、HIF1A、IL-6、HDAC1 等。JUN、MYC、ESR1、CCND1与肿瘤的形成密切相关,共同参与细胞的增殖、分化、凋亡、恶性转变等过程。EGFR能诱导细胞增殖,可通过作用于下游的炎症通路而诱发炎症反应,同时参与肿瘤的侵袭与转移。以上基因的富集在一定程度上阐释了UC易于癌变的特性。NF-κB参与UC促炎因子的表达,UC患者及肠炎模型的结肠组织均可见NF-κB活化。Caspase3是引起细胞凋亡的关键酶,异常的细胞凋亡参与UC溃疡形成,有研究显示Caspase3在UC小鼠表达较正常组多。IL-6在急性炎症反应中占据中心地位,其在肠炎小鼠中呈现高表达,并且IL-6血清水平对UC的缓解及复发具有预测作用。由此,可以推测薏苡附子败酱散对UC的治疗作用与其多靶点协同合作有关,具体体现在薏苡附子败酱散能调控细胞增殖、分化、凋亡、炎症反应等。
对核心基因进行GO功能富集分析,结果显示,生物过程主要富集条目为细胞进程、代谢过程、生物调节、刺激反应等,分子功能主要富集条目为连接、催化活性、分子功能调控等,细胞组分主要富集条目为细胞、细胞组分、细胞器等。核心基因GO功能富集分析结果的多样性表明薏苡附子败酱散能通过多种生理过程干预UC的发生发展,体现了中药复方多成分、多靶点协同增效的优势。KEGG通路富集分析发现薏苡附子败酱散治疗UC的通路主要涉及肝炎、病毒感染、癌症、AGE-RAGE、细胞凋亡、TNF、p53、PI3K/Akt等多条信号通路。TNF-α参与UC的发生发展,根据UC内科处理国际指南(2015年多伦多共识),抗TNF单抗被推荐用于UC的治疗,目前已获得很好的疗效。PI3K/Akt是参与细胞增殖、分化及凋亡的经典通路,已有研究证实该通路与UC的发病机制密切相关,PI3K/Akt通路抑制剂能明显缓解UC小鼠的疾病状态及结肠镜下表现。不断复发的UC具有癌变倾向,薏苡附子败酱散中多种有效成分均与抗肿瘤效应相关,而KEGG结果显示薏苡附子败酱散治疗UC还涉及多条癌症通路,我们可以推测薏苡附子败酱散能在一定程度上防止UC进一步发展成为肠癌。
动物实验结果显示,薏苡附子败酱散对UC小鼠的结肠病理具有改善作用,而且能降低p-AKT、Caspase3、EGFR在肠炎小鼠结肠表达,这与既往研究本方中败酱草能抑制AKT有关通路一致。EGFR是PI3K/Akt的上游基因,调控着细胞增殖,同时能作用于下游基因参与炎症反应,而Caspase3与细胞凋亡有关,EGFR、p-AKT及Caspase3表达增加提示UC小鼠结肠上皮细胞的凋亡及增殖指数均高于正常小鼠。这可能是由于在炎症活动区域,黏膜上皮细胞凋亡速率明显增加,为保持结肠黏膜正常功能,上皮细胞则会呈现代偿性过度增殖。因此,我们推测薏苡附子败酱散能通过作用于EGFR/PI3K/Akt通路及Caspase3调控细胞增殖及凋亡的平衡达到治疗UC的目的。薏苡附子败酱散成分复杂,其对UC治疗作用的机制有待于进一步实验验证。
综上,本研究通过网络药理学研究方法,从分子水平阐述了薏苡附子败酱散治疗UC的相关机制,为该方的治疗效果提供理论支持,同时在动物水平上验证了部分网络药理学结果,可为后续深入研究提供线索。
