蟾毒灵抑制肿瘤相关成纤维细胞介导的转移
2022-09-21朱锐秋殷佩浩
朱锐秋,殷佩浩
作者单位:安徽医科大学上海普陀中心临床学院,上海 200062
结直肠癌(colorectal cancer, CRC)是新发癌症病例的第三大原因,也是癌症相关死亡的第二大常见原因。转移频率和耐药性的增加导致 CRC 患者的预后不良。据估计,50%~60%的CRC患者可能有转移;转移性CRC患者的5年总生存率仅为13.3%,而局限期患者的5年总生存率为91.1%[1-2]。其中,肿瘤微环境(tumor microenvironment, TME) 是癌症进展和转移的必要先决条件。肿瘤相关成纤维细胞(cancer-associated fibroblast, CAF)是CRC基质的主要细胞类型之一,其通过利用旁分泌因子在肿瘤的增殖、转移、血管生成和化学抗性中起重要作用[3-4]。越来越多的证据表明,STAT3信号通路的激活是CRC细胞上皮间充质转化 (epithelial-mesenchymal transition, EMT)和侵袭性增加的关键因素,但关于CAF来源的白细胞介素-6 (interleukin- 6, IL-6)对于STAT3信号通路的激活的报道甚少[5]。蟾毒灵是从蟾蜍毒液中分离的主要生物活性成分,由于其对肿瘤细胞凋亡、转移和增殖的影响,已被证实是一种有效的抗肿瘤药物。有研究[6]表明,蟾毒灵具有靶向STAT3通路的作用。该研究旨在探索蟾毒灵对于CAF介导的肿瘤细胞侵袭和转移的作用。
1 材料与方法
1.1 材料
1.1.1药品与试剂 DMEM培养基、RPIM-1640培养基、胎牛血清(FBS)、双抗、胰酶均购自美国Gibco公司;细胞培养耗材和Transwell小室购自美国Corning公司;基质胶购自美国BD公司;RIPA裂解液、上样缓冲液均购自美国Cell Signaling Technology公司;IL-6 ELISA试剂盒购自武汉博士德生物科技有限公司 (Human, EK0428);兔源FAP抗体 (英国Abcam公司, ab53066)、鼠源α-SMA (英国Abcam公司, ab124964)、鼠源STAT3抗体 (美国CST公司, 9139S)、兔源P-STAT3抗体 (美国CST公司, 9145S)、兔源E-cadherin (美国CST公司, 3195S)、兔源N-cadherin (美国CST公司, 13116S)、兔源Snail (英国Abcam公司, ab180714)、鼠源VIM (美国CST公司, 5741S)和鼠源β-actin (英国Abcam公司, ab6276);蟾毒灵购自成都瑞芬思生物科技有限公司。
1.1.2仪器 超低温冰箱(青岛海尔公司),全波长酶标仪(美国Thermo Fisher Scientific公司),凝胶电泳仪、电泳槽(美国BIO-RAD PowerPace Basic公司),离心机(德国Hettich公司),ChemiDoc MP成像仪(美国BIO-RAD公司),共聚焦显微镜(德国ZEISS公司)。
1.1.3细胞 该课题选取结肠癌细胞HCT116、CAF作为实验对象,HCT116来自美国模式培养物集存库(American type culture collection,ATCC)细胞库。CRC组织来源的CAF,从CRC患者的癌组织中分离得到。细胞培养条件是37 ℃、5% CO2。组织标本的使用征得了患者的知情许可。
1.2 方法
1.2.1原代CAF细胞提取 在培养皿中加入适量的生理盐水后将所取病人组织标本块置于其中,将多余脂肪、边缘残留组织清理掉,加入适当10%双抗 D-Hanks溶液45 ml清洗组织至澄清。用镊子夹起组织,眼科剪剪碎至糊状。用吹管将组织碎末转移到15 ml离心管中,加入适量D-Hanks溶液完全淹没组织,配平后1 000 r/min,25 ℃离心5 min,弃去上清液。关灯避光,加入胶原酶,封口膜封住管口,置于37 ℃恒温摇床中 150 r/min振荡1 h。清洗胶原酶:消化后离心5 min,倒掉胶原酶,加入含15%胎牛血清完全培养基2 ml,吹打离散组织后离心5 min,重复此步骤3次,待胶原酶全部去除后加入培养基,转移至小培养皿中放入培养箱中孵育。
1.2.2细胞分组 根据实验目的将HCT116分成5组:对照组,细胞常规培养未做任何处理;CAF-1条件培养基组,CAF-1条件培养基加入HCT116中培养24 h;CAF-2条件培养基组,CAF-2条件培养基加入HCT116中培养24 h;蟾毒灵+CAF-1条件培养基组,CAF-1条件培养基中加入蟾毒灵后加入HCT116作用24 h;蟾毒灵+CAF-2条件培养基组,CAF-2条件培养基中加入蟾毒灵后加入HCT116作用24 h,其中蟾毒灵浓度为35 nmol/L,作用时间为24 h。
1.2.3免疫荧光 CAF(2×104)在显微镜上接种培养过夜。用PBS洗涤两次,甲醇固定15 min,0.2% TritonX-100渗透5 min,5% BSA在室温下封闭1 h后一抗在4 ℃孵育过夜,一抗有FAP(1 ∶100,兔源)、VIM(1 ∶100,鼠源),然后与二抗[山羊抗小鼠IgGH&L(AlexaFluor®488)]和[山羊抗兔IgGH&L(AlexaFluor®594)]孵育2 h。用DAPI进行核定位评估。
1.2.4条件培养基 当CAF增长到80%的浓度时,培养基被无血清的培养基取代。处理48 h后,收集细胞悬液作为条件培养基。高速离心后收集条件培养基,通过0.22 μm微孔膜过滤,在-20 ℃保存。
1.2.5Western blot检测蛋白表达水平 用含有蛋白酶和磷酸酶抑制剂的细胞裂解液裂解细胞,置于冰上裂解30 min后离心提取蛋白,并使用BCA蛋白检测试剂盒进行蛋白定量。用10%的SDS-PAGE分离等量的细胞裂解物,并将分离后的蛋白转移到PVDF膜上。用5%脱脂牛奶封闭1 h后,依照蛋白分子量的大小截取不同条带,将条带与一抗孵育,一抗有FAP(1 ∶1 000)、α-SMA(1 ∶2 000)、VIM(1 ∶1 000)、β-actin(1 ∶5 000)、P-STAT3(1 ∶1 000)、STAT3(1 ∶1 000)、E-cadherin(1 ∶1 000)、N-cadherin(1 ∶1 000)、Snail(1 ∶1 000)。在4 ℃条件下孵育过夜,漂洗3次后与二抗在常温下孵育1 h。洗膜3次,使用增强化学发光显色法进行显色,用Image J软件进行蛋白表达分析。
1.2.6ELISA检测IL-6水平 收集CAF、HCT116的条件培养基。使用ELISA试剂盒测定IL-6水平。将100 μl样品加入抗体包被的96孔板的每个孔中,室温下孵育2 h。将100 μl的工作检测溶液加到每个孔中,在加入100 μl底物溶液之前,室温下再孵育1 h。加入50 μl终止液终止反应。在450 nm波长处读取吸光度。
1.2.7划痕实验 肿瘤细胞汇合后,用无菌移液管尖端直线划痕HCT116。PBS清洗细胞,清除细胞碎片,加入培养基。24 h记录划痕照片,对不同样本的划痕实验进行调查和分析。使用Image J软件测量划痕面积。使用倒置显微镜获得数码照片。
1.2.8Transwell实验 预先用基质胶包被Transwell小室的底膜并放入24孔 Transwell专用板中。将转染后的细胞分散在300 μl无血清的培养基中并加入小室内;向小室下部的孔中加入700 μl含10% FBS的培养基。孵育48 h后,将穿出到膜下表面的细胞用甲醇固定,结晶紫染色,并在显微镜下拍照,在光学显微镜下以×400放大倍数计数细胞。
1.2.9CCK-8检测HCT116细胞活力 细胞铺板于96孔板中,并在24 h内用蟾毒灵作用。24 h后,使用CCK-8检测方法评估细胞活力。
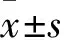

图1 原代CAF提取及验证
2 结果
2.1 原代CAF提取及验证首先使用CRC组织标本提取原代CAF细胞,对细胞株命名为CAF-1和CAF-2,由图1结果可见,镜下观察其形态呈长梭形。提取的原代细胞表达CAF常见表面标志物FAP、α-SMA和VIM。这一结果表明,提取的原代细胞是成纤维细胞,确保后续实验的可靠性。
2.2 CAF中IL-6的分泌水平CRC中,CAF通常有IL-6的分泌。如图2所示,ELISA实验显示,CAF的IL-6分泌强于CRC细胞。CAF中IL-6分泌水平高,差异有统计学意义(F=220.2,P<0.05 )。
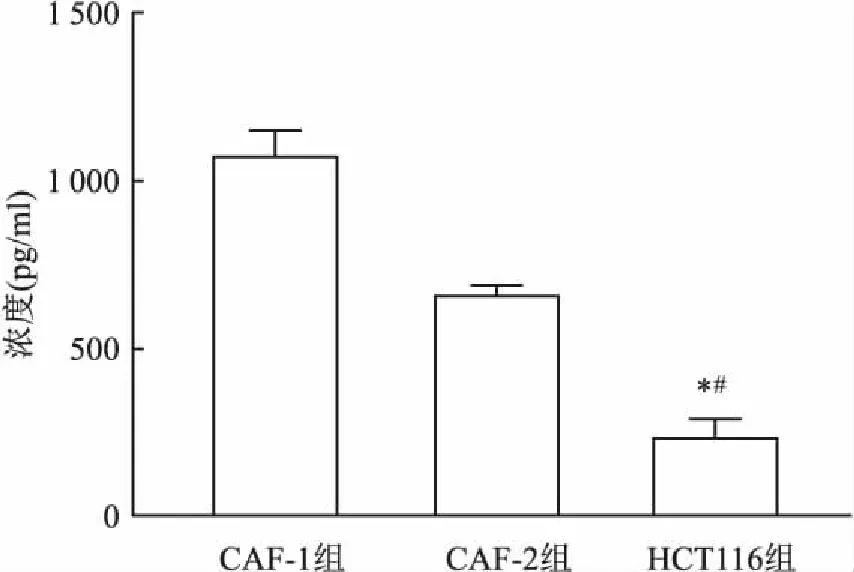
图2 各组细胞IL-6分泌水平
2.3 CAF促进结直肠细胞STAT3信号通路激活为了进一步探究CAF促进CRC侵袭的机制,该研究选择对照组、CAF-1条件培养基组和CAF-2条件培养基组进行Western blot分析。如图3所示,与对照组相比,条件培养基组中人结肠癌肿瘤细胞HCT116的P-STAT3蛋白表达升高,差异有统计学意义(F=39.32,P<0.05)。结果表明CAF可以促进CRC的STAT3信号通路激活。
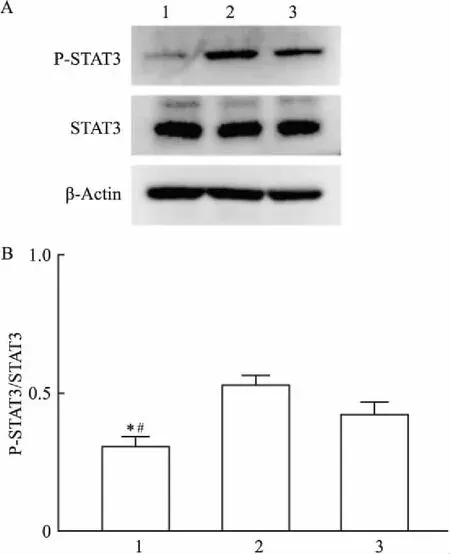
图3 各组细胞P-STAT3、STAT3蛋白表达量
2.4 CAF促进CRC侵袭转移能力提升为了观察CRC细胞侵袭能力的改变,该研究选择对照组、CAF-1条件培养基组和CAF-2条件培养基组进行Western blot、划痕实验和Transwell实验。如图4所示,与对照组相比,条件培养基组HCT116的E-cadherin蛋白表达降低,差异有统计学意义(F=98.27,P<0.05),N-cadherin和Snail蛋白表达升高,差异有统计学意义(FN-cadherin=56.3,FSnail=218,P<0.05)。迁移能力和侵袭能力提升,差异有统计学意义(Fscratch=199.1,Ftranswell=242.9,P<0.05 )。这一结果表明CAF可以促进CRC的侵袭转移能力。
2.5 蟾毒灵对于CAF促转移效应的影响为了研究蟾毒灵对于CAF促转移效应的影响,本研究选择CAF-1条件培养基组、CAF-2条件培养基组、蟾毒灵+CAF-1条件培养基组和蟾毒灵组、蟾毒灵+CAF-2条件培养基组进行试验,其中蟾毒灵浓度为35 nmol/L,作用时间为24 h。如图5A所示,蟾毒灵是蟾蜍毒液中分离的主要生物活性成分。如图5B所示,通过CCK-8实验,为该研究选择出蟾毒灵的非杀伤浓度进行后续实验(IC15=35 nmol/L)。如图5C、D所示,蛋白免疫印迹分析表明蟾毒灵可以抑制CAF条件培养基对于HCT116中STAT3信号通路的激活,蟾毒灵组P-STAT3表达降低,差异有统计学意义(F=159,P<0.05 )。通过蛋白免疫印迹分析、划痕实验和Transwell实验显示蟾毒灵组有效的抑制了CAF促进肿瘤EMT、迁移和侵袭的效应,差异有统计学意义(FE-cadherin=109.8,FN-cadherin=64.53,FSnail=446.6,Fscratch=59.5,Ftranswell=87.31,P<0.05 )。见图5E、F。
3 讨论
肿瘤转移是CRC晚期患者死亡的主要原因。大多数转移性CRC患者的中位生存期仅为2年,远不能令人满意[2]。为改善转移性CRC患者的生存率,近年来越来越多的研究将重点放在对肿瘤转移的机制探讨当中,如潘琪伟 等[7]的研究证明了氧化固醇结合蛋白相关蛋白8(ORP8)能够抑制CRC细胞的增殖、迁移和侵袭,其作用机制可能与阻断EMT有关。
最近的研究[4]表明,肿瘤转移密切依赖于肿瘤细胞与TME的相互作用,这是一个动态的、不断变化的网络。CAF被认为是肿瘤基质中的活化成纤维细胞,有助于恶性肿瘤的发生和发展。大量实验和临床研究[4]支持CAF分泌生长因子来调节原发肿瘤中的肿瘤生长、EMT从而促进转移。然而,CAF促进肿瘤细胞转移的机制还有待确定。
IL-6是一个多功能的细胞因子,能介导对损伤或感染的反应,也参与免疫疾病和癌症的过程中。最近有研究[8]表明,在癌症中,IL-6由癌细胞、炎症细胞和基质细胞产生,在原代CAF的提取后,通过ELISA实验观察到IL-6在CAF中大量产生。IL-6水平升高会刺激STAT3信号通路的过度激活,这通常与肿瘤的EMT和患者预后不良有关[9],本研究通过Western blot实验证明了CAF条件培养基会激活肿瘤细胞的STAT3信号通路。并且肿瘤STAT3信号通路的过度激活会促进IL-6的分泌,形成正反馈,导致整个肿瘤微环境内的IL-6含量进一步增加[10]。根据划痕实验和Transwell实验结果表明,STAT3信号通路激活后会导致肿瘤细胞EMT,并且肿瘤细胞迁移和侵袭能力升高。虽然相较于对照组,CAF-1和CAF-2均促进了肿瘤细胞侵袭,但是促进能力存在差异。结合文献[4]显示,这可能源于CAF存在异质性,细胞因子分泌存在差异。所以靶向STAT3信号通路进行治疗至关重要。近几年在鉴定和开发可应用于临床的STAT3抑制剂方面科学家付出了相当大的努力。然而,鉴于STAT3作为细胞内转录因子的地位,其缺乏酶活性,通常被认为是不可成药,对STAT3可能的抑制剂开发一直很困难[11]。
蟾毒灵是一种中药单体,是从中药蟾酥中分离得到的主要活性成分。在过去的十年,蟾毒灵在各种癌症中展示出杰出的抗肿瘤能力。蟾毒灵的抗癌机制可概括为抑制增殖、促进细胞凋亡、抑制血管生成和转移、逆转耐药性和诱导自噬[12]。最近的研究表明蟾毒灵可以有效抑制STAT3信号通路,Dong et al[13]的实验表明,蟾毒灵能显著降低Mcl-1的表达,并适度降低Bcl-XL的表达水平。这些抗凋亡蛋白的下调与抑制转录因子STAT3的激活密切相关。Wu et al[14]在实验中发现,蟾毒灵在体内和体外均抑制了JAK2和STAT3的磷酸化,进而抑制STAT3信号通路的激活。本研究通过Western blot实验对此进行了验证。通过划痕实验和Transwell实验结果表明,随着STAT3信号通路的抑制,CAF的促侵袭能力得到了抑制。并且根据以往研究[15]显示,蟾毒灵还可以抑制其他促进肿瘤侵袭的信号通路,同时指出蟾毒灵对TME细胞没有直接影响。值得注意的是,与之前关于蟾毒灵的其他抗肿瘤研究相比,该实验选择了较低浓度的蟾毒灵(IC15=35 nmol/L)[6]。实验结果表明低浓度蟾毒灵影响CAF介导的肿瘤转移的机制,并且STAT3信号通路直接作用于肿瘤细胞而不是CAF细胞,体现了蟾毒灵低毒性高效应的特点。
综上所述,本研究通过原代CAF的提取探讨了CAF和肿瘤细胞转移之间的关系,提示STAT3信号通路是肿瘤细胞转移的关键因素,其中可以通过蟾毒灵阻断STAT3信号通路的激活来抑制CAF介导的肿瘤转移。
