生姜皮多糖锌的制备及体外模拟消化研究
2022-09-13李文文王丹董淑君侯丽静张禧庆郑振佳
李文文,王丹,董淑君,侯丽静,张禧庆, ,郑振佳
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;2.龙大食品集团有限公司,山东烟台 265231;3.山东杰诺检测服务有限公司,山东烟台 265200)
生姜,是我国重要的调味品,在我国大部分地区均有种植,年产量约在800 万吨左右。在姜片和姜脯等的初加工过程中会产生大量姜皮,通常作为废弃物丢弃,造成资源浪费和环境污染。生姜多糖具有多种生物活性,例如免疫调节、抗氧化、抗肿瘤、降血糖活性等。生姜皮富含多糖,从其中提取多糖可实现生姜资源的综合利用,增加生姜附加值。
锌是生物体生长发育所必需的微量元素,参与体内多种酶和蛋白质的组成,发挥着重要的生理功能。缺锌会导致生长发育迟缓、免疫失调等一系列疾病。膳食中锌含量不足,且食物中存在锌元素吸收抑制剂,因此新型高效、吸收利用率高的补锌剂具有重要的开发价值。
多糖具有表面络合能力,可与锌离子结合得到多糖锌,有效避免锌离子在胃肠道中产生沉淀,利于提高锌离子的生物接受率。同时,多糖锌兼具锌与多糖两者的生物活性,与无机锌相比,具有高效、稳定、副作用小等优点。因此,对多糖锌开展生物合成及生物活性的相关研究具有重要意义。近年来,多糖锌的相关研究主要集中于降血脂、抗氧化等生物活性的评价分析,多糖锌中锌离子的生物接受率有待深入研究。生姜皮多糖与锌离子复合的研究较少,本研究将生姜皮多糖与硫酸锌螯合,以螯合率为指标明确制备生姜皮多糖锌的最优工艺条件,并通过体外模拟胃肠道消化比较分析硫酸锌和生姜皮多糖锌的消化与吸收情况,为新型补锌剂的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
姜皮 罗平县垠地工贸有限公司;七水合硫酸锌 分析纯,天津市凯通化学试剂有限公司;锌标准储备液(1000 μg/mL)国家检验认证有限公司;人工胃液和肠液 福州飞净生物科技有限公司;硝酸超纯,苏州晶瑞化学股份有限公司;盐酸(优级纯)、氢氧化钠(分析纯)天津市科密欧化学试剂有限公司;透析袋(500 Da)怡康科贸生物试剂耗材实验有限公司。
7800 型电感耦合等离子体质谱仪 美国安捷伦科技公司;Avanti J-15R 型冷冻高效台式离心机 美国贝克曼库尔特有限公司;SECURA224-ICN 型电子天平 赛多利斯科学仪器有限公司;S210 型pH 计梅特勒-托利多仪器有限公司;DKZ-2B 水热恒温振荡水槽 上海一恒科学仪器有限公司;FD-304 冷冻干燥机 济南骏德仪器有限公司;Multiwave PRO微波消解仪 Anton Paar。
1.2 实验方法
1.2.1 生姜皮多糖提取 采用热水浸提法从生姜皮中提取多糖。称取粉碎后的生姜皮2.5 kg,按料液比1:10(g/mL)进行热水回流提取2 h,重复一次,合并滤液,过滤浓缩,醇沉后,5000 r/min 离心10 min,沉淀复溶后加入1/4 体积的Sevag 溶液(氯仿:正丁醇=4:1)处理至中间层无变性蛋白,将上清液醇沉,冻干得生姜皮多糖粉末。
1.2.2 生姜皮多糖锌的制备工艺 采用硫酸锌法制备生姜皮多糖锌复合物。将一定浓度的多糖溶液与硫酸锌溶液等量混合,调节溶液pH,置于一定温度的恒温震荡水槽中反应一定时间,反应完毕后加入4 倍体积的无水乙醇醇沉,5000 r/min 离心10 min,沉淀复溶后于500 Da 透析袋透析48 h,真空冷冻干燥得生姜皮多糖锌。
1.2.3 单因素实验 分别考察反应温度、反应时间、反应pH、多糖与锌质量比四个因素对螯合率的影响。
1.2.3.1 反应温度对螯合率的影响 取0.4 g/L 的锌溶液,按多糖与锌质量比为5:1 进行混合,调整pH为7,分别于30、40、50、60、70 ℃条件下,200 r/min震荡反应100 min,精确移取5 mL 混合液加入20 mL无水乙醇醇沉,离心后取上清液进行锌含量测定,计算螯合率,考察反应温度对螯合率的影响。
1.2.3.2 反应时间对螯合率的影响 取0.4 g/L 的锌溶液,按多糖与锌质量比为5:1 进行混合,调整pH为7,于50 ℃、200 r/min 分别振荡反应30、60、90、120、150 min 后,按“1.2.3.1”进行操作,考察反应时间对螯合率的影响。
1.2.3.3 反应pH 对螯合率的影响 取0.4 g/L 的锌溶液,按多糖与锌质量比为5:1 进行混合,调整pH 为6、7、8、9、10,于50 ℃、200 r/min 振荡反应100 min后,按“1.2.3.1”进行操作,考察pH 对螯合率的影响。
1.2.3.4 多糖与锌质量比对螯合率的影响 取0.4 g/L的锌溶液,分别按多糖与锌质量比为10:1、15:1、20:1、25:1、30:1 进行混合,调整pH 为7,于50 ℃、200 r/min 振荡反应100 min 后,按“1.2.3.1”进行操作,考察多糖与锌质量比对螯合率的影响。
1.2.4 响应面试验 在单因素实验的基础上,选择多糖与锌质量比、反应时间和反应pH 这三个因素,以生姜皮多糖锌的螯合率为响应值,采用Design-Express 8.0.6 软件,以Box-Behnken 设计响应曲面试验方案,对生姜皮多糖锌的制备工艺进行响应面优化设计,响应面试验设计因素与水平如表1 所示。
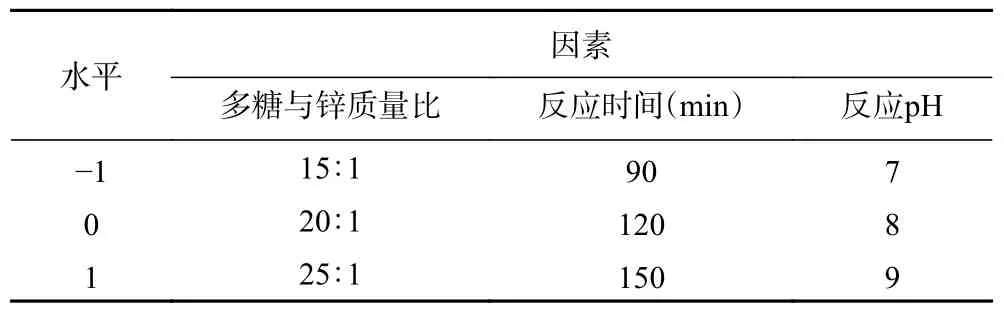
表1 Box-Behnken 试验设计因素水平表Table 1 Factors and coded levels used in Box-Behnken design
1.2.5 螯合率的计算

1.2.6 锌含量的测定
1.2.6.1 锌标曲的绘制 利用锌标准溶液配制成浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL 的锌溶液。电感耦合等离子体质谱仪测定,以锌元素的浓度(X,μg/mL)为横坐标,响应信号值(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=0.989X+0.0072,R=0.9998。
1.2.6.2 锌含量的测定 将生姜皮多糖锌(20 mg)置于50 mL 的试管中,然后加入7.0 mL 的硝酸,室温下保存过夜。消化后,用5%硝酸稀释样品的浓度,电感耦合等离子体质谱仪测定锌含量。
1.2.7 体外模拟消化试验 通过体外模拟消化实验对生姜皮多糖锌和硫酸锌进行生物接受率比较。
体外模拟消化试验参照文献[26]方法并稍做修改:取浓度为5 mg/mL 的生姜皮多糖锌和锌溶液,用1 mol/L 的HCl 调节pH 为2.0,加入等体积模拟胃液混匀,在37 ℃,150 r/min 的恒温水浴振荡器中分别反应0、30、60、90、120、150、180、210、240 min后,于95 ℃沸水浴灭酶处理10 min,在4 ℃保存备用。取模拟胃液消化120 min 的生姜皮多糖锌溶液和硫酸锌溶液冷却至室温,用1 mol/L 的NaOH 调节pH 为7.0,加入等体积的模拟肠液混匀,于2000 Da 的透析袋中透析,在37 ℃,150 r/min 的恒温水浴震荡器中分别反应1、2、4、6、8 h 后,于95 ℃沸水浴灭酶处理10 min,在4 ℃保存备用。
1.2.7.1 锌离子溶解率的测定 分别取胃液消化和肠液消化不同时间的溶液,用4 倍体积的无水乙醇醇沉,5000 r/min 离心10 min 后取上清液,稀释一定倍数,测定上清液中的游离锌离子含量。计算锌离子的溶解率公式如下:

式中:S 表示上清液中锌离子浓度,mg/mL;C 表示样品中锌离子浓度,mg/mL。
1.2.7.2 透析率的测定 经肠液消化后,取透析袋外的溶液,测定溶液中锌离子含量,用来表示透过模拟肠道的锌含量。计算锌离子的透析率公式如下:

式中:A 表示透析液锌离子浓度,μg/mL;V 表示透析液体积,mL;B 表示样品中锌含量,μg/g;M 表示样品的质量,g。
1.3 数据处理
各组实验均重复3 次,结果以平均值±标准差表示,采用Design Expert 8.0.6 和SPSS 25.0 进行数据统计分析,采用Origin 2019 软件绘图。
2 结果与分析
2.1 单因素实验结果
如图1 和表2 所示,生姜皮多糖与硫酸锌的螯合率随反应温度的升高出现先上升后下降的趋势,当反应温度低于60 ℃时,随着反应温度的升高,螯合率从71.35%缓慢提高到72.59%,当反应温度高于60 ℃以后,螯合率缓慢下降。推测是由于高温引起多糖分子间或分子内基团的变化,从而阻碍多糖分子与Zn的配位反应,也可能为过高的反应温度会使多糖分子与Zn运动太快而无法相互结合,解析速度高于结合速度,因此固定反应温度为60 ℃进行后续试验。螯合率随反应时间的增加出现先增高后轻微下降,推测随着反应时间延长,多糖锌稳定性降低,可能会出现解离现象,致使螯合率下降,因此选择反应时间为90~150 min进行后续试验。当反应pH 过低或过高时均会导致螯合率下降,原因推测为在酸性条件下高浓度的H与Zn在结合多糖中的羟基或羧基时产生竞争作用,阻碍其与多糖结合;碱性条件下,Zn形成沉淀,从而降低螯合率,当pH 为8 时,螯合率达到最大值92.47%。因此,选择反应pH 为7~9 进行后续试验。多糖与锌质量比对螯合率的影响呈现出先上升后趋于平缓的趋势,当质量比超过25:1 时,溶液粘稠度增大,使得结合位点暴露减少,阻碍了Zn与多糖结合,导致螯合率增幅趋于平缓。考虑多糖与锌质量比过大会导致多糖的浪费,质量比过小会导致硫酸锌的浪费,因此选择质量比为15:1~25:1 进行后续试验。

表2 各因素水平及对应数值Table 2 Level of each factors and corresponding values
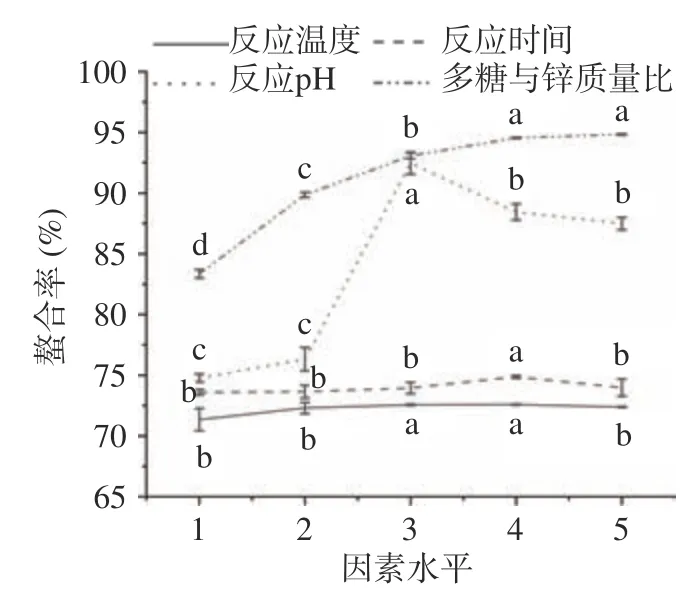
图1 各因素对螯合率的影响(n=3)Fig.1 Influence of the various factors on the chelation rate(n=3)
2.2 响应面试验结果分析
2.2.1 响应面模型的建立与分析 响应面试验结果见表3,方差分析结果见表4。由Design Expert 8.0.6.1 软件对实验数据进行回归分析,得到三元二次回归方程为Y=99.10+1.66A−0.58B+0.70C+1.01AB−0.63AC−0.093BC−1.06A−1.15B−2.70C。如表3 所示,对回归模型进行方差分析,该模型显著(<0.01),失拟项不显著(>0.05),决定系数R为0.9915,校正后决定系数R为0.9805,说明该回归方程拟合度和可信度均较高,可利用此模型对生姜皮多糖和硫酸锌的螯合率进行预测。

表3 响应面优化试验设计及结果Table 3 Response surface optimization test design and results
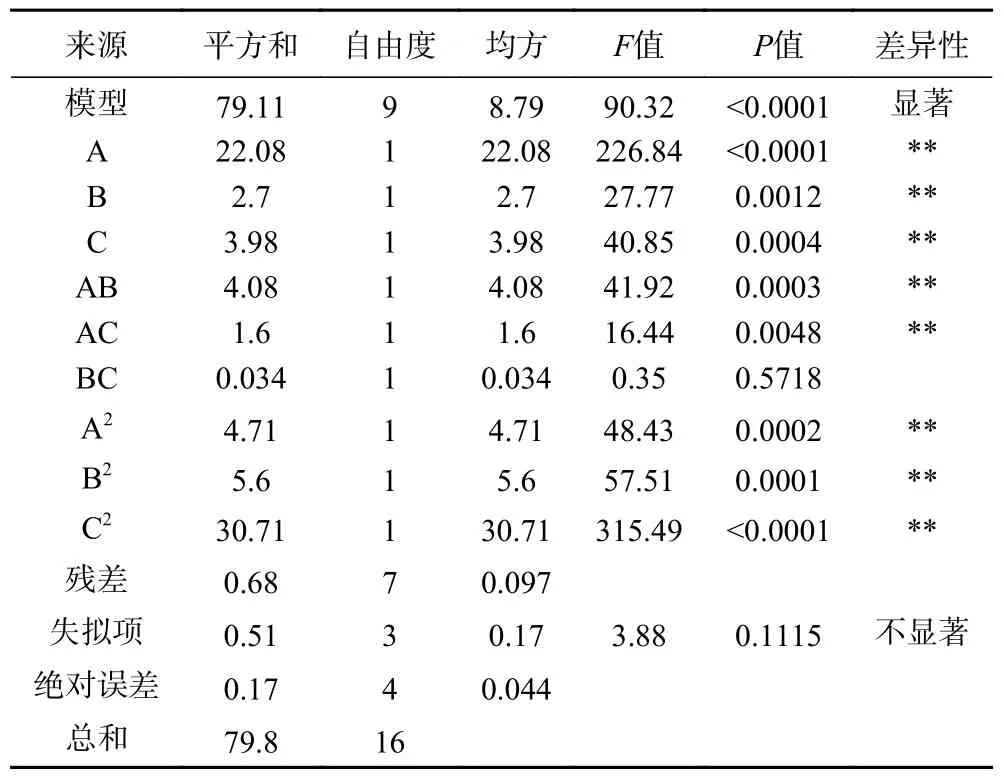
表4 回归模型方差分析Table 4 Analysis of variance of regression model
从表4 中可以看出,一次项A、B、C,交互项AB、AC 和二次项A、B、C对螯合作用的影响极显著(<0.01),交互项AB 对螯合作用的影响显著(<0.05)。BC 项对螯合作用影响不显著(>0.05),将其从回归模型中删除。因此,最终回归模型为:Y=99.10+1.66A−0.58B+0.70C+1.01AB−0.63AC−1.06A−1.15B−2.70C。
2.2.2 响应面图分析 应用统计分析软件绘制两两因素之间交互影响的响应面图,各因素交互影响效果见图2。图2A 中,随着多糖与锌质量比和反应时间水平的增加,螯合率呈现出先上升后下降的趋势,且其二维等高线图偏椭圆型,判断两个因素之间交互作用显著;图2B 中,随着多糖与锌质量比和反应pH水平的增加,螯合率呈现出先升高后下降的趋势,且其二维等高线图偏椭圆型,判断两个因素之间有一定的交互作用;图2C 中,随着反应时间和反应pH 水平的增加,螯合率呈现先上升后下降的趋势,等高线图接近圆形,表明交互作用对响应值的影响不显著。由表4 可知,AB、AC、BC 项的值分别为0.0003<0.05、0.0048<0.05、0.5718>0.05,等高线图与值代表的交互作用对响应值影响程度相一致。

图2 各因素交互作用影响面立体分析图和等高线图Fig.2 Stereo analysis diagram and contour diagram of influence surface influenced by interaction of various factors
2.2.3 回归模型验证试验 由回归模型方程计算可知,当A=24.14,B=123.28,C=8.03 时,Y 出现极大值。即当多糖与锌质量比为24.14:1,反应时间为123.28 min,反应pH 为8.03 时,预测螯合率最大值为99.76%。为方便操作,选择以下试验条件进行验证试验:多糖与锌质量比为24:1,反应时间为125 min,反应pH8,所得螯合率为98.53%±0.31%,达到预测值的98.77%,说明该工艺稳定可靠,可用于生产实践。根据响应面优化试验所得的最优条件制备生姜皮多糖锌,利用电感耦合等离子体质谱仪测定锌含量为21.17±0.25 mg/g。
2.3 生姜皮多糖锌和硫酸锌的体外消化特性
2.3.1 两种锌源在模拟胃液中的消化情况 生姜皮多糖锌和硫酸锌在模拟胃液中锌离子溶解率随着消化时间的变化情况见图3。在整个胃消化过程中,硫酸锌的锌离子溶解率稳定在55%左右。而生姜皮多糖锌在0~60 min 消化初期,其溶解率处于一个平稳的状态,维持在8%左右,但在消化的中期和后期,溶解率呈现出先上升后下降的趋势。硫酸锌的锌离子终溶解率为55.79%高于生姜皮多糖锌的8.35%。结果表明,酸性环境有利于锌离子的溶解与释放,硫酸锌显示出较好的锌离子溶解性;与硫酸锌相比,生姜皮多糖锌在胃液酸性环境下释放较少,推测原因为螯合锌具有较稳定的配位键,具有一定的抗胃液消化特性。随着消化时间的延长,生姜皮多糖锌在胃液中的锌离子溶解率下降,推测原因为锌离子与胃液其它成分进行了结合。

图3 锌溶解率在胃液中随消化时间的变化(n=3)Fig.3 Variation of solubility of zinc in gastric juice with digestion time (n=3)
2.3.2 两种锌源在模拟肠液中的消化与吸收情况生姜皮多糖锌和硫酸锌在模拟肠液中锌离子的溶解率和透析率随消化时间的变化情况见图4 和图5。图4 显示生姜皮多糖锌和硫酸锌的锌离子溶解率均随着消化时间的增加而逐渐减小,8 h 后分别降至1.16%和0.01%。在模拟肠液中硫酸锌和生姜皮多糖锌的锌离子溶解率呈逐渐下降的趋势,原因为在肠液偏碱性的环境下,不利于游离锌离子的存在。图5 显示生姜皮多糖锌的锌离子透析率可达到14.04%左右,远高于硫酸锌的0.60%。其原因可能是硫酸锌受肠液环境的影响易形成不溶性组分,无法透过透析袋,导致锌离子透析率下降;而生姜皮多糖锌具有较稳定的配位键,可在多糖的保护下通过透析袋。多糖锌在模拟肠液中的锌溶解率和透析率均高于无机锌,这一发现与Wang 等结论一致。锌的主要吸收部位为十二指肠,在肠道中锌的溶解率高有利于被人体吸收,综上表明生姜皮多糖锌较硫酸锌具有更高的稳定性和生物接受率,有潜力作为一种新型锌补充剂。

图4 锌溶解率在肠液中随消化时间的变化(n=3)Fig.4 Changes of zinc solubility in intestinal fluid with digestion time (n=3)

图5 锌透析率在肠液中随消化时间的变化(n=3)Fig.5 Changes of zinc dialysis rate in intestinal fluid with digestion time (n=3)
3 结论
本研究通过单因素结合响应面试验确定了生姜皮多糖锌的最佳工艺条件为反应温度60 ℃,反应时间125 min,反应pH8,多糖与锌质量比24:1。在此条件下螯合率可达98.53%±0.31%,以此条件制备得到的生姜皮多糖锌中锌含量为21.17±0.25 mg/g。体外消化模拟实验表明硫酸锌的锌溶解率受胃液的酸化影响较大,生姜皮多糖锌结构稳定且受胃液酸化环境影响较小。在模拟肠液中生姜皮多糖锌的锌离子溶解率和和透析率均高于硫酸锌。与硫酸锌相比,生姜皮多糖锌在胃液消化过程中稳定性较好,同时有效避免了无机锌在肠道中吸收较低的问题,提高了锌的生物接受率,具有作为新型锌补充剂的开发潜力。
