大麻二酚通过调节脑内AMPA受体表达改善痴呆模型大鼠认知损害
2022-09-01周珊珊刘晓朦ElonaKhasanova武继婷李子欣张黎明
周珊珊, 刘晓朦, Elona Khasanova, 武继婷, 李子欣, 周 悦, 张黎明
老年痴呆是卫生领域重大疾病,给社会和家庭带来沉重负担。从1990年到2016年,全球老年痴呆症患者数量增长了一倍多,主要原因是人口增长和老龄化[1]。阿尔茨海默病(Alzheimer’s disease,AD)是最常见的老年痴呆类型。随着人口的老龄化的加剧,AD患病率迅速攀升,预计到2050年,中国AD患病人口将超过2000万,是世界上AD患病人口最多、增长速度最快的地区[2]。目前AD的治疗手段有限,仅有的几种口服药物,常难以达到满意的效果。2021年美国加速批准上市针对β淀粉样蛋白(amyloid protein β,Aβ)的AD治疗药物——阿杜那(Aduhelm)单抗因昂贵的价格和严重的副作用备受争议[3]。
大麻二酚(cannabidiol,CBD)是从大麻植物中提取的一种化学物质,但它与大麻的另一种化学成分四氢大麻酚(tetrahydrocannabinol,THC)不同,CBD没有致幻作用。既往研究表明,CBD在癫痫、抑郁症、多发性硬化和帕金森病中通过抗氧化、抗炎等多种方式发挥神经保护作用[4]。近几年,CBD在AD中的作用成为研究热点,进一步探讨CBD改善AD认知障碍的作用机制,为CBD的临床应用提供理论依据势在必行[5]。本研究探讨了CBD对链脲菌素(streptozotocin,STZ)诱导的认知损害模型大鼠认知功能和脑内α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor,AMPAR)表达的变化。旨在探讨CBD改善认知障碍的潜在机制,为CBD防治AD提供理论依据。
1 材料和方法
1.1 实验材料及主要试剂 CBD(上海麦克林生化科技有限公司,C875838),STZ(美国Sigma公司,V900890),兔抗大鼠多克隆GluR1和GluR2抗体(一抗,美国Affinity生物科技公司,AF6306,AF6307),内参抗体 β-actin(一抗,沈阳万类生物科技有限公司,WL01845),全蛋白提取试剂盒(沈阳万类生物科技有限公司,WLA019),BCA蛋白浓度测定试剂盒(沈阳万类生物科技有限公司,WLA004),辣根过氧化物酶标记羊抗兔IgG(二抗,沈阳万类生物科技有限公司,WLA023)。
1.2 实验动物及给药方法 所有动物实验均在哈尔滨医科大学附属第一医院实验动物伦理委员会批准和监督下实施(伦理学审批编号:2020-075)。成年雄性SD大鼠40只,购于哈尔滨医科大学附属第二医院实验动物中心,动物合格证号:SCXK(黑)2019-001。体重300~350 g。按每组10只随机分为4组:假手术组(S),CBD+假手术组(CBD+S),模型组(STZ),CBD+模型组(CBD+STZ)。CBD和吐温80按1∶1溶解后加入生理盐水稀释至浓度为1%的CBD溶液。CBD+S和CBD+STZ组大鼠按10 mg/kg给与CBD溶液每日一次腹腔注射,共28 d。其余两组每日给与等量溶剂腹腔注射。
1.3 双侧脑室内注射STZ诱导的认知损害模型的建立 依照文献[6]的方法制模:10%水合氯醛3 ml/kg 腹腔注射麻醉,将大鼠头部固定于立体定位仪上,沿头部正中线做矢状切口,分离皮下组织暴露颅骨。取前囟后0.8 mm,左右旁开1.6 mm颅骨打孔,垂直深度4.0 mm微量加样器缓慢 双侧脑室内注射STZ 3 mg/kg。注入的STZ生理盐水溶液体积控制在10 μl左右,假 手术组脑室内注射相应体积的生理盐水。注射完毕用骨蜡封填颅骨缺损,缝合头皮。48 h后重复上述手术注药过程。
1.4 Morris水迷宫试验 造模28 d后进行Morris水迷宫测试大鼠学习和记忆能力[7]。水迷宫是一个直径150 cm,高60 cm充满水的圆形不锈钢水池,水池壁为黑色,水池分为4个象限。逃逸平台是一个透明的直径为10 cm的可移动圆柱形平台,其表面距水面2 cm。在测试中将平台放置在任一象限,选择某个象限将大鼠面朝池壁放入水中。大鼠到达平台后令其在平台停留30 s,然后继续下一次训练。每次寻找平台时间不超过60 s,记录大鼠每次到达平台所用的时间(逃逸潜伏期),60 s内未找到平台逃逸潜伏期按60 s记录。每天训练4次,共训练5 d。
1.5 跳台试验 水迷宫试验后进行跳台试验评价各组大鼠的学习记忆能力。跳台试验箱大小为25 cm ×25 cm ×75 cm,箱底铺满金属方格网,在箱底一角放置一个高5cm,直径8cm的安全平台。首日将大鼠放在安全平台上,当大鼠跳下平台,四肢会受到电击(3 Hz,0.4 mA),经过反复的跳上跳下,大鼠最终会停留在平台上,实验时间为300 s。次日重复相同的实验并记录大鼠第一次跳下平台的时 间(潜伏期)和300 s内大鼠从平台跳下的次数(错误次数)。
1.6 Western-blot检测AMPAR表达 按试剂说明书抽提总蛋白质。制备标准曲线,制备蛋白质待测液,BCA反应,以标准蛋白浓度及对应吸光值绘制标准曲线,并通过回归方程计算样本蛋白浓度,并乘以稀释倍数,即为样本的蛋白浓度。根据目的蛋白分子量大小选用对应浓度的聚丙烯酰胺凝胶,电泳分离蛋白质(40 μg)转移至PVDF膜。用TBST缓冲液配制的5%(M/V)脱脂奶粉封闭后,孵育GluR1(1∶1000)和GluR2(1∶1000)一抗,4℃过夜。孵育二抗(1∶5000),37 ℃,45 min,以超敏ECL试剂显影拍照。将胶片进行扫描,用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.7 统计学方法 应用SPSS 24.0软件对数据进行统计学分析,正态分布的计量资料以均值±标准差表示。多组间比较应用单因素方差分析(ANOVA),方差齐性时,用LSD检验进行两两比较,方差不齐时,组间比较用Dunnett’s T3。以P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫 Morris水迷宫试验中,各组大鼠1 d至5 d平均逃逸潜伏期(s)呈逐渐缩短趋势。5 d逃逸潜伏期(s)结果为:S组(13.00±5.40),CBD+S组(14.00±3.77),STZ组(41.3±5.29),CBD+STZ组(21.4±5.52)。STZ组与S组比较,逃逸潜伏期显著延长(P<0.01);CBD+STZ组与STZ组比较,逃逸潜伏期显著缩短(P<0.01);S组与CBD+S组比较差异无统计学意义(P>0.05)(见图1)。
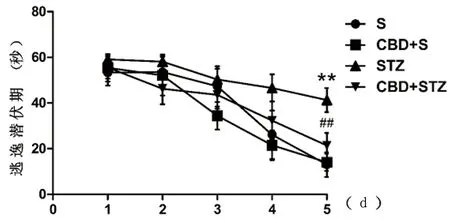
与S组比较**P<0.01;与STZ组比较##P<0.01
2.2 跳台试验 跳台试验中,各组大鼠潜伏期(s)结果为:S组(275.90±30.74),CBD+S组(265.50±34.60),STZ组(207.70±37.08),CBD+STZ组(244.60±41.59)。STZ组与S组比较,潜伏期显著缩短(P<0.01);CBD+STZ组与STZ组比较,潜伏期显著延长(P<0.05);S组与CBD+S组比较差异无统计学意义(P>0.05)。(见图2A)。各组大鼠错误次数(次)结果为:S组(2.10±2.47),CBD+S组(2.80±2.53),STZ组(5.40±1.71),CBD+STZ组(3.20±2.35)。STZ组与S组比较,错误次数显著增加(P<0.01);CBD+STZ组与STZ组比较,错误次数显著减少(P<0.05);S组与CBD+S组比较差异无统计学意义(P>0.05)(见图2B)。
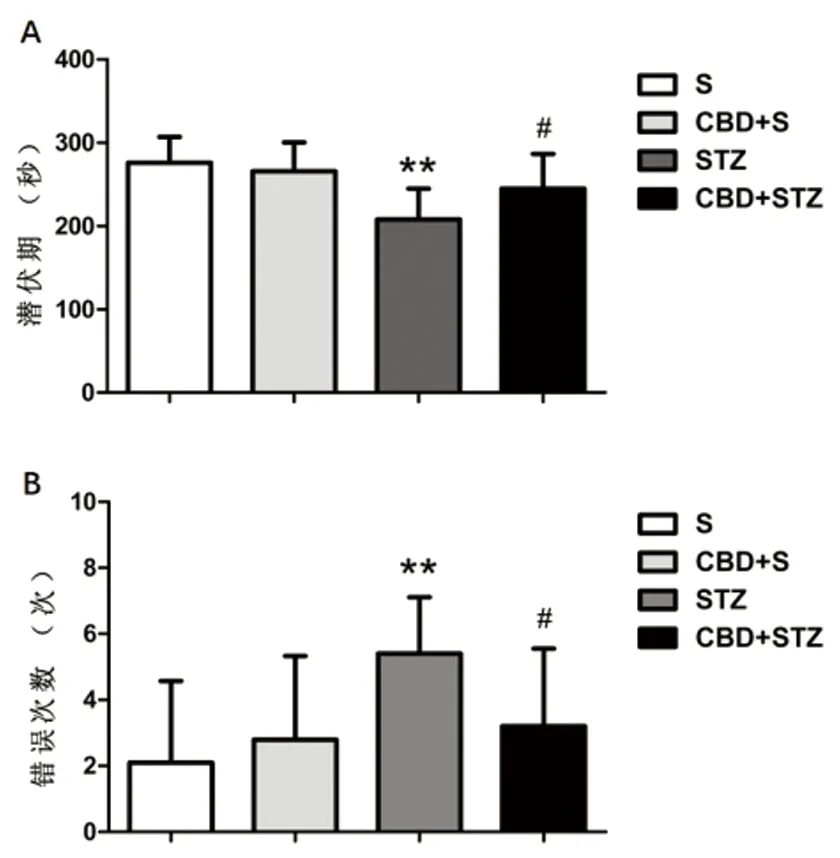
与S组比较**P<0.01;与STZ组比较#P<0.05
2.3 Western-blot检测AMPAR表达 各组大鼠皮质和海马GluR1相对表达量分别为:S组(0.52±0.06)、(0.54±0.05),CBD+S组(0.44±0.06)、(0.43±0.12),STZ组(1.03±0.18)、(1.36±0.24),CBD+STZ组(0.82±0.06)、(0.99±0.09)。STZ组与S组比较,皮质和海马的GluR1表达均显著增加(P<0.01)、(P<0.01);CBD+STZ组与STZ组比较,皮质和海马的GluR1表达均显著减少(P<0.01)、(P<0.05)。S组与CBD+S组比较差异无统计学意义(P>0.05)(见图3)。各组大鼠皮质和海马GluR2相对表达量分别为:S组(0.55±0.07)、(0.52±0.16),CBD+S组(0.39±0.12)、(0.44±0.06),STZ组(1.36±0.07)、(1.05±0.15),CBD+STZ组(0.86±0.19)、(0.82±0.08)。STZ组与S组比较,皮质和海马的GluR2表达均显著增加(P<0.01)、(P<0.01);CBD+STZ组与STZ组比较,皮质和海马的GluR2表达均显著减少(P<0.01)、(P<0.01)。S组与CBD+S组比较差异无统计学意义(P>0.05)(见图3)。
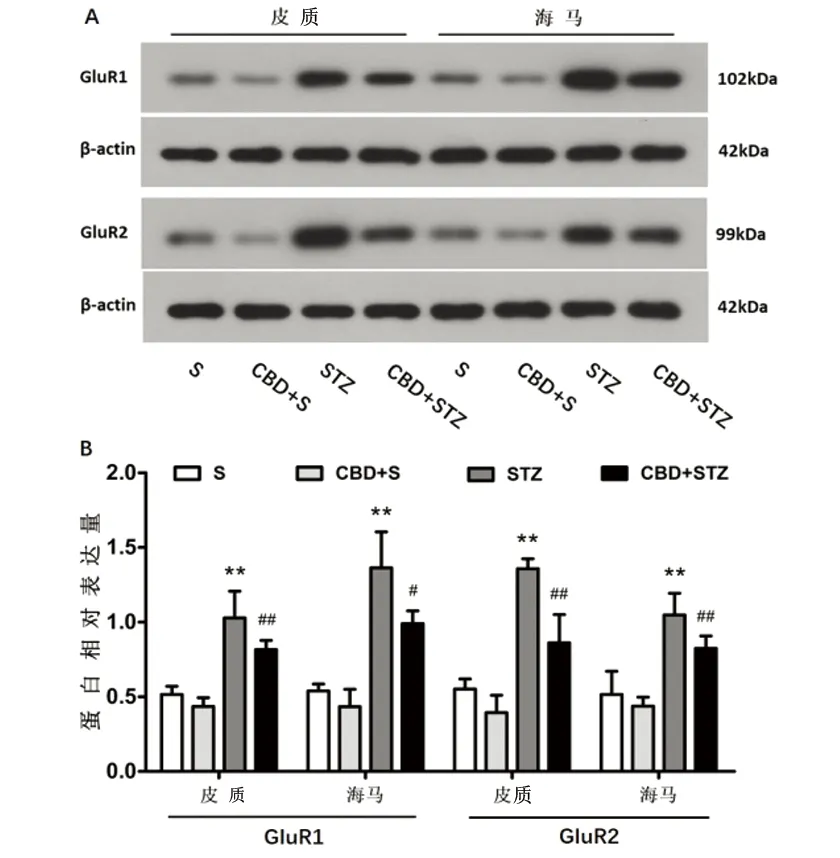
与S组比较**P<0.01;与STZ组比较#P<0.05;与STZ组比较##P<0.01
3 讨 论
AD发病机制不清,可能的机制包括β淀粉样蛋白级联假说,过度磷酸化tau蛋白引起的神经原纤维缠结,炎性机制,线粒体功能障碍,兴奋性毒性和突触功能障碍等。目前,常用于AD治疗的药物包括胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂,AD 的新药研发进展缓慢。曾被人们寄予厚望的Aβ抗体以及tau蛋白聚集抑制剂的相关临床试验都以失败告终[8,9]。随着痴呆患者数量不断增加以及患者和家属对认知功能改善的迫切需求,开发廉价有效的治疗方法已成为当务之急。
CBD是一种在大麻中发现的植物大麻素,其脂溶性较高,容易通过血脑屏障。与四氢大麻酚(Tetrahydrocannabinol,THC)不同,CBD没有致幻作用和成瘾性[10]。已有研究表明CBD具有抗氧化应激,抗炎,促进神经发生等药理作用[4]。2018年6月,首个CBD药物Epidiolex®被批准用于治疗难治性癫痫[11]。除癫痫外,CBD在焦虑抑郁,多发性硬化和帕金森病等多种神经系统疾病中通过多种方式发挥神经保护作用[4]。针对AD多种复杂的发病机制,单一作用于疾病某一环节很难有好的治疗效果,而CBD这种可以作用于多个靶点的药物可能在AD的防治中更具有潜力。
体外研究发现,CBD具有抗炎、抗氧化和神经保护作用,可防止海马和皮质神经退行性变,减少tau蛋白过度磷酸化,并调节小胶质细胞迁移[5]。此外,CBD被证明可以预防Aβ介导的神经毒性和小胶质细胞激活的神经毒性,通过诱导APP泛素化减少Aβ的生成,并且CBD可能通过与PPARγ的相互作用逆转Aβ诱导的长时程增强减弱[12]。然而,CBD在AD中的体内研究还相对较少,尤其是CBD对认知障碍动物模型脑内谷氨酸传递的作用鲜有报道。本研究观察了STZ诱导的认知障碍模型大鼠脑内AMPAR的表达变化以及CBD的作用,旨在探讨CBD改善认知作用的新靶点。
STZ是一种氨基葡萄糖化合物代谢后产生的细胞毒性产物,它能够诱导胰腺β细胞损伤。在大鼠双侧脑室内注射亚致糖尿病剂量的STZ被认为是一种散发AD动物模型,可导致认知功能障碍,脑内葡萄糖和能量代谢受损,氧化应激增加,谷氨酸兴奋性毒性增加和tau蛋白过度磷酸化等类似AD的病理变化[13,14]。本研究应用双侧脑室内注射STZ建立大鼠认知障碍模型,给与CBD治疗,通过Morris水迷宫和跳台实验测试发现CBD干预后大鼠学习记忆能力明显改善。
神经递质失衡,兴奋性毒性和突触丧失被认为是认知功能障碍长期存在的原因。对APPswe/PS1dE9转基因小鼠的皮质神经元的研究发现,在病理进展的早期和晚期阶段神经兴奋性是不同的:幼龄期表现为低兴奋性,老龄期表现为高兴奋性;超兴奋性的原因可能是兴奋性谷氨酸受体上调和网络抑制减少的结果[15]。除此之外,Nakajima等研究发现AMPAR阻滞剂(吡仑帕奈)可改善动物卒中后认知障碍[16]。最近的研究显示STZ诱导的认知障碍大鼠脑内谷氨酸含量增加[14],本研究发现双侧脑室注射STZ四周后大鼠脑内AMPAR显著增加,提示兴奋性谷氨酸受体的上调在STZ诱导的认知障碍中起作用。
研究发现CBD对AD转基因小鼠认知障碍的改善作用与Aβ负荷减少无关,此外,CBD治疗不会改变皮质脂质氧化水平[5]。多项研究表明CBD 在体内发挥作用与内源性大麻素系统密切相关。内源性大麻素系统包含两种大麻素受体(CB1R和CB2R),CBD对CB1R具有负向别构调节作用,对CB2R具有部分激动作用[17]。然而,选择性CB2激动剂并不能预防认知障碍,这表明CBD通过其他机制发挥改善认知的作用。Poulia等研究发现大麻二酚通过激活ERK1/2逆转氯胺酮引起的大鼠脑内AMPAR增加[18]。本研究观察了CBD对STZ诱导的认知障碍模型大鼠脑内AMPAR表达的影响,结果显示CBD显著降低了STZ诱导的AMPAR表达上调。提示CBD通过减少AMPAR在病理状态下的异常过表达,降低谷氨酸兴奋性毒性,从而改善认知功能。最近的一项研究首次表明CBD可作为AMPAR的负变构调节剂(当AMPAR特异由GluA1/GluA2亚基构成时),CBD显著降低了AMPAR介导的诱发性兴奋性突触后电流(eEPSCs)和微小兴奋性突触后电流(mEPSCs)的振幅和频率,并且显著加速GluA1和GluA2亚基的失活[19]。CBD对AMPAR的上述抑制作用依赖于其与GluA1/GluA2 N-末端结构域的相互作用。
综上,病理状态下AMPAR表达的上调可能是机体促进神经突触传递和突触可塑性正常化的代偿机制。然而,上调的AMPAR增加了脑内谷氨酸兴奋性毒性,出现细胞内钙累积,导致细胞稳态的破坏和脑组织的结构损伤。CBD通过调控AMPAR表达改善认知障碍的作用提示AMPAR可能是CBD的重要作用靶点,其改善认知作用的具体机制值得深入研究。
