低氧胁迫和螺原体感染对中华绒螯蟹存活和细胞凋亡的影响
2022-08-30汪雅琴缪艳阳陆银月孟庆国
汪雅琴 黄 晨 耿 超 缪艳阳 陆银月 顾 伟 王 文 孟庆国
(南京师范大学海洋科学与工程学院, 江苏省水生甲壳动物病害重点实验室, 南京 210023)
水体溶解氧(Dissolved oxygen, DO)来源于大气中的氧气与水面接触和水生生物的光合作用, 由于来源不稳定, 水体中溶解氧的含量并不高, 且易受外界影响而扩散慢[1]。正常情况下, 认为发生低氧时水体溶氧量小于2 mg/L[2]。人为因素和自然因素是导致水低氧的重要原因。自然因素包括温度的骤变、昼夜交替、季节和水流速度的变化等。但人为影响是造成低氧的更重要原因, 随着人口的增加, 大量营养物质被排入水体, 水体富营养化, 水中藻类大量繁殖, 加剧了溶解氧的消耗。此外, 养殖业快速发展, 但人工管理尚不完善, 未将残留饲料和排泄物及时处理, 这类物质在高温时节的腐败分解使得水体处于缺氧状态[3]。陈付菊等[4]研究发现重度低氧胁迫会使青海湖裸鲤肝血窦扩张, 血窦内红细胞数量增多, 肝细胞出现空泡化, 并且空泡化程度随着低氧时间的增长而加深。蔡超等[5]研究表明, 低氧胁迫能使鲫血红蛋白和血糖浓度升高,还会影响鳃、血液、肝脏、心脏和脑中与能量代谢和转化相关的酶的活力。吴煜国等[6]发现, 长期低氧胁迫会影响斑马鱼的卵巢发育, 进一步影响卵母细胞的发育成熟。由以上相关实验可以看出, 低氧胁迫在水生生物的生活与生存中有着重要影响。
中华绒螯蟹(Eriocheir sinensis)又被称为河蟹,是我国传统的水产珍品, 螺原体所引起的“颤抖病”对河蟹产业造成了严重危害。而关于低氧是否会对螺原体感染河蟹产生影响, 这一问题亟待研究,因为河蟹螺原体的靶细胞为血淋巴细胞, 所以本文将低氧胁迫与螺原体共同作用于河蟹, 探究它们的协同作用, 将河蟹的血淋巴细胞分离出来进行研究,观察其在低氧状态下的免疫力和生理指标变化, 为河蟹养殖低氧耐受提供新的思路和理论支持。
1 材料与方法
1.1 实验动物和细菌
实验所用河蟹来自江苏省扬州市, 每只河蟹重(25±5) g, 将其在28℃, 溶氧量(6.0±0.5) mg/L的养殖箱中暂养, 检测河蟹螺原体为阴性, 以用于后续实验。
将实验所用螺原体用R2培养基在30℃恒温培养箱中培养, 实验所用均为生长至对数期的螺原体。
1.2 螺原体与低氧刺激后河蟹螺原体拷贝数和死亡率计算
为了探究低氧胁迫对螺原体致死率的影响,(1) 设置不同部分组别: PBS+常氧组(N PBS), PBS+低氧胁迫组(H PBS), 螺原体+常氧组(N SE), 螺原体+低氧胁迫组(H SE), 每组设置两个重复水槽, 每个水槽20只螃蟹。常氧组溶氧量为[(6.0±0.5) mg/L],低氧胁迫组溶氧量为(1.5±0.5) mg/mL, 使用溶氧仪(Bante821, China)实时监测各组水体含氧量。(2) 将对数期的螺原体12000 r/min离心10min, 去掉上清,收集备用。(3) 将螺原体用适量PBS缓冲液重悬, 在实验组的河蟹第五附肢处注射200 μL螺原体, 对照组的河蟹注射200 μL PBS。(4) 每日记录河蟹死亡情况。
为了探究低氧胁迫对河蟹体内螺原体拷贝数的影响, (1) 设置与上步实验相同的组别。(2) 在螺原体感染河蟹后的2d、4d、6d和8d取500 μL血细胞与抗凝剂等比例混合, 每个样品取3—5只河蟹,提取DNA并检测浓度, 将所得DNA的浓度均稀释至10 ng/μL。 (3) 进行RT-qPCR, 具体反应体系及程序参考陆银月等[7]的文献。所用上游引物(10 μmol/L): Q-SE-F: 5′-CGCAGACGGTTTAGCA AGTTTGGG-3′; 下游引物(10 μmol/L): Q-SE-R: 5′-AGCACCGAACTTAGTCCGACAC-3′。使用以下公式计算螺原体拷贝数:
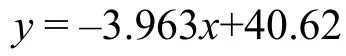
式中,y为实验所得Ct值,x为lgcopy number。
1.3 血淋巴细胞PI染色
(1) 用PBS缓冲液将PI溶液稀释, 使终浓度为10 μmol/L。(2) 在开始实验的2d、4d、6d和8d, 分别随机挑选3只河蟹, 取血细胞与500 μL抗凝剂等比例混合, 离心收集血细胞。(3) 用PBS缓冲液重悬细胞。(4) 加入10 μL PI溶液重悬细胞, 在37℃避光孵育20min。(5) 孵育结束后, 用PBS重悬细胞, 洗去残留的PI溶液, 使用荧光显微镜观察细胞染色情况[7]。
1.4 血淋巴细胞FITC/PI检测
磷脂结合蛋白可与外翻的复合神经酸(Phosphatidylserine, PS)结合, 通过与PI共染色, 区分凋亡细胞(绿色荧光)与坏死细胞(红色荧光)[7]以检测早期细胞凋亡。
(1) 在实验后的2d、4d、6d和8d随机挑选3只河蟹, 取血细胞与500 μL抗凝剂等比例混合, 离心收集血细胞。(2) 用PBS缓冲液重悬细胞。(3) 用100 μL 1×Binding Buffer将细胞吹打混匀。(4) 加入5 μL PI Staining Solution和5 μL Annexin V-FITC,混匀后在室温下孵育10min, 再用400 μL 1×Binding Buffer将细胞吹打混匀, 置于显微镜下观察。
1.5 血淋巴细胞的线粒体膜电位检测
线粒体膜电位的变化可以判断细胞是否发生凋亡, Rhodamine123进入线粒体基质是以穿过细胞膜的方式, 线粒体膜的完整性会在血淋巴细胞发生凋亡时遭到破坏, 从而使线粒体跨膜电位发生紊乱,可以观察到Rhodamina 123发出黄绿色荧光[7]。
(1)用DMSO配制5 mmol/L的Rhodamina 123试剂。(2) 在实验后的2d、4d、6d和8d抽取河蟹血细胞与500 μL抗凝剂等比例混合, 使用缓冲液吹洗细胞一到两次并收集细胞。(3)用100 μL Rhodamina 123对细胞进行重悬, 在37℃避光孵育30min。(4) 再次用缓冲液重悬细胞1—2次, 置于显微镜下观察。
1.6 HE染色
在低氧胁迫处理后第8天, 从未注射螺原体的低氧胁迫组和常氧组中各随机挑选3只河蟹, 在无菌环境下提取其肝胰腺组织和鳃组织, 并用适量4%动物组织固定液将其固定, 然后送至生物公司制备组织切片[7]。
2 结果
2.1 低氧胁迫对河蟹鳃组织和肝胰腺组织的影响
在低氧处理后第8天, 对河蟹的肝胰腺组织和鳃组织进行HE染色并观察其结构变化。观察相应结果显示, 肝胰腺对照组(图 1A)中, 肝细胞均匀分布, 结构稳定, 形态正常, 基底膜与上皮细胞紧密相连且厚度均匀; 而在肝胰腺实验组(图 1B)中, 肝胰腺呈弥散状, 管腔外围出现致密小空泡, 基底膜厚度增加并脱离上皮细胞。在鳃组织中, 常氧组(图 1C)的鳃叶分布均匀, 排列整齐, 鳃轴结构完整, 形态稳定; 而在低氧组(图 1D)中, 鳃轴结构遭到破坏, 但鳃叶损伤较小, 说明低氧处理主要影响鳃轴, 而对鳃叶影响较小。
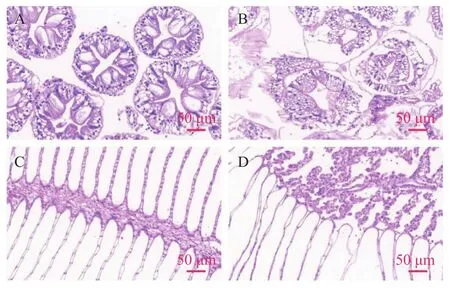
图1 低氧胁迫8d后对中华绒螯蟹肝胰腺和鳃组织结构HE染色(50 μm)Fig. 1 HE staining of hepatopancreas and gills of E. sinensis after 8d of hypoxia stress (50 μm)
2.2 低氧和螺原体刺激对中华绒螯蟹死亡率的影响
图2显示, 低氧胁迫和螺原体共同作用的实验组死亡率增加, 在第10天时, 河蟹全部死亡; 在仅有螺原体刺激的组中, 河蟹于第6天开始死亡, 并在第9天死亡加剧, 死亡率在第10和第12天分别达到50%和70%; 在仅低氧处理的组中, 河蟹的死亡率在第5天后也逐日增加, 但增加的速度低于仅有螺原体处理的组; 而在对照组中, 相较于其他组, 河蟹死亡率较为低缓。以上结果表明, 被螺原体感染的河蟹死亡速度受低氧胁迫的影响加快, 死亡率升高。
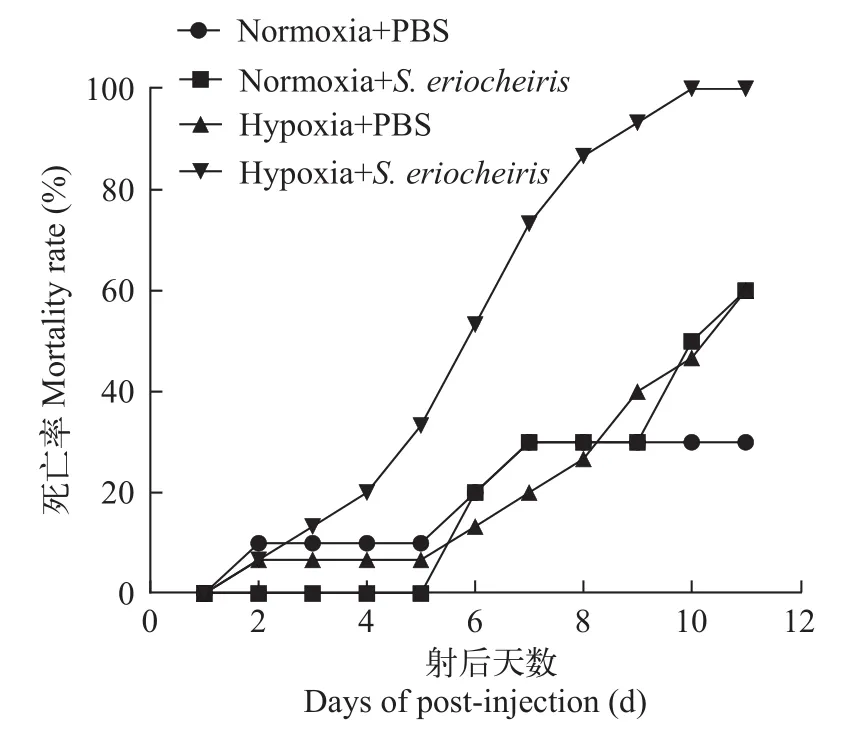
图2 低氧胁迫及螺原体侵染对中华绒螯蟹死亡率的影响Fig. 2 The mortality rate of crabs after hypoxia and S. eriocheiris infection
2.3 低氧胁迫对中华绒螯蟹血淋巴细胞中螺原体拷贝数的影响
为了研究低氧胁迫是否对螺原体的生长繁殖有影响, 使用RT-qPCR检测中华绒螯蟹血淋巴细胞中的螺原体拷贝数变化。如图 3所示, 在螺原体感染后, 相比于常氧组, 低氧组河蟹血淋巴细胞中的螺原体拷贝数明显较高, 综上所述, 河蟹受低氧胁迫后更容易被螺原体感染。
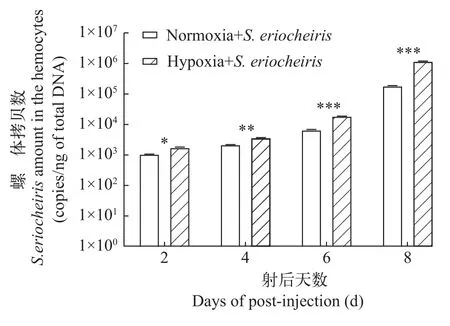
图3 低氧胁迫对血淋巴细胞中螺原体拷贝数的影响Fig. 3 S. eriocheiris copy number in hemocytes after hypoxia
2.4 河蟹血淋巴细胞坏死(PI)受低氧及螺原体侵染的影响
利用PI染色技术来研究在低氧胁迫状态下, 螺原体感染对河蟹血淋巴细胞坏死是否会产生影响。对受低氧胁迫和螺原体刺激后的河蟹于2d、4d、6d和8d分别取样, 进行PI染色, 结果如图 4所示, 随着螺原体感染时间的推移, 带红色荧光细胞的数目逐渐增多。同时将带红色荧光细胞数与总细胞数进行统计, 结果见图 5, 发现低氧胁迫和螺原体共同作用的实验组第4天的血淋巴细胞坏死显著高于对照组, 仅有螺原体刺激的实验组细胞坏死状况则无显著变化, 综上所述, 河蟹血淋巴细胞结构可能受低氧破坏, 从而导致血淋巴细胞坏死发生。

图4 低氧胁迫及螺原体刺激对河蟹血淋巴细胞坏死(PI)的荧光检测Fig. 4 Fluorescence detection of necrosis (PI) in hemocytes of E.sinensis after hypoxia and S. eriocheiris stimulation
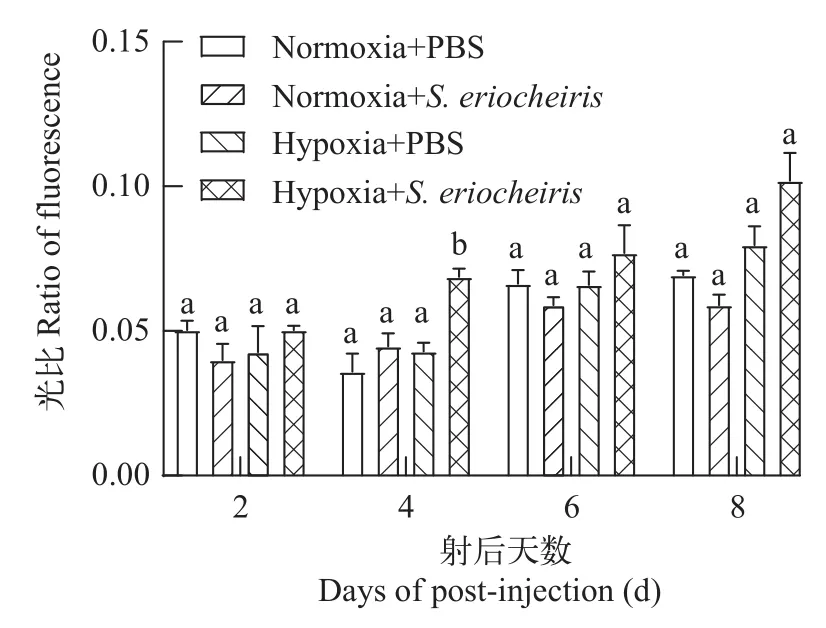
图5 低氧胁迫及螺原体刺激对河蟹血淋巴细胞坏死(PI)的红色荧光占比Fig. 5 Red fluorescence percentage of necrosis (PI) in hemocytes of E. sinensis after hypoxia and S. eriocheiris stimulation
2.5 低氧胁迫及螺原体刺激下河蟹血淋巴细胞凋亡(FITC/PI)情况
根据细胞凋亡试剂盒对河蟹血淋巴细胞进行染色, 观察在低氧胁迫和螺原体刺激下, 血淋巴细胞凋亡情况。对被低氧和螺原体刺激后的河蟹于2d、4d、6d和8d取样, 进行荧光拍照与并统计荧光比例, 如图 6所示, 螺原体感染前期, 细胞开始出现凋亡, 并且随着感染时间的推移, 绿色荧光细胞和红色荧光细胞数量均出现增多。如图 7所示, 同对照组相比, 在低氧胁迫和螺原体刺激的共同作用下,实验组在螺原体侵染前期凋亡现象并不明显, 但在感染后第8天, 与对照组相比, 河蟹细胞凋亡率明显升高, 这说明在低氧胁迫和螺原体刺激的共同作用下, 河蟹血淋巴细胞主动发生凋亡以适应环境变化。

图6 低氧胁迫及螺原体刺激对河蟹血淋巴细胞凋亡(FITC/PI)的荧光检测Fig. 6 Fluorescence Detection of Apoptosis (FITC/PI) in hemocytes of E. sinensis after hypoxia and S. eriocheiris stimulation
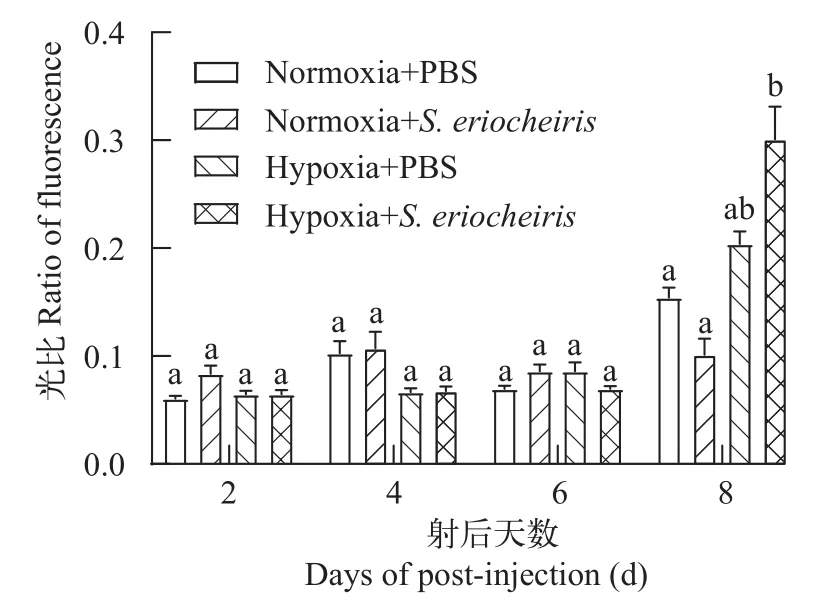
图7 低氧胁迫及螺原体刺激对河蟹血淋巴细胞凋亡(FITC/PI)的绿色荧光占比Fig. 7 Green fluorescence percentage of apoptosis (FITC/PI) in hemocytes of E. sinensis after hypoxia and S. eriocheiris stimulation
2.6 低氧胁迫及螺原体侵染对河蟹血淋巴细胞线粒体膜电位(Rhodamine123)的影响
为研究低氧胁迫及螺原体刺激对河蟹血淋巴细胞线粒体膜电位是否有影响, 使用Rhodamine 123检测河蟹血淋巴细胞的凋亡情况。如图 8所示,在第 2天, 两组带绿色荧光的细胞均较少, 且与对照组相比, 随着实验时间推移, 每个实验组中的荧光量都在逐渐增加。在图 9中, 发现低氧胁迫和螺原体共同作用的组在第4、第6和第8天的荧光比例均高于对照组, 并且随着感染时间的增加, 荧光比例呈现上升趋势, 仅有螺原体刺激的组中, 荧光比也随着感染时间的增长而增加, 且在第8天的时候, 显著高于对照组, 相对于对照组, 仅受低氧刺激的实验组无明显差异。综上所述, 河蟹受低氧和螺原体刺激后, 会为了适应环境变化而改变生存策略。

图8 低氧胁迫及螺原体刺激对河蟹血淋巴线粒体膜电位的荧光检测Fig. 8 Fluorescence detection of mitochondrial membrane potential (Rhodamine 123) in hemocytes of E. sinensis after hypoxia and S. eriocheiris stimulation
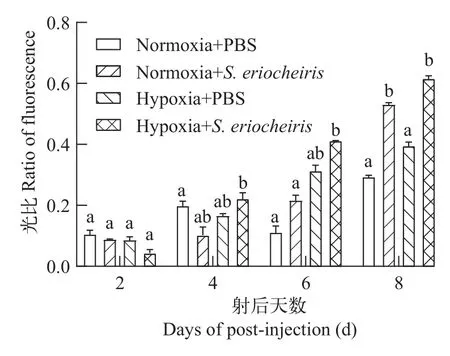
图9 低氧胁迫及螺原体刺激对河蟹血淋巴细胞线粒体膜电位的绿色荧光占比Fig. 9 Green fluorescence percentage of mitochondrial membrane potential in hemocytes of E. sinensis after hypoxia and S.eriocheiris stimulation
3 讨论
一般认为, 溶氧量为4 mg/L左右的水体是适宜中华绒螯蟹生长的环境, 低于2 mg/L溶氧量的水体环境会抑制河蟹的生长蜕壳和变态[8]。本研究发现, 河蟹在长期低氧胁迫状态下, 死亡率和血淋巴细胞内螺原体拷贝数均显著上升。与之相同的是,蓝蟹(C. sapidus)幼体在低溶氧量状态下的死亡率也显著高于对照组[9]。由此可见, 低氧对水生生物的生存生活有着重要影响。
细胞凋亡(Apoptosis)是程序性细胞死亡的严格调控形式, 可触发细胞的自我毁灭而不受任何外部影响。细胞的凋亡和坏死有着本质的区别, 细胞凋亡是一种主动死亡以维持内环境稳定的方式, 当外界环境变化, 细胞受到刺激, 体积缩小, 染色体浓缩,膜上的复合神经酸外翻, 形成能快速被巨噬细胞识别并吞噬的凋亡小体, 并且不会影响周围细胞[10,11]。细胞坏死是外界环境剧烈变化, 强刺激下, 细胞会发生肿胀、破裂, 继而引发周围细胞感染炎症[12]。多数研究表明, 大部分病原菌感染都能引起细胞凋亡和坏死, 由于感染钩端螺旋体(Leptospira), 巨噬细胞的细胞周期停滞, 继而发生凋亡[13]; 红细胞的渗透性会被创伤弧菌溶细胞素破坏溶解, 从而诱导内皮细胞发生细胞凋亡[14]。中性粒细胞在小鼠被鼠伤寒沙门菌(Salmonella typhimurium)[11]感染后发生凋亡, 并且随着时间推移, 细胞坏死率逐渐上升。
在河蟹等无脊椎动物抵御细菌等外来病原体入侵的过程中, 先天免疫系统的作用至关重要, 血淋巴细胞更是其中的重要组成部分[15]。螺原体侵染河蟹的第一个靶细胞是血淋巴细胞, 螺原体在其中生长繁殖后通过血液流动到达河蟹的各个组织,引起河蟹附肢颤抖, 进而引发河蟹死亡[16—18]。在此研究中, 发现河蟹血淋巴细胞坏死率在低氧条件下显著高于对照组, 且低氧胁迫与螺原体共同刺激时,血淋巴细胞在感染后期发生凋亡。与这类似的是,罗氏沼虾的血淋巴细胞受氨和亚硝酸盐刺激时也会发生凋亡[19]。
线粒体是一种双层膜包被的细胞器, 存在于真核细胞中。在细胞凋亡过程中, 线粒体膜通透性的变化起着至关重要的作用。线粒体是细胞制造能量的结构, 其内膜中储存的电化学势能可以引起内膜两侧的离子浓度分布不对称, 从而形成线粒体膜电位(Mitochondrial membrane potential, MMP)[20],线粒体膜电位的下降是细胞凋亡的标志性事件之一。在此实验中, 通过对河蟹血淋巴细胞进行Rhodamine123染色发现, 与常氧组相比, 低氧组的河蟹感染螺原体后的荧光比例显著升高, 并且随着感染时间的增加, 荧光比例呈现上升趋势, 即细胞凋亡增强。无脊椎动物的线粒体的摄氧量相较于脊椎动物要低得多, 受低氧刺激6h后, 对虾的线粒体摄氧量及相关酶活性均呈明显下降趋势, 这说明对虾通过减少摄氧量和降低蛋白的合成率以应对缺氧环境[21]。此实验中, 根据组织切片结果, 相对于常氧组, 低氧组的肝胰腺结构较为疏松, 管腔外围出现小空泡, 鳃轴出现弥散, 河蟹的肝胰腺和鳃组织结构均出现不同程度的损伤。类似的是, 在陶易凡等[22]的研究中, 克氏原螯虾(Procambarus clarkii)在低pH胁迫下, 肝胰腺组织中许多空泡, 鳃的上皮细胞剥落。日本沼虾(Macrobrachium nipponense)在低氧胁迫下, 鳃小片支柱细胞与上皮细胞排列杂乱, 肝组织中B淋巴细胞量减少, 细胞内运转囊泡的体积缩小[23]。
4 结论
本实验将低氧胁迫和螺原体共同作用于河蟹,最终得出结论: 在低氧状态下, 河蟹的组织结构被破坏, 死亡率升高, 血淋巴细胞的坏死率和凋亡率升高, 螺原体感染速度加快, 河蟹更容易被螺原体感染, 这些实验结果为研究低氧胁迫加速河蟹颤抖病的分子机制指明了方向。
