黄鳝饲料蛋白质需求量的研究
2022-08-30姜文灏周秋白王自蕊胡重华张文平
姜文灏 杨 鑫 周秋白 王自蕊 高 淼 王 颖 胡重华 张文平
(江西农业大学动物科学技术学院, 南昌 330045)
黄鳝(Monopterus albus), 俗称鳝鱼, 属于硬骨鱼纲、合鳃目、合鳃科、黄鳝属, 又名鳝鱼、长鱼、田鳗、无鳞公子等[1]。黄鳝肉质细嫩, 无肌间刺, 具有很高的营养和药用价值[2]。随着野生黄鳝资源减少, 主要靠养殖黄鳝满足市场需求, 国内2018年黄鳝养殖产量达31.9×107kg[2]。蛋白质作为动物核心营养成分, 是细胞、组织和机体的重要组成部分, 除为鱼体生长提供必需氨基酸外, 同时还可作为鱼类生命活动的能量来源, 是决定鱼类生长和发育的关键因素之一[3]。鱼类必须从外界摄入充足的蛋白质, 以维持正常的生命活动。目前关于鱼类的蛋白质需求量已有大量研究, 大多数鱼类生长适宜的饲料蛋白质含量在30%—50%[4]。关于黄鳝蛋白质需求量研究较少, 杨代勤[4]及闫建林等[5]曾对24—75 g的黄鳝蛋白质需求量进行了研究, 研究结果分别为35.7%及45%, 有着较大的差异。通过对黄鳝饲料市场调查发现效果较好的饲料蛋白质含量大多在40%—50%[6], 同时均添加冰鲜鱼进行投喂。目前黄鳝饲养主要依靠黄鳝配合饲料与冰鲜鱼糜搅拌投喂来满足黄鳝生长需要, 至今还没有完全投喂黄鳝配合饲料进行养殖。推测黄鳝是一种典型的肉食性鱼类, 可能对碳水化合物利用能力有限, 蛋白质需求量高。黄鳝饲料需求量也越来越大, 特别是随着鱼类资源衰退, 投喂冰鲜鱼类的养殖方式已不能满足黄鳝产业需求, 开发全价黄鳝配合饲料势在必行。本试验通过比较不同饲料蛋白质含量对黄鳝生长性能、蛋白质保留率、消化能力及生理生化指标等的影响, 综合评价确定黄鳝饲料适宜蛋白质含量, 为精细化开发黄鳝配合饲料提供数据参考。
1 材料与方法
1.1 试验饲料配方及制作
试验饲料所用原料于南昌大佑农生物科技有限公司采购。主要蛋白源为鱼粉和酪蛋白, 配制7种不同蛋白质含量(干物质)的等氮等能饲料,T1(32.74%)、T2(38.50%)、T3(42.26%)、T4(48.35%)、T5(52.65%)、T6(57.87%)和T7(62.31%)[1]。在试验料制作时, 先将原料用粉碎机粉碎, 再用80目筛过筛[11], 根据配方比例称取原料并逐级搅拌混合均匀,加入适量的水, 经膨化饲料机加工制粒, 自然风干,于阴凉干燥处保存备用。各试验饲料的原料配方组成和营养成分实测值见表 1。
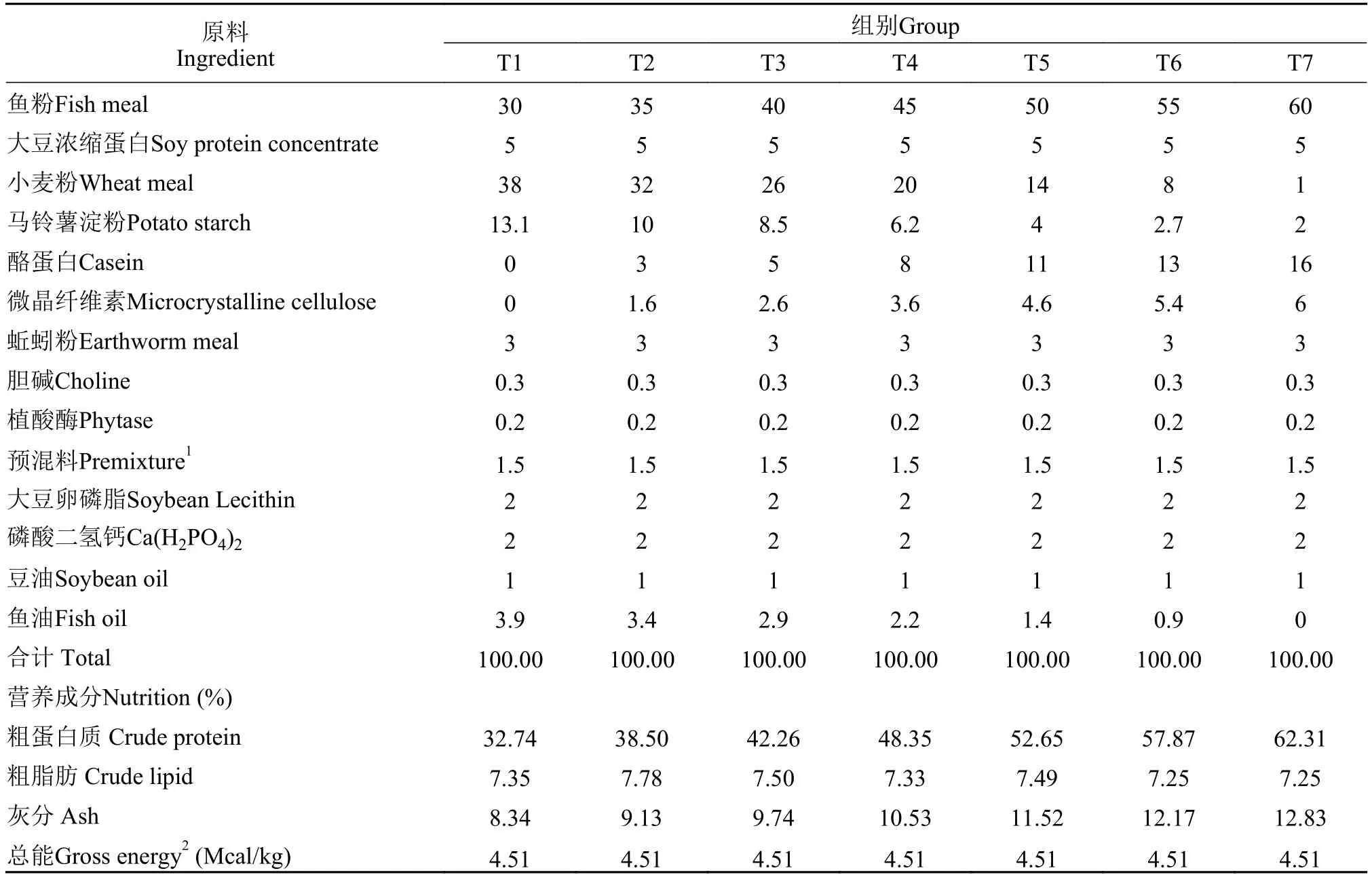
表1 试验饲料原料组成及营养水平(干物质基础)Tab. 1 Ingredients and nutritional compositions of the test diets (% dry matter)
1.2 试验鱼及饲养管理
试验所用黄鳝为鄱阳湖野生黄鳝, 黄鳝置于养殖箱中暂养和驯食, 直至黄鳝正常摄食配合饲料。驯食完成后, 选择规格(17.1±0.2 g/尾)一致的700尾幼鳝作为试验用鱼。然后将试验鱼随机均匀分在28个容积为300 L的养殖水箱中, 设置7个试验组,每个组设置4个重复。
饲养管理与实验室前期研究相同, 简而言之,用自来水充分曝气后用于黄鳝养殖, 实验期间连续使用增氧机充气, 保持良好养殖水质(溶氧量大于4 mg/L, 氨氮小于0.2 mg/L, pH在7.1—7.4, 自然水温为18—31℃)。每天18:00定时定点饱食投喂, 投喂1时后收集残饵烘干并从摄食量中扣除, 养殖期持续60d[1]。
1.3 样品采集与指标分析
养殖试验结束后, 禁食24h, 分别统计各养殖水箱中的黄鳝总重和数量, 用于计算其末均重(FBW)、存活率(Survival rate)、增重率(Weight gain rate)、饲料系数(Feed conversion ratio)和特定生长率(Specific growth rate)等。每养殖箱中取3尾, 每组共12尾进行解剖取样。断尾取血[12], 分离血清用于测定各项生化指标。测量形体参数(体长、内脏重、肝脏重、肠道重等)并记录, 用于后续计算。取8尾试验鱼部分肝脏、胃和肠组织, –80℃冰箱保存, 备用于测定其生理生化指标, 取部分肌肉样品和收集剩下的肠道及肝脏分别做营养成分分析。另取4尾黄鳝用于全鱼营养成分分析。
指标测定方法: 饲料的常规营养成分水分用105℃ 烘干法 (GB/T 6435—2014)、粗蛋白用凯氏定氮法 (GB/T 6432—1994)、粗脂肪用索氏抽提法(GB/T 6433—2006)和灼烧称重法(GB/T 6438—2007) 进行灰分测定[1]。生化指标及消化酶活性采用商业试剂盒测定(南京建成生物工程研究所), 严格按照说明书方法进行, Thermo酶标仪读取数据。
相关计算公式如下:
存活率(SR, %)= 终末数量/初始数量×100
增重率(WGR, %)=(终末体重–初始体重)/初始体重×100
特定生长率(SGR, %/d)=(Ln终末体重–Ln初始体重)/饲养天数×100
饲料系数(FCR)= 饲料摄入量/(终末体重–初始体重)
蛋白质保留率(Protein retention rate,PRR,%)=(体蛋白增加量/饲料蛋白摄入量)×100
蛋白质效率(Protein efficiency ratio,PER, %)=体重增加量/(饲料摄入量×饲料蛋白含量)×100
蛋白质摄食率(Protein feeding intake,PFI,%/d)=饲料摄入量×饲料蛋白质含量/[饲养天数×(初始体重+终末体重)/2]×100
干物质摄食率(Dry matter feeding intake,DMFI, %/d)=饲料摄入量×(1–饲料水分)/[饲养天数×(初始体重+终末体重)/2]×100
1.4 数据处理分析
试验数据均使用SPSS19.0进行统计分析, 统计结果以平均值±标准误(mean±SEM)展示, 先进行单因素方差分析(One-way ANOVA), 再进行多重比较(采用Duncan氏法), 显著水平为P<0.05。
2 结果
2.1 蛋白质含量对黄鳝生长的影响
在养殖试验60d后, 各试验组黄鳝的存活率、增重率和特定生长率等结果见表 2, 存活率各组之间差异不显著(P>0.05); 增重率随饲料蛋白质含量呈先升高后降低的趋势, T5—T7三组显著高于T1—T4组(P<0.05), 但当饲料蛋白含量超过52.65%(T5)时, 各高蛋白组间增重率无明显差异(P>0.05)。
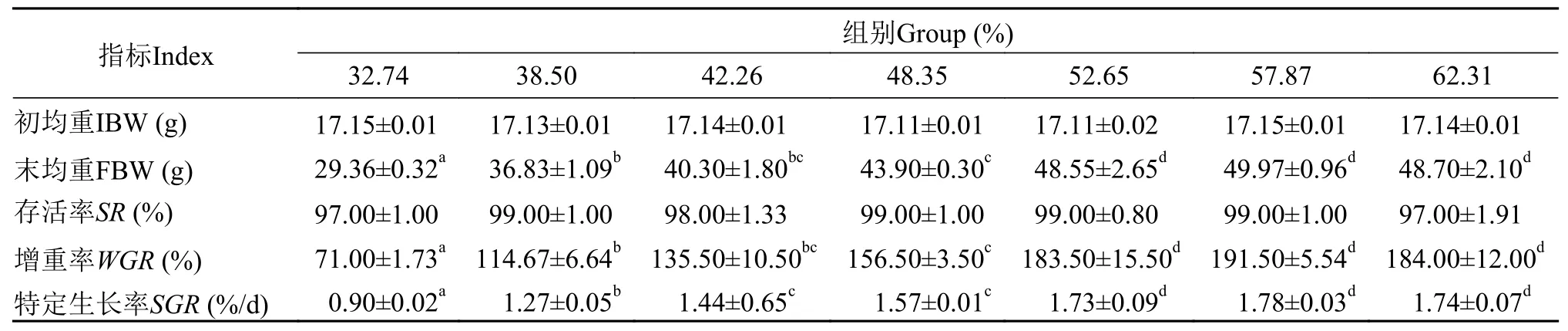
表2 蛋白质含量对黄鳝生长的影响Tab. 2 Effects of dietary protein levels on growth performance of M. ablus (means±SEM)
2.2 蛋白质含量对黄鳝饲料利用效果的影响
各组黄鳝的饲料系数及蛋白效率见表 3, 当饲料粗蛋白含量由32.74%(T1)升高至62.31%(T7)时,饲料系数呈先降低后上升的趋势, T5—T7三组显著低于T1、T2和T3组(P<0.05), 与T4组无明显差异(P>0.05), 且T5—T7三组间差异不显著(P>0.05); 蛋白质效率随饲料蛋白质含量则呈先升高再下降的趋势, T5—T7三组显著高于T1、T2和T3组(P<0.05), 与T4组无明显差异(P>0.05), 且T5—T7三组间差异不显著(P>0.05); 蛋白质保留率的变化趋势与蛋白质效率相似, 在T5组蛋白质保留率最高;干物质摄食率呈下降趋势, 在T1组有最大值(P<0.05),且T3—T7五组间无显著性差异(P>0.05); 蛋白质摄食率的变化趋势则与干物质摄食率相反, T1组最低, T7组最高, 各组间均具有显著性差异(P<0.05)。

表3 蛋白质含量对黄鳝饲料利用的影响Tab. 3 Effects of dietary protein levels on the diet utilization of M. ablus (means±SEM)
2.3 黄鳝饲料蛋白质需要量
在增重率基础上进行分析并进行折线拟合, 拟合结果见图 1。当饲料干物质蛋白含量在32.74%—48.35%时, 拟合折线模型为y=5.4565x–101.3307,R2=0.9625,P<0.05。当饲料干物质蛋白含量在52.65%—62.31%时, 折线模型为y=0.1362x+178.5256,R2=0.0214。二者交点坐标为(52.60, 185.68), 即以增重率为评估指标, 幼鳝对饲料干物质的蛋白质需要量为52.60%。

图1 增重率与蛋白质含量之间的关系Fig. 1 Relationship between weight gain rate and dietary protein content
蛋白质效率随饲料蛋白质含量的变化趋势与增重率随饲料蛋白质含量之间呈相似关系。拟合折线模型为:y=3.5054x–18.8954,R2=0.9552,P<0.05, 及y=–0.1095x+156.706,R2=0.1521。如图 2,由公式可知, 当x=48.51时即可获得较高的蛋白质效率。因此, 由蛋白质效率为评估指标, 确定幼鳝对蛋白质的需要量为48.51%(干物质)。

图2 蛋白质效率与蛋白质含量之间的关系Fig. 2 The relationship between protein efficiency ratio and dietary protein content
蛋白保留率与蛋白质含量的拟合曲线模型为:y=1.3384x–28.1028,R2=0.9741,P<0.05, 及y=–0.1927x+50.6558,R2=0.2966。由图 3可知, 当x=51.44时, 蛋白质保留率较高。因此, 由蛋白保留率为评估指标, 确定幼鳝对蛋白质的需要量为51.44%(干物质)。

图3 蛋白质保留率与蛋白质含量之间的关系Fig. 3 The relationship between protein retention rate and dietary protein content
饲料系数与蛋白质含量之间的关系拟合折线模型为: 当蛋白含量在32.74%—48.35%(干物质)时,拟合折线模型为y=–0.0882x+5.5923,R2=0.9719,P<0.05。当蛋白含量在52.65%—62.31%(干物质)时, 折线模型为y=0.003x+1.0738,R2=0.0627。当x=49.53时, 可获得较低的饲料系数(图 4)。即以饲料系数为指标幼鳝对蛋白质的需要量为49.53%(干物质)。综上所述, 在本试验条件下, 幼鳝对饲料的蛋白质需求量为48.51%—52.60%。

图4 饲料系数与蛋白质含量之间的关系Fig. 4 The relationship between feed conversion ratio and dietary protein content
2.4 蛋白质含量对黄鳝血清生化指标的影响
如表 4所示, 随着饲料中蛋白质含量的升高, 血清中GPT和GOT的活性呈下降趋势, T5—T7显著低于其他组(P<0.05), 但三组之间无明显差异(P>0.05);血清中TP含量呈先上升后不变的趋势, 以T4组最高, 显著高于T1、T2和T3组(P<0.05), 与T5、T6和T7组无明显差异(P>0.05); BUN含量呈上升趋势,T7组最高, 与T6组差异不显著(P>0.05), 显著高于T1—T5组(P<0.05); 血清中TC和TG的呈下降趋势,在T1组有最大值, T7组有最小值, 具有明显差异(P<0.05); 血清中HDL-C的含量呈下降趋势, 在T1组有最大值, 与T2组无明显差异(P>0.05), 但高于T3—T7组(P<0.05); 血清中LDL-C的含量呈下降趋势, 在T1组有最大值, 显著高于T5—T7三组(P<0.05),同时T2—T5组差异不显著(P>0.05), T4—T7组之间差异不显著(P>0.05); 血清中CRE的含量无明显变化, 各组之间无显著性差异(P>0.05); 血清中GLU的含量呈现先降低后不变的趋势, 在T1组有最大值,显著高于其他各组(P<0.05), T2组次之, T3和T4随之降低, T5、T6和T7无显著性差异(P>0.05)。

表4 蛋白质含量对黄鳝血清生化指标的影响Tab. 4 Effects of dietary protein levels on serum biochemical indexes of M. ablus (means±SEM)
2.5 蛋白质含量对黄鳝消化性能的影响
如图 5所示, 在肝胰脏、肠和胃3种组织中, 蛋白酶活性均随饲料蛋白质含量升高而升高, 以T1组最低(P<0.05), T7组最高(P<0.05), 但在肝胰脏及肠组织中T7组与T5、T6组差异不明显(P>0.05), 在胃组织中T7组与T4、T5、T6差异不明显(P>0.05); 如图 6所示, 随着饲料蛋白质含量的升高, 肝胰脏脂肪酶呈下降趋势, T1和T2组最高, 显著高于其他各组(P<0.05); 胃、肠脂肪酶活性各试验组之间无显著性差异(P>0.05)。

图6 饲料不同蛋白质含量对黄鳝不同组织脂肪酶活性的影响Fig. 6 Effects of dietary protein levels on lipase activity in different tissues of M. ablus
如图 7所示, 随着饲料蛋白质含量的升高, 胃淀粉酶活性无明显变化, 各试验组之间无显著性差异(P>0.05); 肝胰脏及肠组织淀粉酶的活性随蛋白质含量的升高呈下降趋势, 在T1组有最大值, 且T1、T2组无明显差异(P>0.05), T7组最小, 显著小于T1—T4组(P<0.05)。
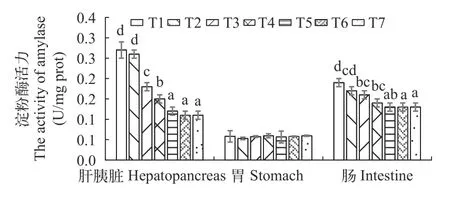
图7 饲料不同蛋白质含量对黄鳝不同组织淀粉酶活性的影响Fig. 7 Effects of dietary protein levels on amylase activity in different tissues of M. ablus
3 讨论
3.1 饲料蛋白质含量对黄鳝生长性能的影响
本试验结果表明, 黄鳝摄食饲料的蛋白含量不同对其存活率无显著影响, 说明黄鳝能够耐受不同蛋白质含量的饲料, 这和用不同蛋白质含量的饲料饲喂拉萨裸裂尻鱼(Schizopygopsis younghusbandi)[7]、大鳞鲃(Barbus capito)幼鱼[8]、条纹幼鲶(Pangasianodon hypophthalmus)[9]和宝石鲈(Scortum barcoo)[10]等得到的结果类似。本试验中随饲料蛋白质含量的升高黄鳝的增重率和特定生长率先升高,至饲料蛋白含量62.31%组增重率和特定生长率有下降趋势, 但不明显。已有研究表明, 饲料蛋白质含量的升高会对鱼类的生长速度造成不同的影响,丁立云等[11]对星斑川鲽(Platichthys stellatus)的研究结果显示, 饲料蛋白含量的升高可促进鱼体生长,但这种促进作用会在饲料蛋白升高到某一含量时消失。王蕾蕾等[12]在黑鲷(Takifugu rubripes)上作了相似的研究, 结果表明鱼体的生长速度与饲料蛋白含量并非呈线性关系, 而是呈先升高后下降的趋势。鱼类在摄入过量的蛋白质后, 蛋白质分解为氨基酸, 氨基酸再分解供能, 在氨基酸分解过程中会消耗一定的能量, 产生氧化应激和增加氮代谢废物[13,14]。不同种类的鱼类利用蛋白质作能量能力不同, 过量饲料蛋白质含量对生长产生不同程度的负面影响[21]。在本试验中, 黄鳝的生长性能与丁立云等[11]对星斑川鲽幼鱼的研究结果类似, 先随饲料蛋白质含量的升高而升高, 当蛋白含量达到一定含量后, 黄鳝的生长性能不再改变, 这说明黄鳝摄食首先满足蛋白质需要, 当蛋白水平达到生长需求后,饲料系数和蛋白质效率趋于稳定。
3.2 饲料蛋白质含量对黄鳝饲料利用效果的影响
本试验结果表明, 黄鳝对高蛋白组饲料的利用效果较好, 饲料系数较低蛋白饲料低, 这在多种鱼类上得以印证[10,11,15,16]。另一方面, 由表 3可知, 蛋白质效率先随饲料蛋白含量的升高而有所提高, 但在蛋白含量达到一定含量后, 蛋白质效率不再明显变化, 这与先前南方鲇的研究结果相一致[17]。另有研究指出, 蛋白质效率与饲料蛋白含量呈负相关关系[13,18], 或先升高然后再下降[13,19,20]。这些结果可能是由不同鱼类的特异性造成差异, 即不同鱼类对粗蛋白含量不同的饲料, 耐受性也不同有关, 对饲料蛋白需求高的鱼类, 可能在摄食高蛋白饲料时体内蛋白酶的活性较高, 能够对饲料蛋白充分利用来提高生长速度, 而对饲料蛋白需求较低的鱼类, 在摄食高蛋白质含量的饲料时, 体内蛋白酶的活性较低不足以完全利用蛋白质, 多余的蛋白质被浪费,从而造成较低的蛋白质效率[1], 这与上述结果中消化酶中胰蛋白酶的变化(图 5)相一致。

图5 饲料不同蛋白质含量对黄鳝不同组织蛋白酶活性的影响Fig. 5 Effects of dietary protein levels on protease activity in different tissues of M. ablus
此外, 本试验结果表明, 摄食率与饲料蛋白含量呈负相关关系, 即低蛋白组饲料黄鳝摄食率高,而高蛋白组饲料黄鳝摄食率低。这可能是鱼体为满足蛋白质需求而做出的适应性改变。相似的结果在杂交鲟(Acipenser baeriifemale× A. gueldenstaedtiimale)上得以展现[21]。本实验在饲料低蛋白质含量时, 黄鳝蛋白质效率较低, 可能是由于黄鳝需要增加摄食量来满足机体对蛋白质的需求, 而低蛋白含量饲料中含有较高的碳水化合物, 过高的碳水化合物影响了黄鳝的正常生理功能, 在上述黄鳝血清的生化结果中进一步证实。而张磊[22]的研究表明, 达氏鲟(Acipenser dabryanus)的摄食率随着饲料蛋白质含量的升高而升高, 这种结果的差异可能与不同鱼种应对饲料不同蛋白质含量的能力有关。
3.3 饲料蛋白质含量对黄鳝血清生化指标的影响
血清生化指标可直观反映机体的代谢稳态, 故用来衡量机体的健康状况以及机体对环境的适应能力[1,23]。在一般情况下, GPT与GOT主要在肝细胞中, 当肝细胞受损失, 这两种酶会被释放进入血液, 因此, 血清中这两种酶的变化可以反映肝脏是否发生病变[32,33]。本实验结果表明, 血清中这两种酶的活性随饲料蛋白含量升高而呈下降趋势, 这与红旗东方鲀[13]中的研究结果相一致。这可能意味着, 低蛋白含量的饲料不能提供足够的蛋白质而导致肝脏受到了损伤。此外, 血清MDA的含量也与饲料蛋白水平相关, 低蛋白水平与过高蛋白水平组MDA含量高, 而适宜蛋白水平MDA含量低, 这样的结果表明在一定蛋白水平范围内, 饲料蛋白水平的提高能减小肝脏损伤, 但超过这个区间后, 会导致肝损伤。结合BUN含量增加, 这可能是蛋白质作为能源物质增加了氧化应激, 反而对机体不利。血清TP含量可看出机体的蛋白代谢情况[24], 当肝功能异常时, 血清TP含量降低[14]。本实验结果表明, 血清TP含量先随饲料蛋白水平的升高而升高, 然后保持相对稳定。这与珍珠龙胆石斑鱼(Epinephelus lanceolatusmale×E. fuscoguttatusfemale)的实验结果相一致[25], 这可能意味着, 低蛋白水平的饲料会损伤鱼体肝脏功能。然而有研究指出, 血清TP含量并不会受饲料蛋白水平的影响[13], 造成这种结果的原因尚未明确, 可能是鱼种特异性, 也可能是蛋白水平范围不同。BUN是含氮物质在机体内的代谢产物, 外源蛋白质消化吸收后最终以游离氨基酸和小肽等形式存在, 接着被用于合成沉积或用于分解供能, 分解的部分主要以BUN的形式随尿排出体外[1],一般认为血浆中BUN含量降低意味着蛋白质分解减弱, 而蛋白质沉积加强[26]。在赤石斑鱼(Epinephelus akaara)上的实验结果显示[27], 血清BUN含量随饲料蛋白水平的升高而升高, 这与本试验的结果类似, 这说明饲料中蛋白质含量越高被代谢掉的N元素也越多。TC及TG是构成血脂的主要成分, 血脂主要来源于外源脂肪的吸收及肝脏等组织的合成,血脂含量对全身脂类含量的影响很小, 但血脂会转运于各组织之间[1]。因此, 动物机体内的脂类代谢情况, 一定程度上可由血液中TC、TG的含量反映[28]。本实验结果表明, 在蛋白水平升高时, 血液中TC与TG含量呈降低趋势, 这可能是鱼体加强了对脂肪的吸收从而弥补饲料蛋白质摄入不足, 且可能通过糖酵解途径为合成脂肪提供原料, 从而造成血脂升高, 而当摄入饲料蛋白足够时, 机体则会降低脂类代谢[1], 这与一些研究结果相一致[25,29]。HDL-C被称为“血管清道夫”能把TC从血液及外周组织转运至肝脏, 而LDL-C则是把TC从肝脏转运至外周组织[27]。本试验结果表明, 当饲料蛋白水平升高时, HDLC及LDL-C含量降低, 这说明摄入高含量蛋白会抑制脂肪代谢强度, 类似的结果出现在暗纹东方鲀(Takifugu obscurus)[30]的研究中。CRE是肌酸和磷酸肌酸代谢的最终产物, 血清中肌酐含量与肌肉活动量有关, 生成的肌酐经由肾脏过滤排出, 因此, 血清中的CRE含量可反映肾脏的健康状况[31]。本试验结果表明, 血清肌酐含量不受饲料蛋白水平的影响, 这与尼罗罗非鱼(Oreochromis niloticus)[32]上的研究结果相一致。本实验结果表明, 随着饲料蛋白水平升高, GLU含量呈降低趋势, 这可能是鱼体在摄食低蛋白饲料时, 营养的不足而提高了摄食量,间接加强了碳水化合物的摄入。当饲料蛋白水平升高时, 饲料中碳水化合物含量降低, GLU含量也随之降低, 在暗纹东方鲀[30]研究中具有相似的结果。
3.4 饲料蛋白质含量对黄鳝消化酶活性的影响
消化酶活力对机体消化吸收营养物质的能力具有重要的影响, 进而影响生长性能。另一方面,受食性及饲料组成等多个因素都会影响消化酶活性, 存在多样性和复杂性[25,33]。
本实验结果表明, 在黄鳝肝胰脏、胃和肠道中,蛋白酶活性在肠道中较高, 且肠道蛋白酶活性呈先随饲料蛋白水平升高而升高然后保持稳定的现象,这与刘勇[34]在建鲤(Cyprinus carpio var.Jian)上的研究结果一致, 说明黄鳝对饲料蛋白质含量变化的适应性较强。但也有研究表明饲料中过高蛋白水平会降低肠道蛋白酶活性[35,36]。饲料蛋白过高, 可能对鱼体造成氮代谢负担, 蛋白酶活性降低减少摄入蛋白质吸收量, 这可能与鱼类能量利用机制不同有关。推测黄鳝对蛋白质作能量利用能力较强。
本实验结果表明, 在黄鳝肝胰脏、胃和肠道中,肠道的脂肪酶活性最高, 但肠道脂肪酶活性不受饲料蛋白质水平的影响, 这与达氏鲟上的研究结果类似[22]。已有研究表明, 肠道脂肪酶是底物依赖型,即肠道脂肪酶活性与脂肪含量有关[34,36,37], 本研究中各组饲料脂肪含量基本一致, 这可能是脂肪酶活性变化不明显的原因。另一方面, 肠道与肝胰脏脂肪酶活性的变化不同, 在本研究中, 随着饲料蛋白质水平升高, 肝胰脏脂肪酶的活性也随之降低, 这可能是鱼体在摄食低蛋白质饲料时, 为满足机体能量需要, 加强机体对脂肪的利用, 而最终做出的代谢调整。
本实验结果表明, 在黄鳝肝胰脏、胃和肠道中,肝胰脏与肠道淀粉酶活性变化基本一致, 在饲料蛋白水平升高时活性降低。这与建鲤[34]及光倒刺鲃(Spinibarbus hollandi)[38]上的研究结果类似。这可能是因为在设计蛋白质水平试验时, 为了满足各试验组饲料能量一致, 通常在低蛋白组添加大量的碳水化合物而在高蛋白组添加较少的碳水化合物[1]。肝胰脏和肠道淀粉酶可能与肠道淀粉酶情况相同。但在黄姑鱼上的研究结果表明在饲料蛋白含量升高的同时肠道淀粉酶活性也随之上升[39], 可能是不同鱼种对淀粉的利用能力不同, 而造成这种差异。本实验结果表明, 淀粉酶活性在3种组织中的胃内最小, 且饲料蛋白质水平并不会对其活性造成影响, 这也说明黄鳝肠道是淀粉的主要消化场所,而胃不是淀粉的主要消化场所[37]。同时也说明黄鳝对淀粉利用能力不强, 是一种典型的肉食性鱼类。
4 结论
在本试验条件下, 当饲料蛋白水平过低时, 黄鳝会增加摄食量以满足蛋白质需求, 但摄入过多碳水化合物会对损伤黄鳝肝脏。在饲料蛋白水平过高时, 氧化应激增加, 阻碍黄鳝生长, 降低蛋白质效率与蛋白保留率, 同时黄鳝通过降低摄食量减少蛋白质摄入。饲料蛋白质含量在48.51%—52.60%时,幼鳝可获得较好的生产性能。
