虹鳟幼鱼对不同淀粉的利用
2022-08-30党江雨蔡友旺张春燕曹凯林李小勤冷向军
党江雨 蔡友旺 张春燕 曹凯林 李小勤 冷向军
(上海海洋大学水产科学国家级教学示范中心, 农业农村部鱼类营养与环境生态研究中心,水产动物遗传育种中心上海市协同创新中心, 上海 201306)
鱼类对糖的利用能力有限[1], 但是糖类作为一种廉价能量源, 不仅可以降低饲料成本, 而且对于鱼类的生长也有一定的促进作用[2—4]。对虹鳟(Oncorhynchus mykiss)[5]、大西洋鲑(Salmo salar)[6]、青鱼(Mylopharyngodon piceus)[7]、大黄鱼(Larimichthys crocea)[8]和达氏鲟(Acipenser dabryanus)[9]等的研究表明, 淀粉等大分子糖类相较于葡萄糖等小分子糖类对于鱼类的促生长作用更明显, 而且淀粉具有优良的黏合性和可消化性。淀粉由直链淀粉和支链淀粉组成[10], 来源不同的淀粉, 在结构组成存在差异, 其直/支链淀粉比例不同, 鱼类对其利用程度也不相同[11—13]。在虹鳟[14]、罗非鱼(Oreochromis mossambicus)[15]和草鱼(Ctenopharyngodon idella)[16]上的研究表明, 这几种鱼类对支链淀粉的利用程度更高, 而条纹杂交鲈(Morone chrysops×M.saxatilis)[17]对直链淀粉的利用能力更高。
虹鳟属鲑形目(Salmoniformes), 鲑科(Salmonidae), 大麻哈鱼属(Oncorhynchus), 是世界范围内广泛养殖的冷水性鱼类。研究表明, 虹鳟对于饲料中碳水化合物的适宜需要量为≤20%[1]; 在虹鳟对淀粉的利用方面也有一些报道, 例如不同种类淀粉对其消化率的影响[18]、淀粉和脂肪的比例对其生长等的影响[19]和不同水平的淀粉和葡萄糖对其糖代谢等的影响[5]等, 但尚未见虹鳟对不同种类淀粉源利用比较的报道。
本试验分别以木薯淀粉、小麦淀粉、豌豆淀粉和玉米淀粉为淀粉源, 设置相同的淀粉水平, 考察不同种类淀粉对虹鳟生长、鱼体组成、血液生化指标和肝脏糖代谢酶等的影响, 探讨虹鳟饲料适宜的淀粉来源, 为虹鳟高效饲料的配制提供理论依据。
1 材料与方法
1.1 试验设计与试验饲料
本试验分别以木薯淀粉、小麦淀粉、豌豆淀粉和玉米淀粉为淀粉源, 配制淀粉添加水平为15%的4组等氮等脂饲料。饲料原料经粉碎、过筛(60目)后, 按配方比例称取原料进行混合, 用单螺杆挤压机制成直径为2 mm的沉性颗粒饲料[制粒温度(85±5)℃], 制粒后的饲料用烘干机37℃烘至水分含量低于10%(各组保持一致的烘干时间), 室温阴凉干燥保存备用。试验饲料的配方组成及营养成分含量见表 1。

表1 试验饲料配方组成及营养成分含量(风干基础, g/kg)Tab. 1 Ingredients and proximate composition of experimental diets (air-dry basis, g/kg)
1.2 试验鱼和饲养管理
试验用虹鳟购自昆明倘浩水产养殖有限公司。试验鱼暂养驯化2周后, 饥饿24h, 挑选276尾大小均匀, 体格健壮的虹鳟(7.7±0.1) g, 平均分配到12个自动充气循环水桶内(直径1.0 m, 水深0.8 m,水体约为650 L), 试验共4个处理组, 每组设3个平行, 每个平行23尾鱼。养殖期间每天投喂两次(9:00和16:00), 日投喂量约为鱼体重的2%—5%, 根据水温和虹鳟摄食情况进行适当调整, 每次投喂以虹鳟不抢食为宜。每次于投喂2—3h后用虹吸法吸走桶底粪便, 每周换水3次, 换水量为循环系统的1/3。养殖期间水温 12—16℃, 溶氧 6—7 mg/L, pH 7.24—7.78, 氨氮≤0.2 mg /L, 亚硝酸盐≤0.1 mg /L。养殖试验于2020年冬季在上海海洋大学滨海养殖基地循环水车间进行, 养殖试验共持续56d。
1.3 样品采集
在养殖试验结束后, 鱼体饥饿24h, 统计每桶中虹鳟数量并称重, 计算增重率、饲料系数和成活率。每桶随机取9尾鱼, 用MS-222麻醉(100 mg/L),取3尾鱼装袋后于–20℃保存, 用于全鱼常规成分的测定; 另取3尾鱼, 测量体重、体长、内脏重和肝脏重, 用经过肝素钠润洗的注射器从尾静脉处采血,3500 r/min离心10min, 取血清于–80℃保存; 取部分肝脏于波恩固定液中固定, 用于组织学观察, 剩余肝脏于–20℃保存, 用于测定肝糖原含量和肝脏糖代谢酶活性; 其余3尾鱼, 抽血后(防止解剖时血液污染样品)采集肝脏样本于–20℃保存, 用于测定肝脏组成。
在采样结束后, 将剩余虹鳟继续投喂3d, 使其恢复正常的生理状态。在饥饿24h后, 饱食投喂1次,于投喂前(0)及投喂后1h、3h、5h、7h和9h, 每桶随机取1尾虹鳟(每处理组每个时间点为3尾鱼), 用MS-222麻醉(100 mg/L), 使用经肝素钠润洗的注射器从尾静脉处采血, 3500 r/min离心10min后取血清,于–80℃保存, 进行血糖含量的测定。
1.4 测定指标与方法
生长性能与形体指标成活率SR(%)=100×终末尾数(尾)/初始尾数(尾);
增重率WGR(%)=100×[终末体重(g)–初始体重(g)]/初始体重(g);
饲料系数FCR=采食量(g)/[终末体重(g)–初始体重(g)];
脏体比VSI=100×内脏重(g)/体重(g);
肝体比HSI=100×肝脏重(g)/体重(g);
肥满度CF(g/cm3)=100×体重(g)/体长(cm)3;
蛋白质沉积率PR(%)=100×鱼体蛋白质贮积量/摄入的蛋白质总量;
脂肪沉积率LR(%)=100×鱼体脂肪贮积量/摄入的脂肪总量。
全鱼、肝脏与饲料组成全鱼与饲料的水分、粗蛋白含量测定分别采用105℃常压干燥法和凯氏定氮法(2300自动凯氏定氮仪, FOSS, 瑞典), 粗脂肪含量测定采用氯仿-甲醇抽提法, 粗灰分测定采用550℃高温灼烧法。
肝糖原含量测定将肝脏样本于4℃解冻后,取0.1 g左右肝脏, 将肝脏与碱液以1﹕3的体积混合,在沸水浴中加热20min, 得到水解液, 采用南京建成生物工程研究所试剂盒测定肝糖原含量。
血清生化指标测定血清葡萄糖、甘油三酯和总胆固醇含量及谷草转氨酶和谷丙转氨酶活性采用南京建成生物工程研究所的试剂盒和酶标仪(BioTeK Ynergy HTX, 美国)测定。
肝脏糖代谢酶活性的测定取肝脏样本于4℃解冻, 匀浆, 4℃离心(3000 r/min, 10min), 取上清液用于肝脏己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、磷酸烯醇式丙酮酸激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)活性测定。采用南京建成生物工程研究所的试剂盒和酶标仪(BioTeK Ynergy HTX, 美国)测定上述酶活性。
肝脏组织切片石蜡切片HE染色: 将肝脏样品从固定液中取出, 用不同浓度的酒精、酒精和二甲苯混合液、二甲苯逐级脱水, 之后进行浸蜡、包埋、切片、染色等工作, 染色剂为苏木精-伊红。染色后装片, 待干燥后观察肝脏的组织形态,并拍照。
1.5 数据处理
试验数据以平均数±标准差表示, 采用SPSS25.0软件进行单因素方差分析, 结果用“平均值±标准误”表示, 其中差异显著者进行Duncan多重比较, 差异显著水平为P<0.05。
2 结果
2.1 生长性能与形体指标
在养殖过程中, 各组虹鳟存活率均为100%(表 2)。木薯淀粉组增重率最高(1049.3%), 饲料系数(0.83)最低; 与木薯淀粉组相比, 小麦淀粉组、豌豆淀粉组和玉米淀粉组的增重率显著降低, 饲料系数显著升高(P<0.05), 该3组在增重率和饲料系数上无显著差异(P>0.05)。各组在肥满度、脏体比和肝体比之间也无显著差异(P>0.05)。
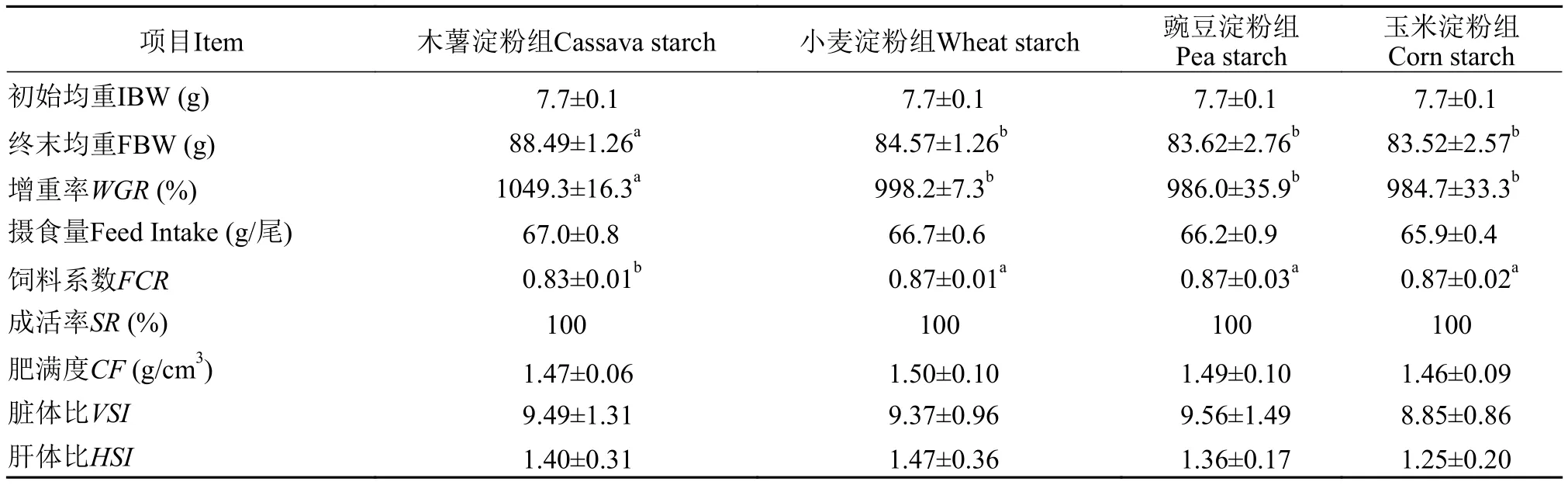
表2 饲料淀粉种类对虹鳟生长性能和形体指标的影响Tab. 2 Effects of dietary starches on growth and morphological indices of rainbow trout
2.2 鱼体、肝脏组成
由表 3可见, 各组在全鱼水分、粗蛋白质、粗脂肪和粗灰分含量上均无显著差异(P>0.05)。在营养物质利用方面, 各组蛋白质和脂肪沉积率无显著差异(P>0.05)。肝脏水分、粗蛋白质和粗脂肪含量也不受淀粉种类影响(P>0.05)。豌豆淀粉组肝糖原含量显著低于其余各组(P<0.05); 木薯淀粉组、小麦淀粉组和玉米淀粉组的肝糖原含量无显著差异(P>0.05)。

表3 饲料淀粉种类对虹鳟全鱼和肝脏组成的影响(鲜重, %)Tab. 3 Effects of dietary starches on body and liver composition of rainbow trout (fresh weight, %)
2.3 血清生化指标
由表 4可见, 各组血清甘油三酯、总胆固醇含量不受淀粉种类影响, 谷草转氨酶和谷丙转氨酶活性也无显著差异(P>0.05)。

表4 饲料淀粉种类对虹鳟血液生化指标的影响Tab. 4 Effects of dietary starches on serum biochemical indices of rainbow trout
2.4 肝脏糖代谢酶活性
由表 5可见, 各组丙酮酸激酶、葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶活性均不受淀粉种类影响(P>0.05)。木薯淀粉组和小麦淀粉组己糖激酶活性显著高于豌豆淀粉组和玉米淀粉组(P<0.05),磷酸果糖激酶活性显著高于玉米淀粉组(P<0.05)。
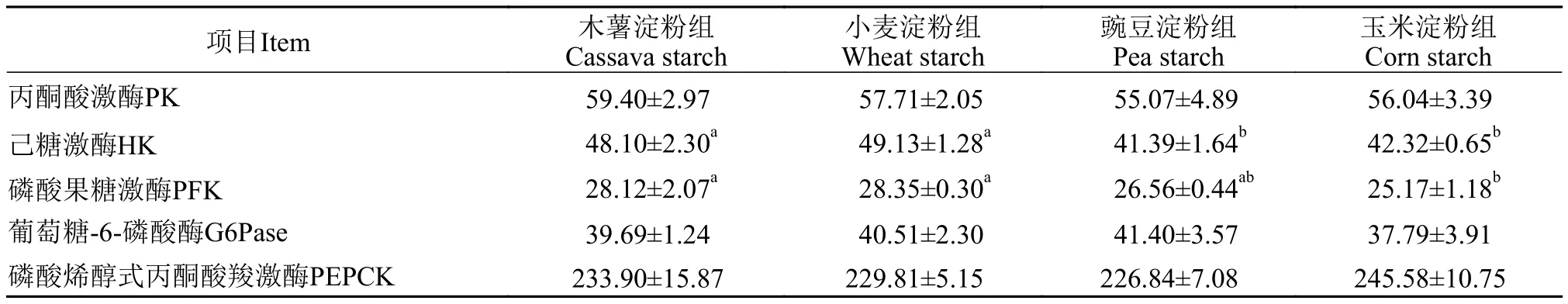
表5 饲料淀粉种类对虹鳟肝脏糖代谢酶活性的影响Tab. 5 Effects of dietary starches on activities of carbohydrate metabolic enzymes in the liver of rainbow trout (U/mg prot)
2.5 餐后血糖含量变化
由表 6和图 1可见, 各组虹鳟在摄食后, 血糖含量均呈现先上升后下降的趋势, 在摄食后7h血糖含量达到最高。木薯淀粉组在摄食后1—7h的血糖含量均显著高于其余3组(P<0.05)。摄食9h时, 各组血糖含量无显著差异(P>0.05)。从双因素分析来看,餐后时间和淀粉种类均对血糖含量存在显著影响(P<0.05), 但二者交互作用无显著影响(P>0.05)。
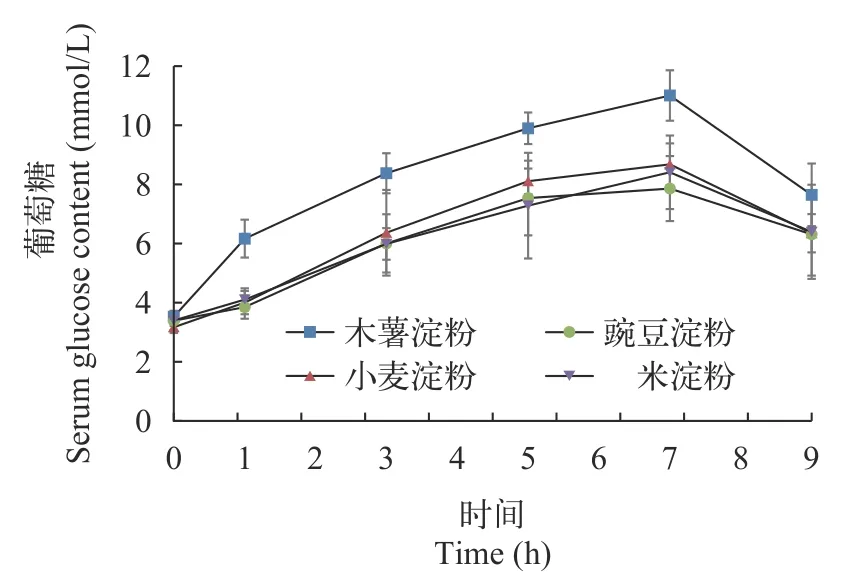
图1 虹鳟餐后血糖含量变化Fig. 1 The serum glucose content of rainbow trout after feeding

表6 饲料淀粉种类对虹鳟摄食后血糖含量的影响Tab. 6 Effects of dietary starches on postprandial serum glucose content of rainbow trout (mmol/L)
2.6 肝脏组织学
由图 2可见, 各组肝脏组织形态正常, 未出现肝细胞肿胀、空泡化和细胞核位移等现象。

图2 虹鳟肝脏组织切片Fig. 2 Tissue slices of rainbow trout liver (200×)
3 讨论
3.1 不同种类淀粉对虹鳟生长性能的影响
淀粉的来源广泛, 不同种类的淀粉其直链淀粉和支链淀粉的含量、颗粒大小、分子结构等方面均有不同, 直/支链淀粉的比例会影响鱼类对淀粉的利用[20]。在本试验选用的4种淀粉中, 木薯淀粉的支链淀粉含量最高。从生长性能来看, 木薯淀粉组的鱼体增重率显著高于小麦淀粉组、豌豆淀粉组和玉米淀粉组, 饲料系数也最低, 这表明虹鳟对支链淀粉含量高的淀粉源有较好的利用效果。在Preffer等[14]的研究中, 虹鳟对蜡质玉米淀粉(1%直链淀粉和99%支链淀粉)的利用能力高于普通玉米淀粉(28%—30%直链淀粉和70%—72%支链淀粉),此外, 在草鱼[16]和罗非鱼[21]中也有类似的报道。但在大口黑鲈(Micropterus salmoides)[22]的研究中, 高直链/支链比的淀粉对鱼类的生长反而有促进作用,其原因可能是过多的支链淀粉水解造成了摄食后血糖水平过高, 不利于大口黑鲈的正常生长。苟仕潘等[23]的研究表明, 大口黑鲈[初始体重(28.36±0.10) g]饲料中适宜的可消化淀粉水平为9.22%—10.05%,而虹鳟[初始体重(28.4±3.2) g]饲料中的适宜淀粉水平分别为18%(15%粗脂肪)和27%(18%粗脂肪)[19],可见, 虹鳟较大口黑鲈更能耐受高糖。
在本试验中, 各组肝脏组织学无显著差异, 表明在15%的淀粉水平下, 肝脏均处于正常生理状态, 但豌豆淀粉组肝糖原含量显著低于其余3个试验组, 原因可能是豌豆淀粉的直链淀粉含量高, 直链淀粉不易被消化分解, 从而降低了糖原在肝脏中的积累, 这与Song等[24]和徐祥泰等[25]在大口黑鲈上的研究结果类似。
3.2 不同种类淀粉对虹鳟鱼体组成和血液生化指标的影响
在本试验中, 各试验组在全鱼和肝脏常规营养组成方面没有显著差异, 并且血液的总胆固醇和甘油三酯含量也不受淀粉种类影响, 而这两个指标代表着鱼类脂肪代谢情况, 表明不同种类的淀粉对蛋白质和脂肪的转化利用没有产生显著影响。任鸣春[5]采用小麦淀粉、木薯淀粉和玉米淀粉3种糊化淀粉源饲喂军曹鱼(Rachycentron canadum), 对全鱼组成也未产生显著影响; Song等[24]采用小麦淀粉、豌豆淀粉、木薯淀粉和高直链玉米淀粉为淀粉源饲喂大口黑鲈, 各组全鱼组成之间也无显著差异。
谷草转氨酶和谷丙转氨酶是反映肝功能的重要指标, 当肝脏受损时, 肝脏中的这两种酶会释放到血液中, 从而使血液中两种酶活性升高。在本试验中, 各试验组血液中的谷草转氨酶和谷丙转氨酶活性没有显著差异, 在解剖过程中, 各处理组的肝脏从外观上也没有发现明显差异。
3.3 不同种类淀粉对虹鳟糖代谢酶和餐后血糖水平的影响
本试验测定了己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、磷酸烯醇式丙酮酸激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)的酶活性, 前3种酶属于糖酵解途径, 后两种酶存在于糖异生途径。HK是糖酵解途径的第一个限速酶。在本试验中, 木薯淀粉组HK活性显著高于豌豆淀粉组和玉米淀粉组, PFK活性显著高于玉米淀粉组, 并且餐后1—7h的血糖含量也显著高于其余3组, 表明较高的血糖水平对HK和PFK产生了诱导, 使其活性增加。小麦淀粉组的血糖水平并不高, 但HK和PFK活性较高, 其原因尚不清楚, 有待进一步研究。PK是糖酵解最后一步的限速酶, 在本试验中,各组PK活性不受淀粉种类影响, 说明其无法呼应较高的血糖水平, Panserat等[26]曾报道, 虹鳟在摄食不含糖与含糖饲料后6h和24h, 其PK基因表达均无显著差异。但在欧洲海鲈(Dicentrarchus labrax)[27]的研究表明, 饲料糖水平能够调控PK的活性, 这可能是鱼的种类和糖的种类不同造成的。PEPCK和G6Pase是糖异生途径的代谢酶, 有研究发现[26], 虹鳟在摄食含糖和不含糖的饲料后, 其肝脏中PEPCK基因表达量均无变化, 说明饲料中的糖对其没有显著影响; 饲料中糖种类对欧洲海鲈[28]G6Pase活力也无显著影响。在本试验中, 各组PEPCK和G6Pase活性差异不显著, 说明这两种酶活性不受淀粉种类的影响。
有研究表明, 当海鲷(Sparus aurata)[29]和暗纹东方鲀(Takifugu obscurus)[30]长期处于高血糖状态时, 会导致肝糖原异常积累, 对鱼类的生长不利, 在本试验中, 木薯淀粉组虹鳟的餐后1—7h血糖高于其余3个淀粉组, 但在9h后, 各组并无显著差异, 木薯淀粉组在摄食表现和肝脏健康上都与其他各组无显著差异, 且生长性能最好, 这可能是虹鳟对糖的利用性和耐受性较高的缘故。Bergot[31]的研究表明, 摄食含30%葡萄糖组饲料虹鳟增重率、饲料效率和蛋白质效率高于15%葡萄糖组, 也表明了在其耐受范围内, 较高水平的糖类可能有利于提高虹鳟的生长和饲料利用。
4 结论
在15%的淀粉水平下, 综合考虑增重率、血液生化指标、糖代谢酶和肝脏组织学等指标, 木薯淀粉较小麦淀粉、豌豆淀粉和玉米淀粉更适宜作为虹鳟饲料的淀粉来源。
