LIMD2基因表达对食管癌细胞增殖、凋亡及ERK/MAPK信号通路的影响
2022-08-12李险波张志强韩小勇甄志鹏李焕芬保定市第一中心医院胸外科河北保定07000河北省人民医院胸外科河北石家庄05005
李险波,张志强,韩小勇,甄志鹏,李焕芬,赵 钦 (.保定市第一中心医院胸外科,河北 保定 07000;.河北省人民医院胸外科,河北 石家庄 05005)
食管癌是消化道系统最常见的肿瘤之一[1],其病死率居世界第6位,是世界第八大癌症[2]。食管癌的发生发展涉及遗传、表观遗传、基因及蛋白异常表达等多种途径的改变[3],阐明食管癌的致癌分子机制对食管癌的靶向治疗具有重要意义。LIM结构域(LIM domain,LIMD)可广泛存在于真核生物中,能调控细胞黏附、运动和信号转导等相关基因表达,从而参与调节细胞生长发育进程[4]。LIMD家族中的LIMD2目前已被证实与人类癌症的发生和进展相关[5],且LIMD2已被确定为甲状腺乳头状癌淋巴结转移的生物标志物,成为了肿瘤进展的新效应器[6]。但LIMD2在食管癌中的作用尚未明确。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)磷酸化活化后,可从细胞质转移到细胞核,并激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路,调控细胞增殖、生长、分化、凋亡等生命活动过程[7]。且ERK/MAPK信号通路活化已被证实参与食管癌、结肠癌、甲状腺癌等多种癌症的发展过程[8]。有研究显示,LIMD2能够通过调控ERK/MAPK信号通路而影响甲状腺癌进展[9]。本研究就LIMD2对食管癌细胞增殖、凋亡的影响及分子机制展开分析,以期为食管癌的靶向治疗提供参考。
1 材料与方法
1.1 标本来源及细胞来源
选择2019年3月至2020年6月于保定市第一中心医院进行手术切除治疗的食管癌患者10例,留取新鲜的癌组织及对应的癌旁组织标本。患者术前均未接受化疗或放疗,10例患者中,男6例,女4例;年龄42~70岁;肿瘤最大径3~8 cm;高分化2例,中分化6例,低分化2例;TNM分期:Ⅰ期1例,Ⅱ期5例,Ⅲ期4例;淋巴结转移7例,无淋巴结转移3例。本研究经保定市第一中心医院伦理委员会批准执行(2018-B-566),患者均知情同意。
人食管癌细胞KYSE30、EC9706和人正常食管上皮细胞(HEEC)均购自宁波明舟生物科技有限公司,批号分别为18210615、18251481、18053217。
1.2 主要试剂与仪器
CCK-8试剂盒(批号8127165)购自福州飞净生物科技有限公司;RNA提取试剂盒(批号15181036)购自北京博迈斯科技发展有限公司;逆转录试剂盒(批号0621181809)购自美国GeneCopoeia公司;一抗ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK、细胞周期相关蛋白cyclin D1和CDK2、凋亡相关蛋白caspase-3、整合素β1、黏着斑激酶(focal adhesion kinase,FAK)、整合素连接激酶(integrin-linked kinase,ILK)均购自Abcam公司,批号分别为1513812、0627143、0825641、1315703、2164215、5108514、1003052、02190418、1652025、0583521;Q1600型qRT-PCR仪购自厦门和谱仪器有限公司;SpectraMax i3x酶标仪购自美谷分子仪器(上海)有限公司。
1.3 组织处理、细胞培养及分组处理
各新鲜食管癌组织及癌旁组织标本,剪取1 g置于-80 ℃冰箱保存,以备检测LIMD2 mRNA及ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK蛋白表达,剩余组织置于4%多聚甲醛中固定24 h,随后进行石蜡包埋、切片,以备免疫荧光染色检测LIMD2蛋白表达水平。
取人食管癌细胞(KYSE30、EC9706)和人正常食管上皮细胞(HEEC)常规复苏,随后用DMEM培养基(含10%胎牛血清及100 U/mL青霉素—链霉素)在恒温培养箱中常规培养及传代,待细胞达到90%融合度时收集,采用qRT-PCR及免疫荧光染色检测各细胞中LIMD2 mRNA及蛋白表达,选择LIMD2 mRNA及蛋白表达最高的EC9706细胞进行后续试验。
取EC9706细胞,按照1×105个/孔的密度接种于6孔板中,并设置为:对照组、Si-LIMD2组、Si-NC组、PD98059组、ISO组、Si-LIMD2+ISO组,每组6个复孔。对照组常规培养;Si-LIMD2组及Si-NC组分别转染含LIMD2干扰序列的腺病毒载体及不含LIMD2干扰序列的空腺病毒载体;PD98059组及ISO组参照文献[10-11]分别在培养基中加入终浓度为50 μmol/L的ERK/MAPK通路阻断剂(PD98059)及20 μmol/L的ERK/MAPK通路激活剂盐酸异丙肾上腺素(isoproterenol hydrochloride,ISO);Si-LIMD2+ISO组在Si-LIMD2组基础上加入ISO溶液(20 μmol/L)进行培养。各组培养24 h后进行后续试验。
1.4 qRT-PCR法检测细胞及组织LIMD2 mRNA表达
取1.3项下于-80 ℃保存的癌组织及癌旁组织,4 ℃解冻,冰上匀浆分离,随后用RNA提取试剂盒提取总RNA。取1.3项下的KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞,加入细胞裂解液,用RNA提取试剂盒分别提取总RNA。将提取的总RNA用逆转录试剂盒反转录得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒说明书进行PCR反应(反应体系:上下游引物各0.5 μL,2×SYBR mix 10 μL,10×cDNA模板1 μL,灭菌双蒸水8 μL。反应条件:94 ℃预变性14 min、94 ℃变性33 s、67 ℃退火57 s,55个循环,72 ℃延伸17 min),以GAPDH为内参,用2-ΔΔCt法计算LIMD2 mRNA表达水平。各引物序列由大连宝生物公司合成,见表1。

表1 引物序列表
1.5 免疫荧光染色检测细胞LIMD2蛋白表达
取1.3项下KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞进行细胞爬片,将爬片经4%多聚甲醛固定,曲拉通透化、封闭,而后加入一抗(LIMD2,1∶200)4 ℃孵育过夜,避光加入荧光二抗(异硫氰酸荧光素,1∶200),DAPI染核、甘油封片后于荧光显微镜下观察拍照,用Image Pro Plus 5.0分析图像,测定阳性表达的平均光密度值。
1.6 Western blot法检测相关蛋白表达
取1.3项下-80 ℃保存的癌组织及癌旁组织,4 ℃解冻,冰上匀浆分离,用蛋白提取试剂盒提取总蛋白,并用BCA法检测蛋白浓度。取1.3项下KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞,加入细胞裂解液,用蛋白提取试剂盒提取总蛋白,并用BCA法检测蛋白浓度。各取25 μg蛋白样品行电泳(浓缩胶80 V,分离胶120 V)及转膜反应200 mA,加入一抗(ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK、cyclin D1、CDK2、caspase-3、整合素β1、FAK、ILK抗体,1∶2 000;内参抗体β-actin,1∶2 000),4 ℃孵育过夜,加入辣根过氧化物酶二抗(1∶3 000),室温下孵育2 h。ECL显影曝光后用化学发光成像分析系统拍照并分析灰度值,每组试验重复3次。其中癌组织及癌旁组织只检测ERK/MAPK通路蛋白表达。
1.7 CCK-8法检测细胞增殖活性
取1.3项下培养24 h后的各组EC9706细胞,加入10 μL CCK-8溶液继续培养2 h,随后用比色法在450 nm波长下检测各组细胞OD值,以细胞培养液OD值为空白OD值,根据公式细胞生存率(%)=[(试验组OD值-空白OD值)/(对照组OD值-空白OD值)]×100%计算细胞生存率,以细胞生存率高低代表细胞增殖活性。
1.8 流式细胞仪检测细胞周期及凋亡率
收集1.3项下培养24 h后的各组EC9706细胞,加入100 μL结合缓冲液、10 μL FITC标记的Annexin-V溶液,室温避光孵育30 min,再加入5 μL碘化丙啶避光孵育5 min,随后加入400 μL结合缓冲液,在流式细胞仪下检测细胞周期和凋亡情况。
1.9 统计学分析
2 结果
2.1 食管癌组织中LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达
qRT-PCR结果显示,癌组织中LIMD2 mRNA表达高于癌旁组织(P<0.05),见表2。免疫荧光染色显示,癌组织中LIMD2蛋白表达高于癌旁组织(P<0.05),见图1。Western blot结果显示,癌组织中p-ERK1/2、p-p38MAPK蛋白表达高于癌旁组织(P<0.05),见图2、表2。

a:癌旁组织;b:癌组织图1 食管癌组织中LIMD2免疫荧光图片(×400)
表2 食管癌组织中LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达比较
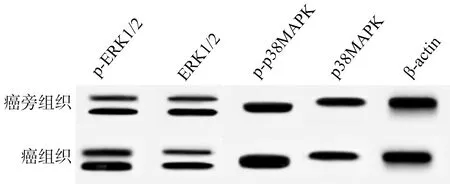
图2 食管癌组织中ERK/MAPK通路蛋白表达免疫印迹图
2.2 细胞中LIMD2表达
qRT-PCR结果显示,KYSE30、EC9706细胞中LIMD2 mRNA表达高于HEEC细胞(P<0.05)。免疫荧光染色显示,KYSE30、EC9706细胞中LIMD2 蛋白表达高于HEEC细胞(P<0.05),且EC9706细胞中LIMD2 mRNA、LIMD2蛋白表达高于KYSE30细胞,见表3、图3。
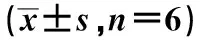
表3 细胞中LIMD2 mRNA、LIMD2蛋白表达比较
a:HEEC细胞;b:KYSE30细胞;c:EC9706细胞图3 细胞中LIMD2免疫荧光图片(×400)
2.3 各组EC9706细胞LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达
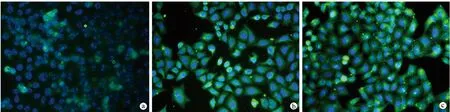
qRT-PCR及免疫荧光染色结果显示,与对照组相比,Si-LIMD2组LIMD2 mRNA、LIMD2蛋白表达较低(P<0.05),见图4、表4。Western blot结果显示,与对照组相比,Si-LIMD2组和PD98059组p-ERK1/2、p-p38MAPK蛋白表达较低(P<0.05),ISO组p-ERK1/2、p-p38MAPK蛋白表达较高(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组p-ERK1/2、p-p38MAPK蛋白表达较高(P<0.05),见表4、图5。
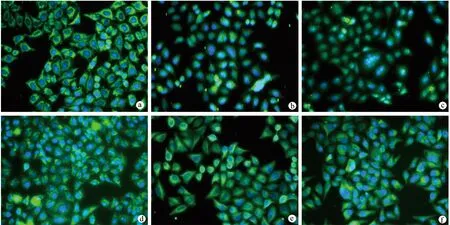
a:对照组;b:Si-LIMD2组;c:PD98059组;d:ISO组;e:Si-LIMD2+ISO组;f:Si-NC组图4 各组EC9706细胞LIMD2免疫荧光图片(×400)
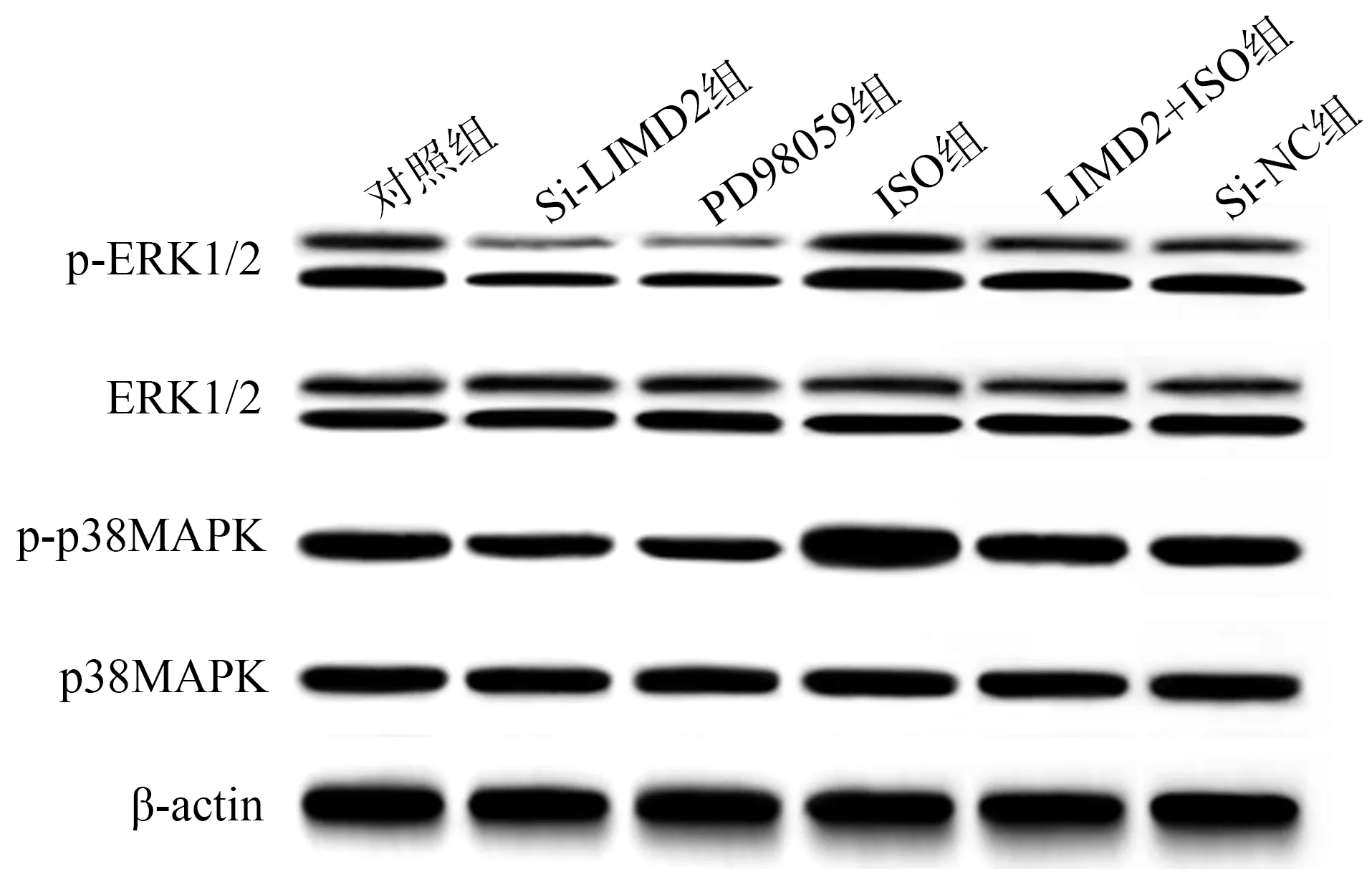
图5 各组EC9706细胞ERK/MAPK通路蛋白表达免疫印迹图
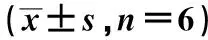
表4 各组EC9706细胞LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达比较
2.4 各组EC9706细胞增殖活性
与对照组相比,Si-LIMD2组和PD98059组细胞增殖活性较低(P<0.05),ISO组细胞增殖活性较高(P<0.05)。与Si-LIMD2组比较,Si-LIMD2+ISO组细胞增殖活性较高(P<0.05),见表5。
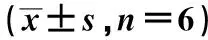
表5 各组EC9706细胞增殖活性比较
2.5 各组EC9706细胞周期及凋亡率
与对照组相比,Si-LIMD2组和PD98059组细胞G0/G1期比例较高,S期及G2/M期比例较低,凋亡率较高(P<0.05);ISO组细胞G0/G1期比例较低,S期及G2/M期比例较高,凋亡率较低(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组细胞G0/G1期比例较低,S期及G2/M期比例较高,凋亡率较低(P<0.05),见表6、图6。
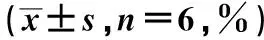
表6 各组EC9706细胞周期及凋亡率比较
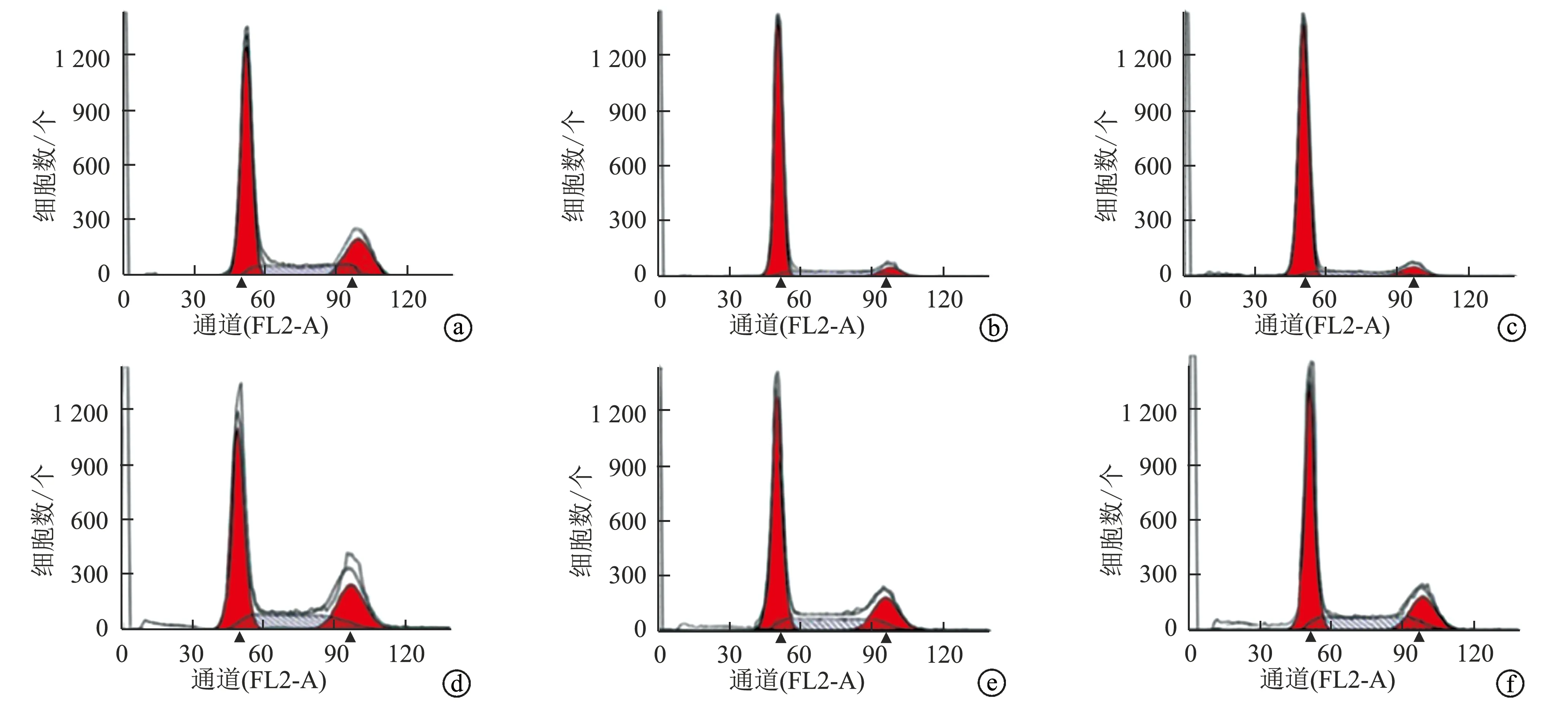
a:对照组;b:Si-LIMD2组;c:PD98059组;d:ISO组;e:Si-LIMD2+ISO组;f:Si-NC组图6 各组EC9706细胞流式周期图
2.6 各组EC9706细胞周期及凋亡相关蛋白表达
与对照组相比,Si-LIMD2组和PD98059组cyclin D1、CDK2蛋白表达较低,caspase-3蛋白表达较高(P<0.05),ISO组cyclin D1、CDK2蛋白表达较高,caspase-3蛋白表达较低(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组cyclin D1、CDK2蛋白表达较高,caspase-3蛋白表达较低(P<0.05),见表7、图7。

图7 各组EC9706细胞周期及凋亡相关蛋白表达免疫印迹图
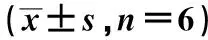
表7 各组EC9706细胞周期及凋亡相关蛋白表达比较
2.7 各组EC9706细胞FAK、ILK、整合素β1蛋白表达
与对照组相比,Si-LIMD2组和PD98059组FAK、ILK、整合素β1蛋白表达较低(P<0.05),ISO组FAK、ILK、整合素β1蛋白表达较高(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组FAK、ILK、整合素β1蛋白表达较高(P<0.05),见图8、表8。
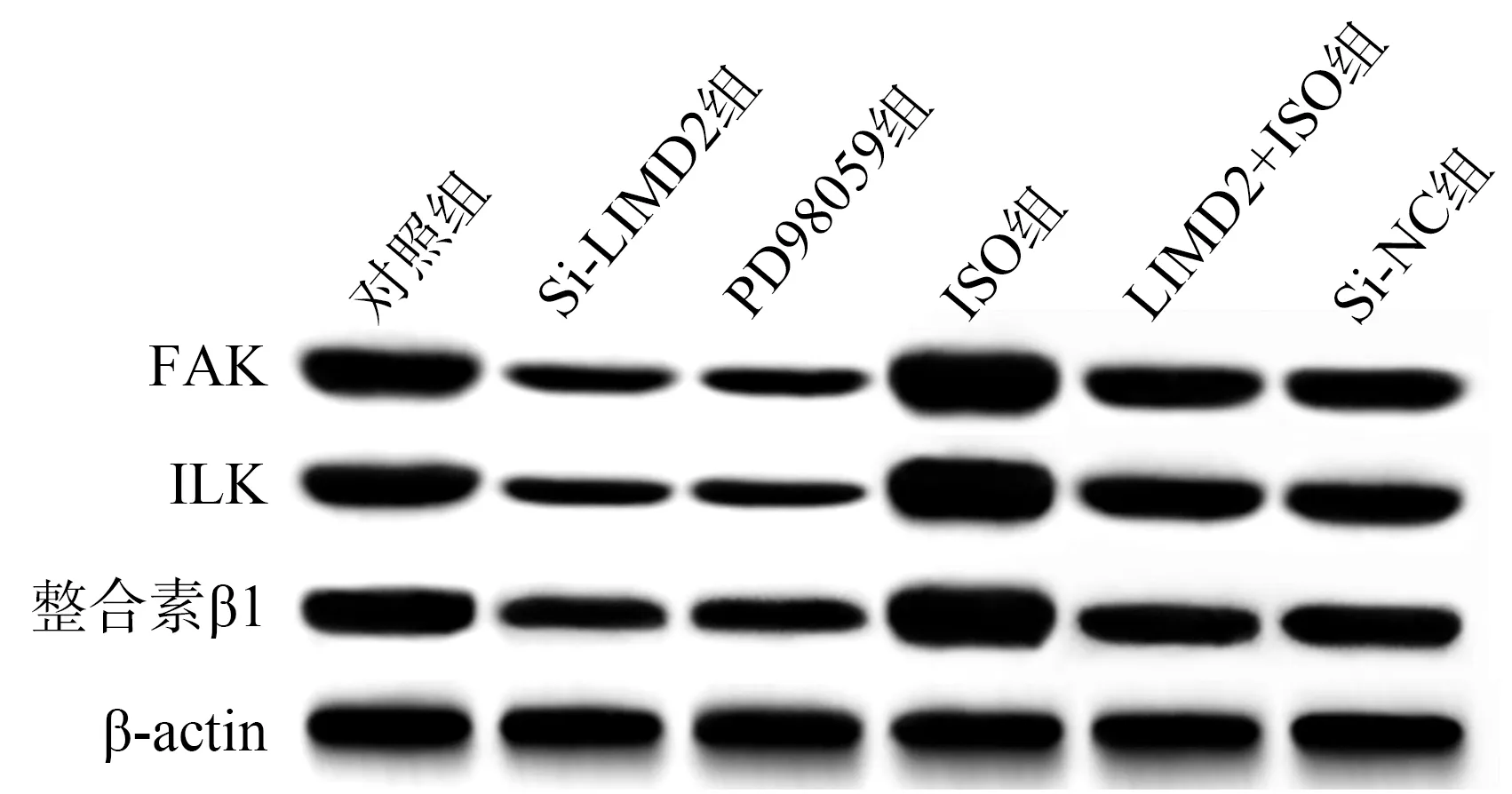
图8 各组EC9706细胞FAK、ILK、整合素β1蛋白表达免疫印迹图
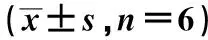
表8 各组EC9706细胞FAK、ILK、整合素β1蛋白表达比较
3 讨论
近年来研究发现,含LIMD的蛋白与人类多种肿瘤的生长及增殖密切相关,并逐渐受到肿瘤研究者的重视。Wang等[12]研究发现,LIMD家族的LIMD2可促进非小细胞肺癌细胞的增殖及侵袭进程。夏朝晖等[13]发现,LIMD2高表达与子宫内膜癌肿瘤分期及淋巴结转移浸润有关。LIMD2已在乳腺癌、膀胱癌、甲状腺癌、黑色素瘤等人类癌症中有较多研究,但LIMD2在食管癌中的作用尚未明确。本研究发现,LIMD2在食管癌组织及KYSE30、EC9706细胞中表达均较高,且在食管癌细胞中以EC9706细胞表达较高,提示LIMD2参与了食管癌的发生发展过程。本研究进一步沉默EC9706细胞中LIMD2表达后,发现细胞增殖活性降低,细胞周期阻滞于G0/G1期,细胞凋亡率增加,表明沉默LIMD2表达可显著抑制EC9706细胞增殖,并促进其凋亡,预示LIMD2可能成为治疗食管癌的潜在靶分子,但其具体调控机制还有待进一步探究。
据文献资料研究显示,LIMD2可在细胞质与细胞核之间穿梭,并组装蛋白,使原本无相互作用的蛋白产生级联作用,进而调控信号转导[14]。Pinheiro等[6]及Peng等[15]发现,LIMD2可直接与ILK结构域结合,促进ILK活化,引起细胞运动和侵袭性相关信号转导途径激活,参与癌细胞扩散过程。另外,ILK与整合素β1结合活化后,可促进整合素β1下游FAK/MAPK通路活化,从而调控细胞增殖、分化过程[16-17]。本研究发现,沉默EC9706细胞中LIMD2表达后,ILK、整合素β1、FAK蛋白及ERK/MAPK通路p-ERK1/2、p-p38MAPK蛋白表达亦减少,提示沉默LIMD2表达抑制EC9706细胞增殖,并促进其凋亡的作用可能与抑制ERK/MAPK通路有关。
MAPK与其通路中的重要分子ERK作用,将细胞外信号传递至细胞内,并调控细胞周期,将增殖信号传至细胞内,促进细胞周期相关蛋白cyclin D1及CDK2表达,进而增强癌细胞恶性增殖能力[18]。且ERK/MAPK通路已被证实是参与肿瘤细胞发生发展的重要通路[19]。本研究发现,ERK/MAPK通路p-ERK1/2、p-p38MAPK蛋白在食管癌组织中表达较高,用ISO激活EC9706细胞ERK/MAPK通路后,细胞增殖活性升高,G0/G1期比例较低,S期及G2/GM期比例较高,凋亡率较低,同时细胞周期蛋白cyclin D1及CDK2表达较高,凋亡相关蛋白caspase-3表达较低,反之用PD98059抑制EC9706细胞ERK/MAPK通路后,癌细胞显示出较低的增殖活性,且凋亡率升高,提示ERK/MAPK通路激活可能是促进食管癌恶性发展的诱因,这与以往文献研究结果一致[9-10]。本研究在沉默LIMD2表达的基础上用ISO激活ERK/MAPK通路,结果发现,沉默LIMD2表达抑制EC9706细胞增殖,并促进其凋亡的作用被逆转,证实LIMD2是通过调控ERK/MAPK通路参与食管癌的发生发展。
综上所述,沉默LIMD2表达可能通过抑制ERK/MAPK通路而抑制食管癌细胞增殖、促进其凋亡,这为阐明LIMD2参与食管癌发生发展的可能机制提供了一定理论依据。