具核梭杆菌激活Wnt/β-catenin信号通路促进结直肠癌细胞化疗耐药
2022-08-12魏攀凤邹智勇庄伊凡泉州医学高等专科学校基础医学部福建泉州36000厦门市思明区梧村街道社区卫生服务中心全科医学福建厦门36000厦门大学附属中山医院胃肠外科厦门大学医学院胃肠肿瘤研究所福建厦门36000
魏攀凤,邹智勇,庄伊凡 (.泉州医学高等专科学校基础医学部,福建 泉州 36000;.厦门市思明区梧村街道社区卫生服务中心全科医学,福建 厦门 36000;3.厦门大学附属中山医院胃肠外科/厦门大学医学院胃肠肿瘤研究所,福建 厦门 36000)
根据2020年全球癌症报告,结直肠癌的新发病例和病死率均排在前5位[1],晚期结直肠癌患者的5年生存率低于10%[2]。目前化疗仍然是晚期结直肠癌最重要的辅助治疗方法,然而固有或获得性耐药严重影响其治疗效果[2-3]。随着慢性病肠道起源学说[4]研究的深入,证实多种化疗[2,5]和免疫治疗[6]方案的有效性均与体内微生物组相关。
具核梭杆菌(fusobacterium nucleatum,Fn)主要定植于口腔,是一种普遍存在的促炎自源性细菌,与食管癌、结直肠癌等的发生密切相关[7]。Zhang等[8]的研究显示,唾液腺Fn基因可作为结直肠癌的潜在生物标志物,且Fn基因表达水平与结直肠癌患者的总生存期和无病生存期存在相关性。还有研究报道了Fn感染与结直肠癌[9]和食管鳞状细胞癌[10]化疗耐药性的潜在关系,但Fn的具体诱导效应和相关的分子机制尚不明确。因此,本研究拟建立Fn与结直肠癌细胞共培养模型,探讨其在结直肠癌化疗中诱导耐药的作用及相关机制。
1 材料与方法
1.1 实验材料
Fn标准株ATCC 25586(美国菌种保藏中心);人结直肠癌细胞株HCT-116(中国科学院上海细胞库);脑心浸出液肉汤(BHI)细菌培养基(北京华越洋生物)、RPMI 1640细胞培养基(武汉普诺赛生命科技有限公司);5-氟尿嘧啶(5-fluorouracil,5-FU;美国Selleck Chemicals公司);噻唑蓝(MTT)试剂盒(上海碧云天生物技术有限公司);Annexin V/PI染色试剂盒(江苏凯基生物技术有限公司);Pierce BCA Protein试剂盒(上海碧云天生物技术有限公司);兔抗人多药耐药相关蛋白1(multidrug resistance-associated protein,MRP1)、P糖蛋白(P-glycolprotein,P-gp)、Wnt2、β-catenin、β-actin多克隆抗体(北京博奥森生物技术有限公司)。
1.2 实验干预与分组
将HCT-116细胞水浴复苏,在37 ℃、5% CO2、含10%胎牛血清的MyCoy’s 5A培养基中培养,当细胞生长至80%~90%融合时,胰酶消化,传代培养。将细胞配成5×106/mL的细胞悬液备用。将Fn冻干粉接种在BHI-s血琼脂平板上,37 ℃厌氧培养48 h,重复洗涤,弃上清,用比浊法计算细菌浓度,调节细菌浓度至1×108/mL备用。参照Ma等[11]的方法,将Fn和HCT-116细胞按照病毒感染复数为100∶1的比例混合,于37 ℃、5% CO2中孵育12 h,制备细菌—细胞共培养(bacteria-cell co-culture,BCC)模型。
本研究设置4个组,将常规培养的HCT-116细胞设为对照组;Fn与HCT-116细胞共培养设为BCC组;采用5-FU(1.5 μmol·L-1)分别干预生长良好的对照组及BBC组细胞,并设为5-FU组和BCC+5-FU组。每组设5个复孔,实验重复3次。
1.3 MTT试验检测细胞活力
收集各组细胞,按每孔200 μL的密度接种于96孔板,加入不同浓度5-FU(低浓度20 μmol·L-1、中浓度40 μmol·L-1、高浓度80 μmol·L-1)进行干预,37 ℃、5%CO2孵育24 h。弃去原培养基,加入新培养基,每孔加入MTT溶液20 μL继续培养4 h,加入DMSO水平振荡溶解晶体,置于酶标仪检测各孔的吸光度OD值(490 nm),评估细胞活力。
1.4 细胞集落形成实验检测细胞增殖能力
取对数生长期的各组细胞,按照2×103个/孔的密度接种于6孔板孵育24 h。待细胞贴壁且生长良好后,加入60 μmol·L-15-FU继续培养2周,每2天更换1次新鲜加药培养基。终止培养,弃培养液,PBS浸洗,细胞固定液室温固定,Giemsa染液染色15 min,PBS清洗去浮色,空气干燥,相差显微镜下观察计数细胞集落形成情况。
1.5 流式细胞术检测细胞凋亡
将各组细胞按照1×105个/孔的密度接种于6孔板,待细胞贴壁且生长良好时加入60 μmol·L-15-FU,继续培养2周。终止培养,胰酶消化,以2 000 r/min离心5 min,取上清,0.2 mL预冷的buffer重悬细胞,分别加入5 μL Annexin V-FITC混匀,再加入5 μL PI染液混匀,室温避光孵育10~15 min,于1 h内上机,流式细胞仪(Ex=488 nm;Em=530 nm)检测细胞凋亡情况。
1.6 Western blot检测相关蛋白表达
收集各组细胞株,接种于细胞培养瓶中贴壁培养,加入60 μmol·L-15-FU,继续培养24 h。加入适量的PBS并用细胞刮刮下细胞,细胞悬液以10 000 r/min 4 ℃离心5 min后,加入适量RIPA细胞裂解液,充分裂解细胞获得总蛋白,取上清液,BCA法测定蛋白浓度。取各组样本50 μg上样,恒压(90 V、20 min,110 V 70 min)电泳,恒流(200 mA、60 min)转膜,5%脱脂奶粉封闭,加入一抗(1∶800)于4 ℃摇床孵育过夜,室温下水平摇床孵育二抗(1∶1 000)1 h,TBST漂液,ECL显影。以β-actin为内参,检测MDR1、P-gp、Wnt2及β-catenin蛋白表达。
1.7 统计学分析
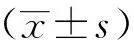
2 结果
2.1 Fn上调结直肠癌细胞活力
相较于对照组,BCC组结直肠癌细胞活力明显增加(P<0.05)。给予不同浓度5-FU干预后,各组结直肠癌细胞活力均降低,且呈浓度依赖性,差异均有统计学意义(P<0.05)。相同剂量的5-FU干预后,BCC组细胞活力均较对照组高(P<0.05),见图1。
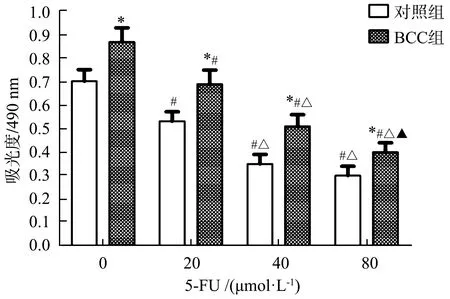
*:与相同浓度对照组相比,P<0.05;#:与0 μmol·L-1 5-FU相比,P<0.05;△:与20 μmol·L-1 5-FU相比,P<0.05;▲:与40 μmol·L-1 5-FU相比,P<0.05图1 Fn与结直肠癌细胞HCT-116共培养上调结直肠癌细胞活力
2.2 Fn影响5-FU抑制结直肠癌细胞集落形成能力
相较于对照组,BCC组结直肠癌细胞增殖能力更强(P<0.05)。给予60 μmol·L-15-FU干预后,5-FU组和BCC+5-FU组结直肠癌细胞集落形成数量均明显减少,但BCC+5-FU组结直肠癌细胞集落形成数量较5-FU组明显增加,差异均有统计学意义(P<0.05),见图2。
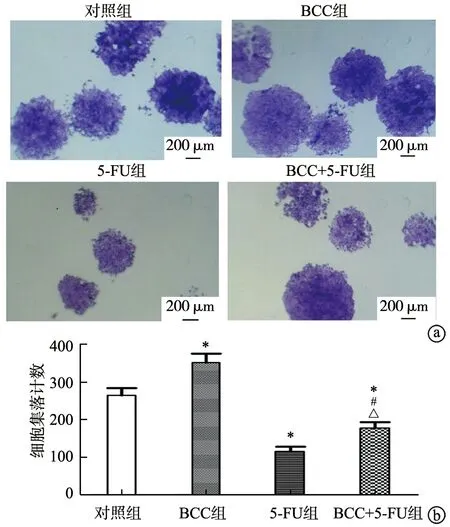
a:各组细胞集落形成情况;b:各组细胞集落计数定量图*:与对照组相比,P<0.05;#:与BCC组相比,P<0.05;△:与5-FU组相比,P<0.05图2 Fn与结直肠癌细胞HCT-116共培养拮抗5-FU促进结直肠癌细胞集落形成
2.3 Fn影响5-FU诱导结直肠癌细胞凋亡
BCC组结直肠癌细胞凋亡数量较对照组明显减少(P<0.05)。给予60 μmol·L-15-FU干预后,5-FU组和BCC+5-FU组结直肠癌细胞凋亡数量明显增加,且BCC+5-FU组结直肠癌细胞凋亡数量较5-FU组减少(P<0.05),见图3。
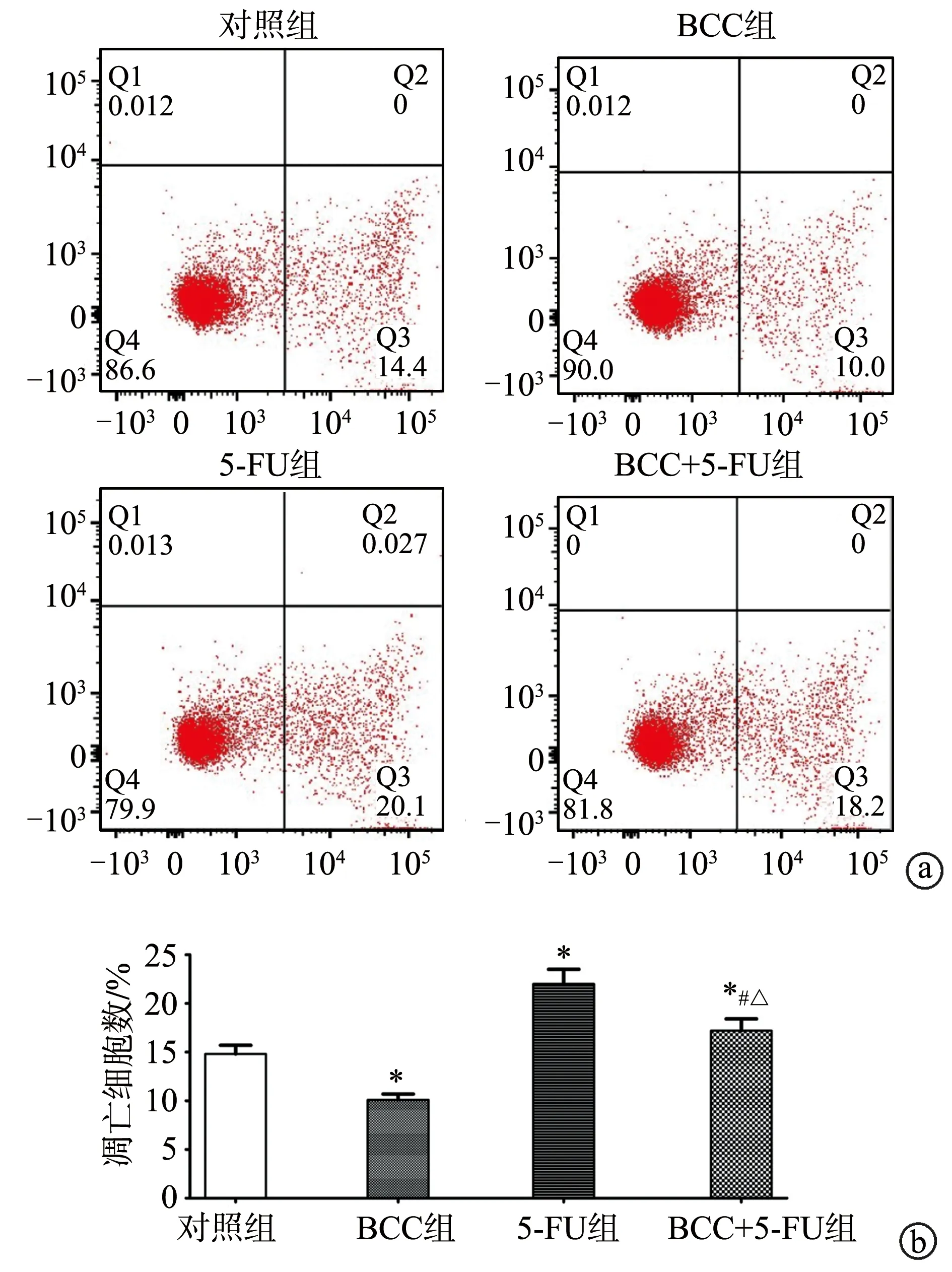
a:各组细胞凋亡情况;b:各组细胞凋亡计数定量图*:与对照组相比,P<0.05;#:与BCC组相比,P<0.05;△:与5-FU组相比,P<0.05图3 Fn与结直肠癌细胞HCT-116共培养拮抗5-FU抑制结直肠癌细胞凋亡
2.4 Wnt/β-catenin信号通路及化疗耐药相关蛋白表达
与对照组相比,BCC组结直肠癌细胞中MDR1、P-gp、Wnt2、β-catenin蛋白表达均明显增高(P<0.05)。给予60 μmol·L-15-FU干预后,5-FU组上述蛋白表达较对照组均显著降低(P<0.05)。与BCC组相比,BCC+5-FU组和5-FU组上述蛋白表达不同程度降低,但BCC+5-FU组MDR1、P-gp、Wnt2、β-catenin蛋白表达明显高于5-FU组(P<0.05),见图4。
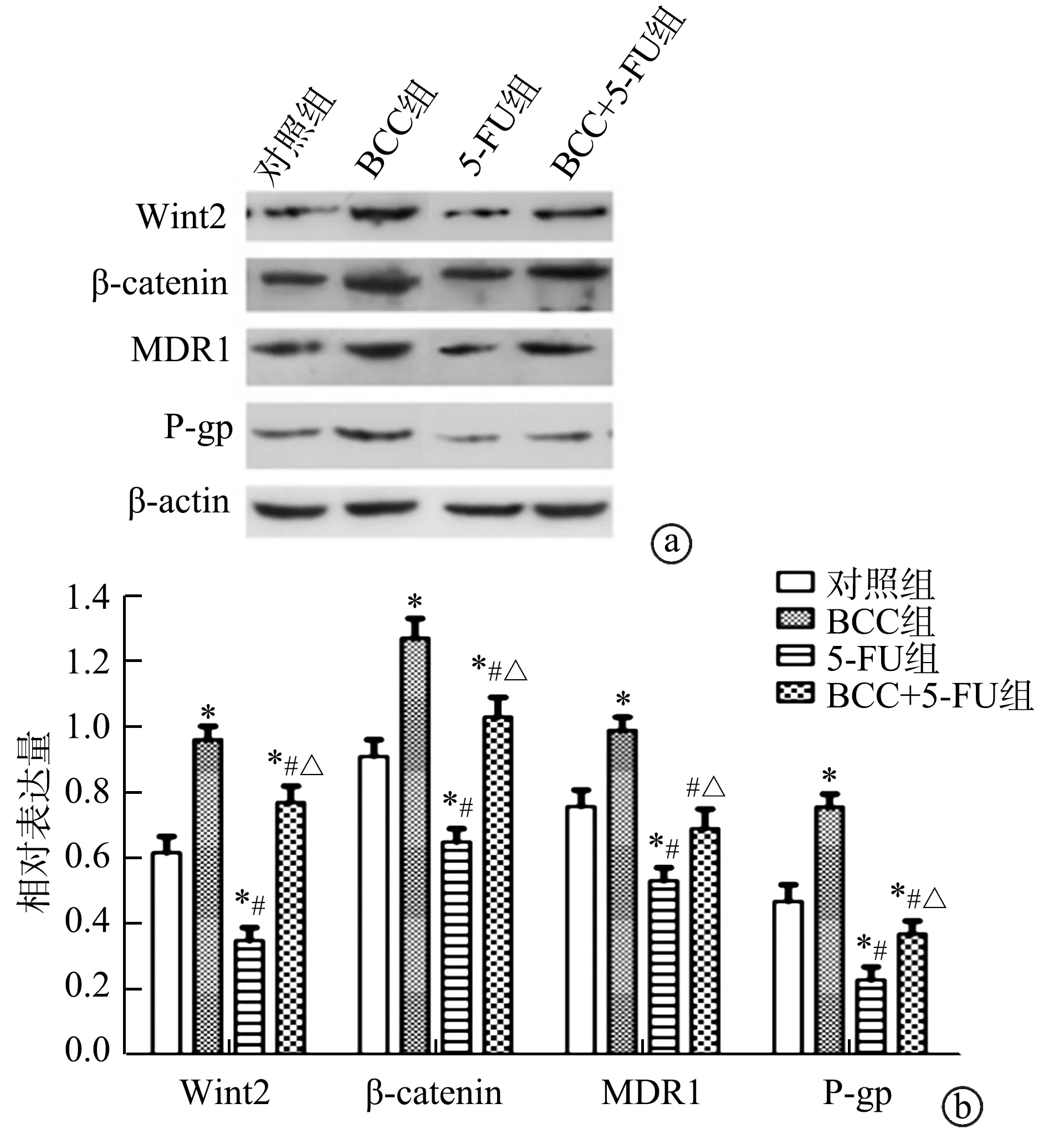
a:相关蛋白表达条带图;b:相关蛋白表达定量图*:与对照组相比,P<0.05;#:与BCC组相比,P<0.05;△:与5-FU组相比,P<0.05图4 FN与结直肠癌细胞HCT-116共培养拮抗5-FU激活化疗耐药蛋白表达
3 讨论
据统计,全球约20%的癌症与传染性病原体有关[12],如人乳头瘤病毒与宫颈癌有关,幽门螺杆菌与胃癌有关。近年来,越来越多的研究表明Fn在结直肠癌发生发展的各个阶段中发挥着至关重要的作用[13-14]。Ma等[11]使用Fn感染结直肠癌细胞NCM460发现,Fn感染可以增强结直肠癌细胞恶性表型,增强细胞的增殖和侵袭能力。Wu等[15]建立ApcMin/+mice小鼠实验模型,在患者近端结直肠癌组织中提取Fn进行为期8周的细菌饲喂实验,结果显示Fn能促进结直肠癌的发生。本研究建立Fn与结直肠癌细胞共培养模型,经检测发现,与Fn共培养可以增强结直肠癌细胞活力,促进细胞集落形成,减少细胞凋亡,还能够拮抗5-FU,增强结直肠癌细胞的化疗耐药性和增殖能力,Wnt/β-catenin信号通路过度激活调控ABC转运蛋白(MRP1及P-gp)高表达可能是其潜在的分子机制。
由于结直肠癌起病隐匿,大多数患者确诊时已处于中晚期或伴有淋巴结及远处转移,失去了手术的最佳时机,因此,联合化疗具有极其重要的辅助治疗价值[2-3]。FOLFOX(亚叶酸钙、5-FU、奥沙利铂)化疗方案是目前晚期结直肠癌患者重要的一线化疗方案之一[3]。在根治术后接受标准5-FU辅助化疗的晚期结直肠癌患者中,高Fn丰度与患者的临床病理特征及肿瘤复发状态密切相关[16]。本研究在对照组和BCC组基础上给予5-FU干预后,细胞集落形成均明显下调,且细胞凋亡水平明显升高;此外,BCC+5-FU组中细胞活力、集落形成的抑制作用和凋亡促进作用均较5-FU组明显减轻。提示肿瘤细胞与Fn共培养对化疗药物具有拮抗作用,可以削弱化疗药物对肿瘤细胞增殖的抑制作用,减少肿瘤细胞凋亡。Yu等[2]利用生物信息和功能学研究比较了共培养和不培养Fn的结直肠癌细胞HT29的基因表达谱,结果证实Fn促进了结直肠癌细胞对化疗的耐药性。
MDR1及P-gp是ATP结合盒式外排转运蛋白家族重要成员,其过表达被证明是产生化疗耐药最常见的机制之一,能使得大量结构、功能不同的抗癌药物(如5-FU、奥沙利铂等)被排出肿瘤细胞,是发挥化疗耐药作用的关键外排蛋白[16]。本研究发现,与Fn共培养可以促进结直肠癌细胞MDR1及P-gp蛋白表达,具有拮抗5-FU、诱导化疗耐药的作用。Wnt/β-catenin信号通路是ABCB1、MDR1及P-gp等耐药蛋白的上游调节通路,是结直肠癌等多种肿瘤发生、发展、转移以及化疗耐药的重要分子机制[17]。An等[18]在肠道益生菌的化疗增敏研究中发现,植物乳杆菌和5-FU联合处理结直肠癌细胞可以激活caspase诱导细胞凋亡,并通过抑制Wnt/β-catenin信号通路发挥潜在的抗癌作用。本研究发现,与Fn共培养能上调结直肠癌细胞Wnt2、β-catenin蛋白表达,且具有拮抗5-FU、诱导化疗耐药的作用。Rubinstein等[19]研究证实,Fn通过FadA黏附蛋白与膜联蛋白A正反馈诱导结直肠癌的发生发展,还发现Wnt/β-catenin信号通路的异常激活。Li等[20]研究发现,Fn能够通过分泌FadA诱导结直肠癌细胞上皮间质转化,从而增强细胞的迁移、侵袭能力,且该过程中伴有Wnt/β-catenin信号通路的激活。为了探究Fn介导的生长刺激,有研究利用Fn同时感染表达E-cadherin的肺癌细胞PC-9、前列腺癌细胞22RV1和乳腺癌细胞MCF7及不表达E-cadherin的膀胱癌细胞UMUC3,结果发现,Fn的生长刺激作用主要是通过介导FadA黏附蛋白与E-cadherin结合,激活Wnt/β-catenin信号通路,导致β-catenin核易位和炎症基因、Wnt基因、癌基因c-Myc以及Cyclin D1的过表达[19]。
值得注意的是,Fn能够分泌多种黏附蛋白(如黏附素Fap2),特异性结合GalGalNAc糖残基,而GalGalNAc糖残基被证实能在结直肠癌组织中过表达。这种由Fn介导形成的生物膜,可聚集大量机会致病菌,改变肠道菌群结构与功能,从而发挥免疫调节作用[21]。但是体内外环境的不同导致细胞学实验很难精准评估聚集多种致病菌的生物膜在结直肠癌发生发展中的作用。此外,人体与啮齿类动物的肠道菌群具有极大的异质性,因此建立啮齿类动物模型用于人体消化道系统Fn定植研究存在一定的局限性[22]。
综上所述,Fn能够通过激活Wnt/β-catenin信号通路促进结直肠癌细胞对5-FU化疗产生耐药性,促进肿瘤细胞增殖,抑制细胞凋亡。本研究是关于化疗过程中肿瘤细胞耐药问题的良好探索,为晚期结直肠癌患者化疗效果预测及临床个性化干预提供了一定的实验室基础。