枫香变红过程中叶片组织结构、光合特性及色素含量变化研究
2022-08-11尹国平刘雄盛杨继生肖玉菲黄荣林
尹国平, 刘雄盛, 蒋 燚*, 王 勇, 杨继生, 肖玉菲, 黄荣林, 姜 英
( 1. 广西壮族自治区林业科学研究院, 广西优质用材林资源培育重点实验室, 南宁 530002; 2. 广西大学, 南宁 530004 )
随着人们对优美生态环境需求日益增加,在森林景观营造和城乡绿化美化中,彩叶树种越来越受到青睐。彩叶树种因其亮丽丰富的色彩和较高的观赏价值而在现代化城市园林景观建设中发挥着越来越重要的作用,从而备受人们关注(Sheue et al., 2012;李卫星等,2017)。随着研究者对彩叶植物的不断研究,将彩叶分为色素型和结构型2大类。其中,色素型分为叶绿素亏缺型(叶绿体发生变化,叶绿素合成受阻)和其他色素型(如叶黄素或花色苷大量积累使叶片呈黄色或红色),而结构类彩叶则主要有表皮型和空隙型。表皮型表现为表皮细胞变异(乳状凸起、不规则形状等)和表皮细胞上附着其他物质(蜡质、绒毛等)使光线发生折射、衍射以及干涉而呈色,而空隙型叶片表皮细胞与栅栏组织细胞间存在较大气室,入射光在气室间形成漫反射,致使叶片呈现其他颜色(Sheue et al., 2012;王振兴等,2016;杜文文等,2019;梁玲等,2020)。目前,对彩叶树种叶片变化成因的研究多集中在色素的种类、含量及分布等方面(Rocca et al., 2011;冯露等,2017;李卫星等,2017),而对叶片组织结构与叶片呈色的关系研究相对较少。
枫香()为金缕梅科(Hamamelidaceae)枫香树属()落叶乔木,分布广泛(主要分布于我国秦岭及淮河以南各省,北起河南、山东,东至台湾,西至四川、云南及西藏,南至广东),适应性和耐火力强,天然易更新,入秋后,其叶片逐渐由绿色变为红色、紫色、橙黄等颜色(主要以变红为主),极具观赏价值,是优良的景观生态树种(王冬雪等,2017)。目前,王冬雪等(2019)描述了不同光质处理下枫香叶色变化过程中色素含量的变化;刘儒等(2017)描述了枫香叶色变化与色素的关系;罗紫东等(2016)研究指出随着枫香叶片逐渐变黄和变红,其净光合速率的光响应能力逐渐降低。然而,这些报道中并没有枫香叶色变化过程中组织结构变化的研究。因此,对于枫香叶色变色是由色素引起还是色素和结构两种兼而有之,尚未得出明确的结论。为此,本文以枫香变红植株为研究对象,通过连续监测自然条件下枫香叶片变红过程中叶片的组织结构、光合特性以及色素含量的变化,分析叶色变化过程中组织结构与光合特性以及色素的关系,旨在探讨叶片结构与枫香叶色变红的关系,为深入研究枫香呈色机理提供理论基础。
1 材料与方法
1.1 材料
所用材料来源于广西德保县红叶森林公园枫香天然林(106°39′5″ E、23°21′19″ N)。红叶森林公园地处北回归线以南,属亚热带湿润气候,以棕壤为主,占地总面积7.29 km,枫香林面积2.44 km。
采用平均木法,选取5株秋季叶片变红、生长健壮的成年枫香植株。从2018年9月底开始,在每株枫香树上选取东、南、西、北四个方向的枝条做好标记,每15~20 d观测和采集样品1次,自试验开始至结束共进行5次叶片观测和样品采样,分别标记为S1(2018-09-29)、S2(2018-10-13)、S3(2018-11-2)、S4(2018-11-22)、S5(2018-12-12),如图1所示。

S1. 全绿; S2. 变红面积<1/3; S3. 1/3<变红面积<2/3; S4. 变红面积>2/3; S5. 全红。下同。S1. All-green; S2. Reddened area < 1/3; S3. 1/3 < Some reddened area < 2/3; S4. Totally red area > 2/3; S5. All-red. The same below.图 1 不同变色时期枫香的叶片颜色Fig. 1 Leaf color of Liquidambar formosana at different discoloration stages
1.2 叶片解剖结构测定
在枫香变色的5个时期,分别对每株枫香取6片典型叶片,对每片叶片从叶基部以上1/3处(保留主脉)用单面刀片将叶片切成0.5 cm × 0.5 cm的小块,放入FAA固定液(体积比为70 %乙醇∶甲醛∶冰醋酸=90∶5∶5),固定24 h后,用于石蜡切片的制作。在每片叶片中部叶脉与叶片边缘之间切取 1.0 mm × 0.5 cm的小块,用2.5%戊二醛固定24 h后,先经磷酸缓冲液清洗,再用1%的锇酸固定2 h,用于叶片气孔超微结构观测。
采用常规石蜡切片法(刘雄盛等,2020),对处理后的叶片进行切片,对每个变色时期每株枫香选取3块组织,用每块组织制作3张切片,切片厚度为8 μm,用番红-固绿对切片进行双重对染,中性树胶封片,于Motic BA410型光学显微镜下观察。每张切片在叶脉和叶肉组织分别观察5个视野,并拍照,之后用Digmizer软件测定叶片栅栏组织、海绵组织以及上、下表皮等组织的厚度。各组织测量10个数值。
气孔超微结构观测参照齐红岩等(2009)的方法,对每个变色时期每株枫香选取3块组织,按常规系列乙醇丙酮脱水,醋酸异戊脂置换,在液态CO中干燥后进行样品粘台, 对其进行喷金处理,在S-450型扫描电子显微镜下观察并拍照。用Digmizer软件测量气孔长()、气孔宽()、气孔器长度()、气孔器宽度(),并计算气孔开度()、单个气孔器面积()。其中,=π ××,=π ××/4(π = 3.14)。每个处理观察10个视野,对每个视野随机选取30个气孔器进行测量。
1.3 光合作用日变化测定
光合特性的测定参照郭连金等(2017)的方法。在枫香变色5个时期,选择在连续3 d晴朗无风天气,采用LI-6400便捷式光合仪测定枫香植株叶片光合参数的日变化。测定时在每株枫香四个方向枝条上分别选取健康无病虫害的3个叶片作为测定叶。测定时间为7:00—17:00,每2 h测1次。采用自然光源,标准叶室(2 cm × 3 cm),测定指标有净光合速率()、蒸腾速率()、胞间二氧化碳浓度()、气孔导度()等。
1.4 叶片色素含量测定
在枫香变色的5个时期,在每株枫香东、南、西、北四个方向的枝条上分别随机选取健康完整的5片叶片,混合后用锡箔纸包裹住,放入液氮灌中短暂保存,带回实验室进行色素含量的测定。叶绿素和类胡萝卜素含量测定参照李合生(2000)的方法,称取0.2 g新鲜叶片粉末,加入5 mL 80%丙酮,置于4 ℃冰箱中避光浸提24 h,取上清液过滤后,利用UV-4802双光束分光光度计,分别测定445、645、663 nm处的吸光值,计算叶绿素a、叶绿素b、总叶绿素的含量及类胡萝卜素含量。
花色苷含量测定参照Kytridis和Manetas(2006)的方法,称取新鲜叶片粉末1.0 g,加入10 mL 1%盐酸甲醇溶液,于32 ℃恒温培养箱中浸提5 h,过滤,将滤液稀释5倍。利用双光束分光光度计测定530 nm和657 nm处的吸光值,计算花色苷含量。
1.5 数据统计分析
使用 Excel 2016软件对叶片结构和光合作用参数的数据进行常规统计和作图。运用SPSS 19.0软件对不同变色时期叶片结构和光合作用参数进行方差分析和多重比较(采用邓肯氏新复极差法),并进行叶片结构与光合作用参数的相关性分析。所有分析显著性水平均设定为=0.05。
2 结果与分析
2.1 枫香叶色变化过程中叶片结构特征的变化
枫香叶片为阔卵形、薄革质、掌状3裂,是典型的异面叶。横切面观:枫香叶片的叶肉由栅栏组织和海绵组织组成,栅栏组织由2层排列整齐、紧密的柱状细胞组成,海绵组织由3~4层形状不规则细胞组成,细胞大小不等,间隙大,排列疏松;枫香叶片的表皮由上表皮和下表皮组成,上表皮由1层椭圆形细胞紧密排列组成,下表皮由1层长条形或椭圆形细胞紧密排列组成(图2)。
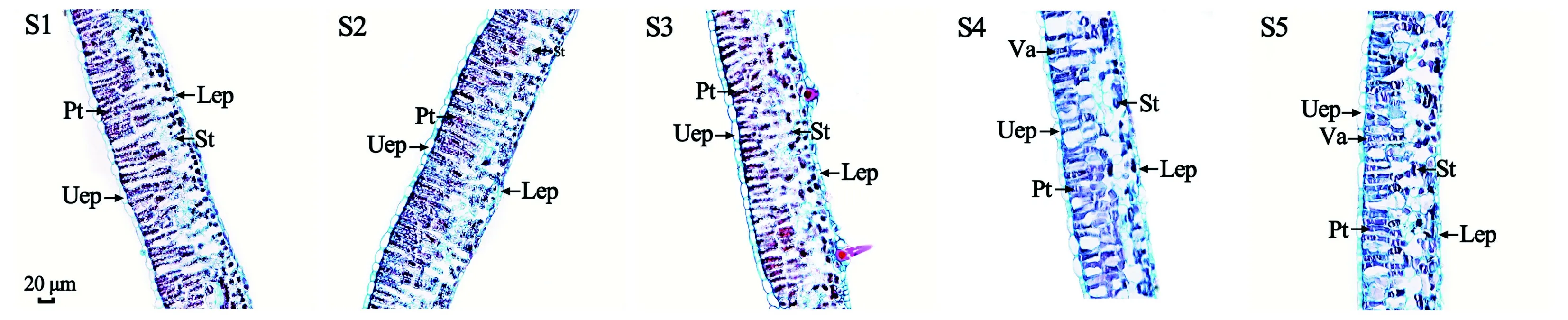
Uep. 上表皮; Lep. 下表皮; Pt. 栅栏组织; St. 海绵组织; Va. 液泡。Uep. Upper epidermis; Lep. Lower epidermis; Pt. Palisade tissue; St. Spongy tissue; Va. Vacuole.图 2 不同变色时期枫香叶片的叶肉解剖结构 Fig. 2 Anatomical structure of mesophyll of Liquidambar formosana leaves at different discoloration stages
不同变色期枫香的叶片厚度、上表皮厚度、栅栏组织厚度以及海绵组织的厚度均差异显著(<0.01),下表皮厚度和栅海比差异不显著(>0.05)(图3)。随着叶片逐渐由绿变红,叶片厚度、上表皮厚度、栅栏组织厚度以及海绵组织厚度均逐渐减小,下表皮厚度和栅海比呈波动性增减。S1时期时,叶片厚度、上表皮厚度、栅栏组织厚度、海绵组织厚度、下表皮厚度以及栅海比分别为170.53、14.58、82.18、62.70、10.60 μm、1.32,S5时期时,分别为122.23、12.76、53.01、45.59、9.23 μm、1.17,较S1时期分别减小28.3%、12.5%、35.5%、27.3%、12.9%、11.4%。
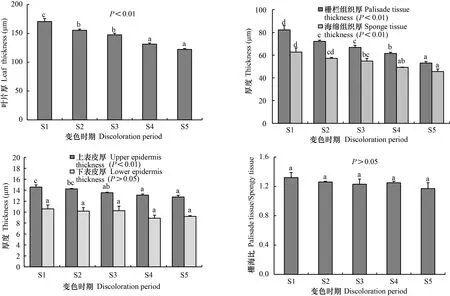
同一颜色柱子上不同小写字母表示差异显著 (P<0.05)。下同。Different lowercase letters on the same color column indicate significant differences (P<0.05). The same below.图 3 不同变色期叶片的横切面结构特征参数Fig. 3 Changes of leaf anatomical structure in different discoloration stages
通过扫描电子显微镜观察发现,枫香叶片气孔仅分布于下表皮,气孔器形状呈近圆形或椭圆形、外凸,排列方式不规则(图4)。由图5可知,不同变色时期枫香叶片气孔开度、气孔器长、气孔器宽、单个气孔器面积均差异显著(<0.05)。其中,随着叶片逐渐变红,气孔开度逐渐减小,S1时期最大(为28.33 μm),至S5时期减小(为15.12 μm);气孔器长、单个气孔器面积逐渐增大,均在S1时期最小,分别为18.54 μm、259.21 μm,至S5时期增大(分别为21.90 μm、377.97 μm);气孔器宽呈波动性增减,在S5时期最大(为21.99 μm),S1时期最小(为17.77 μm)。
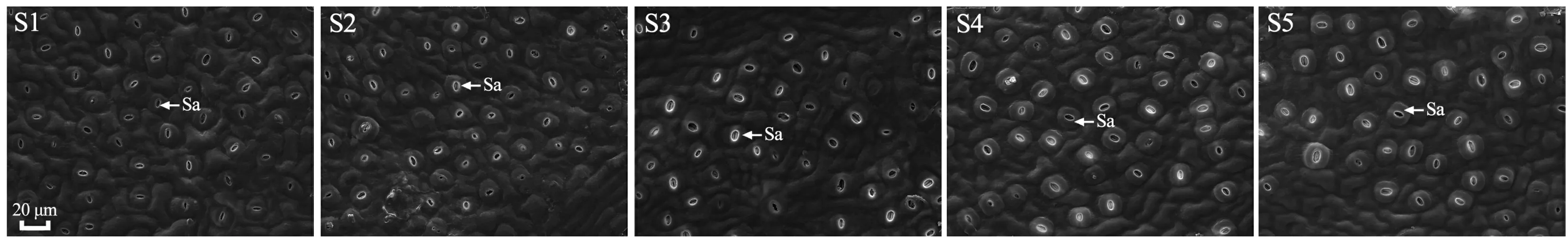
Sa. 气孔器。Sa. Stomatal apparatus.图 4 不同变色期枫香叶片的气孔分布特征Fig. 4 Stomatal distribution characteristics of Liquidambar formosana leaves at different discoloration stages
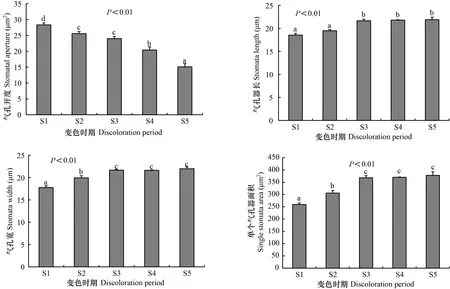
图 5 不同变色期枫香叶片的气孔特征Fig. 5 Stomatal characteristics of Liquidambar formosana leaves under different discoloration stages
2.2 枫香叶色变化过程中光合作用的日变化
由图6可知,枫香叶色变化过程中,各时期叶片净光合速率()日变化差异明显。其中,S1和S2时期叶片日变化趋势一致,均为双峰型,均在11:00时和15:00时达到高峰,13:00时出现光合“午休”现象;S3、S4、S5时期叶片日变化趋势一致,均为单峰型,S3时期在11:00时达到高峰,S4和S5时期均在13:00时达到高峰。各时期叶片胞间CO浓度()日变化趋势基本一致,均先降低后升高。其中,S1、S2、S4、S5时期叶片均在13:00时到达最小值,S3在11:00时到达最小值。各时期叶片气孔导度()日变化均呈先升高后降低趋势。其中,S1、S2、S3时期在11:00时达最大值,S4和S5时期在15:00时达最大值。各时期叶片蒸腾速率()日变化趋势不一。其中,S1和S2时期日变化呈波动性升降,均在11:00时达最大值,S3、S4、S5时期日变化均呈先升高后降低趋势,均在11:00时达最大值。
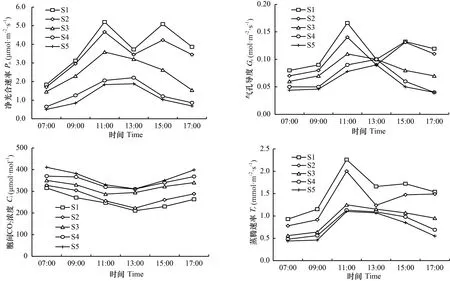
图 6 不同变色期枫香净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)的日变化Fig. 6 Diurnal variation of net photosynthesis rate (Pn), intercellular CO2 concentration (Ci), stomatal conductance (Gs) and transpiration rate (Tr) of Liquidambar formosana under different discoloration stages
就光合作用参数的日均值比较,叶片大小排序为S1>S2>S3>S4>S5,大小排序为S5>S4>S3>S2>S1,大小排序为S1>S2>S3>S4>S5,大小排序为S1>S2>S3>S4>S5。方差分析结果表明,不同变色时期枫香叶片、、、日均值差异均显著(<0.05)(表1)。
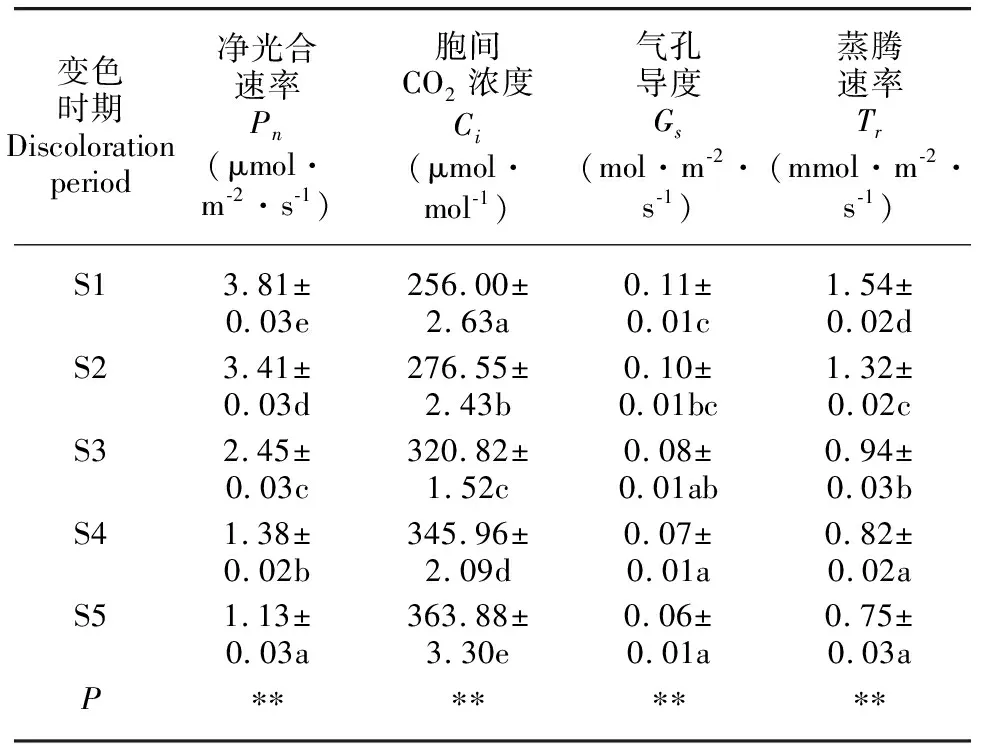
表 1 不同变色期枫香叶片光合作用参数的日均值Table 1 Daily mean values of photosynthesis parameters of Liquidambar formosana leaves under different discoloration stages
2.3 枫香叶色变化过程中叶片色素含量的变化
由图7可知,不同变色期枫香叶片叶绿素a、叶绿素b、类胡萝卜素、花色苷含量均差异显著(<0.05)。随着叶色逐渐变红,叶绿素a、叶绿素b含量均表现出持续减少的趋势,花色苷则持续增加,类胡萝卜素无明显变化规律。S1时期,叶绿素a、叶绿素b、类胡萝卜素、花色苷含量分别为0.469、0.319、0.973、0.155 mg·g;S5时期,叶绿素a、叶绿素b、类胡萝卜素、花色苷含量分别为0.189、0.086、2.348、0.113 mg·g,较S1时期叶绿素a、叶绿素b、类胡萝卜素含量分别减小59.6%、73.0%、14.5%,花色苷含量增加41.3%。随着叶片逐渐变红,各色素含量百分比变化明显,其中叶绿素a、叶绿素b百分比逐渐减小,至S5时期仅占总色素的9.8%、4.4%;类胡萝卜素百分比先增后减,在S2时期占比最大(为9.8%),至S5时期仅占5.8%;花色苷百分比逐渐增加,至S5时期占总色素的50.8%。
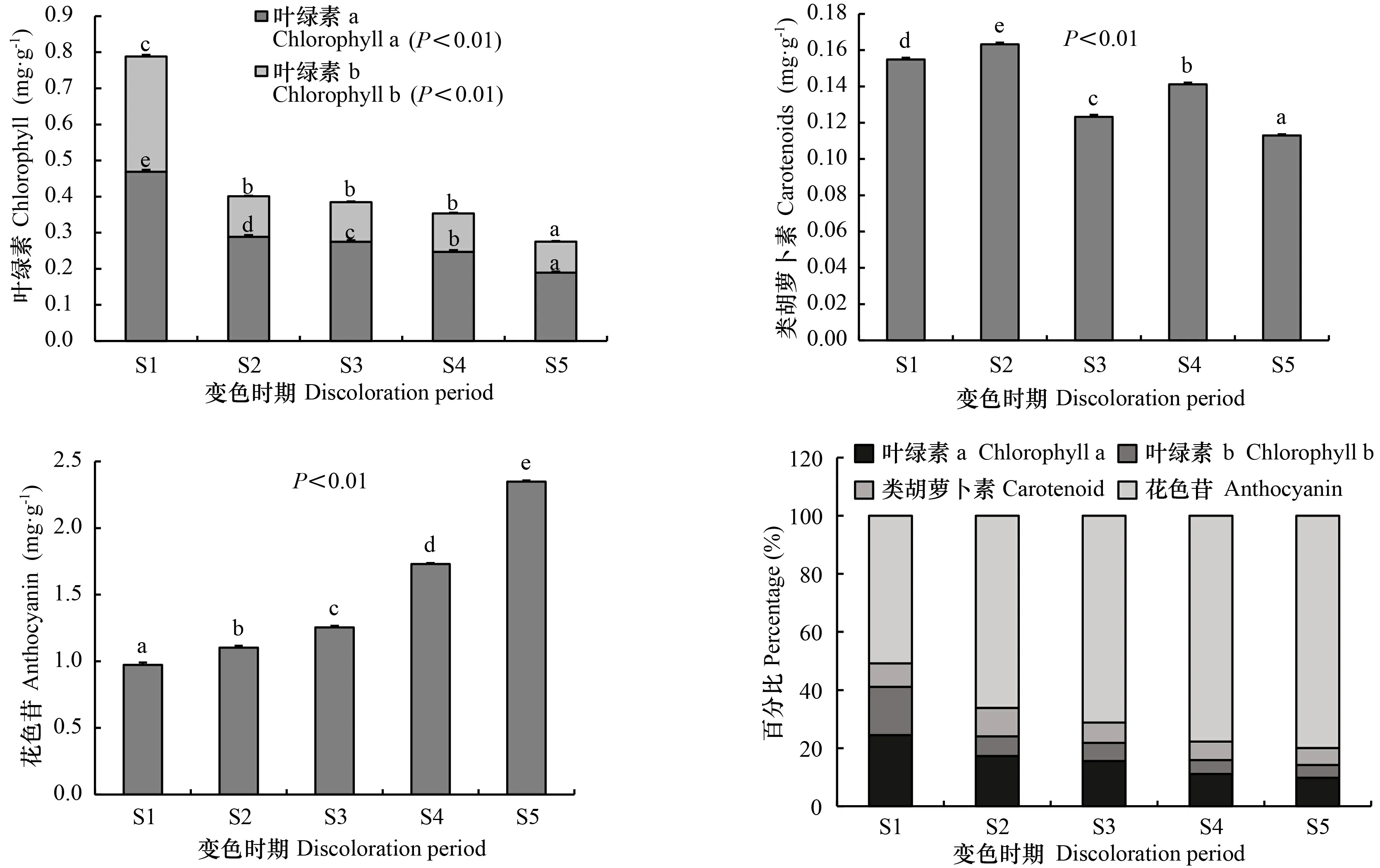
图 7 不同变色时期枫香叶片的色素含量Fig. 7 Pigment content of Liquidambar formosana leaves at different discoloration stages
3 讨论与结论
枫香叶片变色过程中,表皮细胞均为椭圆形,紧密排列,未观察到明显的细胞变异,也未发现绒毛和蜡质等明显的附着物,且上表皮细胞与栅栏组织细胞间排列紧密,未出现较大的气室。因此,枫香叶片变红与其表皮细胞结构及其细胞排列方式无关, 与苏佳露等 (2020)对6个彩叶竹种叶片解剖结构研究和孙旺旺等(2020)对金叶连翘(‘Sun Gold’)不同叶色解剖结构的研究结果一致。除表皮型和空隙型2种结构类彩叶外,一些植物彩叶的结构与正常绿色叶片相比差异显著。本研究中,枫香叶片不同变色期结构差异显著,叶片变色过程中其厚度、栅栏组织厚度和海绵组织逐渐减小,与金叶连翘叶片由绿转黄过程中叶片结构变化类似(孙旺旺等,2020),而与梁玲等(2020)对不同色彩珙桐()叶片解剖结构研究结果却相反,可能是因为珙桐为阴性树种(梁玲等,2020),而枫香为阳性树种,二者对环境的适应策略不同。落叶树种在叶片衰老、变色过程中,大部分可溶性糖、氮、磷等营养元素会被回收、转移至线粒体,为叶片脱落或失去光合能力后,通过线粒体呼吸维持冬季正常生理代谢提供能量(Keskitalo et al., 2005; Zhang et al., 2013)。因此,枫香叶片变色过程中叶片厚度、栅栏组织厚度和海绵组织厚度逐渐减小可能是由于营养物质被回收、转移所致。
栅栏组织和海绵组织是叶绿体的主要合成部位,栅栏组织和海绵组织厚度减小势必会导致叶绿体数量和叶绿素含量减少,叶片光合能力降低,在秋冬季节低温和强光条件下,最终导致光能的过剩,产生大量活性氧自由基,破坏植物叶片的光合机构,造成光抑制甚至光破坏,而花色苷能够吸收绿光和紫外光,反射红光和蓝光,从而起到滤光和消除活性氧、防止强光氧化胁迫和降低光抑制的作用(Zhang et al., 2011; Junker & Ensminger, 2016)。本研究结果表明,随着叶片逐渐变红,栅栏组织和海绵组的厚度逐渐减小,细胞排列逐渐松散,叶绿素含量减少,净光合速率随之逐渐降低,花色苷含量逐渐增加,至S4和S5时期,第二层栅栏组织明显退化,此时叶片叶绿素含量和净光合速率大幅下降,花色苷含量迅速升高,且栅栏组织细胞内出现大量液泡,Lee等(2003)研究指出红色叶片花色苷仅分布在栅栏组织柱状薄壁细胞的液泡中。这说明在叶片变色后期(S4~S5),可能出现光抑制甚至光破坏,致使叶片在栅栏组织细胞的液泡中合成大量花色苷以降低光抑制和光破坏,而大量花色苷的积累直接致使叶片变红。因此,叶绿素含量降低,花色素苷大量积累是导致枫香叶片变红的直接原因,枫香红色叶片属于色素型彩叶。
气孔是植物叶片与外界环境进行HO和CO等气体交换的门户,气孔开度和气孔器大小直接影响植物水分状况及CO同化(Hetherington & Woodward, 2003)。气孔控制水分和CO的进出,是调节光合作用和蒸腾作用的关键所在,气孔开度减小,能减少蒸腾损失,但气孔阻力增加,CO进入叶片受阻,导致光合速率下降(Peeva & Cornic, 2009; 可静等,2017)。本研究中,枫香叶片变色过程中,气孔开度逐渐减小,而胞间CO浓度逐渐增加,说明枫香叶片气孔开度减小,虽然减少了CO进入叶片的量,但叶片内被光合作用转化的CO量少于进入叶片CO的量,进而致使叶片内CO浓度逐渐增加(Zhang et al., 2013)。因此枫香叶片光合速率减小,并不是气孔开度减小,进入叶片的CO受阻所引起,而是由于秋冬季节干燥少雨,枫香通过减小气孔开度来增加气孔阻力以减少叶片水分散失,阻碍水分亏缺(文志等,2014)。Casson和Gray(2008)认为气孔大小主要受温度影响,温度降低气孔器长宽指数则增大;费松林等(1999)认为气孔器大小与最冷月温度有关,温度越低气孔器越大,枫香叶片变色过程中气孔器增大可能是为了适应外界低温环境。因此枫香叶片变色过程中气孔器形态特征变化是为了适应环境,与其叶色变化无明显的直接关系,是否存在其他或更深层次的关系还有待进一步研究。
综上所述,由于枫香叶片变红过程中表皮细胞未出现明显的变异以及绒毛和蜡质等附着物,且上表皮细胞与栅栏组织细胞间排列紧密,没有出现较大的气室,因此枫香不属于结构类彩叶。枫香叶片变红是由于枫香为回收、转移营养物质,叶片厚度和栅栏组织、海绵组织的厚度减小导致叶绿体数量和叶绿素含量减少,光合能力下降,在受到光抑制和光破坏时,合成大量花色苷来自我保护所引起,属于色素型彩叶。因此,枫香叶片变红是其一系列生理结构特征综合作用的结果,这些“特征综合体”反映了枫香对环境的适应以及资源利用策略。
