CD30在淋巴瘤中的表达及检测:现状与挑战
2022-07-26李小秋CD30阳性淋巴瘤病理专家组
李小秋,CD30阳性淋巴瘤病理专家组
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
CD30是肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)成员之一,即TNFRSF8,又被称作Ki-1抗原,最早由德国Karl Lennert等人在1982年发现,他们研制了作用于经典型霍奇金淋巴瘤(classic Hodgkin lymphoma,CHL)的肿瘤细胞——霍奇金/里-施细胞(Hodgkin/Reed-Sternberg cell,HRS)的单克隆抗体,并命名检测到的抗原为Ki-1[1],该蛋白后来被克隆并鉴定为TNFRSF8[2]。
1 CD30蛋白的结构及功能
CD30是I型跨膜蛋白,相对分子质量为120×103;其编码基因位于染色体1p36,有2种mRNA转录本,分别为3.4和2.3 kb。人类CD30分子共有595个氨基酸残基,包括细胞内域(188个氨基酸)、跨膜域和富含半胱氨酸的胞外结构域(362个氨基酸)三部分。胞外部分由6个半胱氨酸重复序列组成,与其他肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)家族具有显著同源性。在自身免疫性疾病和CD30阳性淋巴瘤中,CD30细胞外部分易被蛋白水解酶切割成相对分子质量为88×103的可溶性片段(sCD30),可分泌至血浆中并被CD30抗体检测到[3-4]。细胞质区C端由100个氨基酸残基组成了一段高度保守的序列,包含3个具有独立功能的亚结构域,分别为D1、D2和D3。其中D2和D3结构域含有肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factor,TRAF)蛋白结合位点,可与TRAF1、2、3、5蛋白结合,介导NF-κB信号转导通路的激活;而D1则无需结合即可激活NF-κB信号转导通路[1]。CD30还参与促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路,包括其亚家族ERK1和ERK2信号转导通路,它们在肿瘤细胞中具有多种促进细胞存活和抗凋亡的效应[2]。
CD30的配体(CD30L或CD153)是肿瘤坏死因子(tumor necrosis factor,TNF)家族的膜结合蛋白,其编码基因位于染色体9q33,由234个氨基酸残基组成,相对分子质量为26×103。该配体存在于活化的T细胞、静息性B细胞、粒细胞、胸腺上皮细胞的髓质和哈氏小体以及多种白血病细胞中[3-4]。CD30与配体结合后形成三聚体,激活细胞内结构域进行信号转导,例如募集TNFR相关因子(TRAF2和TRAF5),并激活下游信号转导通路。
2 CD30在不同类型淋巴瘤中的表达特征
CD30主要表达于活化的T细胞、B细胞和NK细胞表面,生理状态下表达水平较低;而在疾病状态下,例如病毒感染、自身免疫性疾病及多种淋巴瘤中,CD30会呈现较高水平表达[5]。
CD30的过表达对于几种淋巴瘤的确诊至关重要,例如在CHL和间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)中,近乎100%的肿瘤细胞表达CD30,因而CD30也早已被用作这两类淋巴瘤的诊断性标志物。此外,CD30在其他淋巴瘤亚型中也具有不同程度的表达(表1),包括弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)、原发性纵隔(胸腺)大B细胞淋巴瘤[primary mediastinal(thymic) large B-cell lymphoma,PMBL]、蕈样肉芽肿病(mycosis fungoides,MF)、淋巴瘤样丘疹病(lymphomatoid papulosis,LyP)以及其他多种类型的外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)等[5]。
霍奇金淋巴瘤约占所有淋巴瘤的11%,主要类型为CHL,其中近半数与EB病毒感染相关。在CHL中,所有肿瘤细胞均表达CD30,免疫组织化学染色显示典型的细胞膜和核旁点状阳性着色。与CHL不同,以结节性淋巴细胞为主的霍奇金淋巴瘤肿瘤细胞通常不表达CD30,但高水平表达CD20[14,19]。
ALCL是一组生物学行为高度异质、侵袭性不等的T细胞肿瘤,约占所有非霍奇金淋巴瘤的2%~8%[20],又分为原发性系统性ALCL(并进一步分为ALK+与ALK-两组亚型)、原发性皮肤ALCL以及乳房植入物相关性ALCL等不同亚型。此类肿瘤的瘤细胞通常也高水平表达CD30抗原,其中,ALK+ALCL还特征性地表达ALK融合蛋白。原发性皮肤ALCL属于皮肤CD30阳性T细胞淋巴增生性疾病之一,后者还包括LyP以及交界性病变,诊断此类疾病,常需与其他CD30阳性的皮肤病(例如真菌病或其他CD30阳性的炎症或反应性病变)作鉴别[21]。
除了ALCL,CD30在其他多种PTCL亚型中也有不同程度的表达。这包括AITL、PTCL,NOS、EATL以及ENKTCL等。约64%的PTCLNOS病例表达CD30[10]。有研究[22]对340例PTCL-NOS样本作回顾性分析,以20%细胞阳性作为阈值,32%的病例为CD30阳性。
CD30在各型B细胞淋巴瘤中的表达状态变异较大,总体而言,15%~20%的B细胞淋巴瘤表达CD30[23-24];其中,DLBCL表达CD30者相对多见,14%~25%病例CD30阳性,特别是EB病毒阳性的DLBCL,常伴有CD30过表达[14,16]。曾有研究[16]提示,在非EB病毒相关性肿瘤中,CD30阳性的DLBCL可能具有较好的预后和独特的基因表达特征。
3 CD30检测方法及其优缺点
淋巴瘤CD30表达的检测方法主要包括免疫组织化学法、流式细胞术(flow cytemetry,FCM)和酶联免疫吸附分析法(enzyme-linked immunosorbent assay,ELISA)等,可单独或联合使用。目前,临床多用免疫组织化学法,有时结合FCM判断。FCM的优点是灵敏、快速,且能同时分析CD30阳性细胞的其他表型(如细胞谱系),但需用新鲜样本检测限制了其广泛应用。相对于FCM,免疫组织化学法的优点在于可以原位检测抗原的表达情况,即对感兴趣的细胞进行形态学鉴定和抗原表达水平评估[25]。免疫组织化学还可对4%甲醛溶液固定、石蜡包埋样本进行回顾性分析。免疫组织化学法的不足之处在于通常一次只能检测单个标志物,虽然已有一些双标记技术,但一时还难以做到更多标志物的同时染色。
4 CD30检测和结果判读所面临的挑战
尽管CD30的免疫组织化学检测已成为淋巴瘤诊断和预后评估的重要生物标志物,相应检测及结果判读时仍面临诸多挑战,主要包括部分技术性缺陷和判读标准不统一的问题。
4.1 技术问题所导致的免疫组织化学染色质量不理想
影响免疫组织化学染色质量的最常见技术问题包括标本固定延迟和固定不充分(导致不同程度的抗原丢失和细胞结构破坏)、过度固定且抗原修复不足(热修复时间太短或温度较低)、一抗浓度过低以及整个免疫组织化学检测平台或方法灵敏度较差。其他因素还包括脱钙对抗原的影响、内源性过氧化物酶的存在、内源性生物素和亲和素的非特异性结合等。诸多技术环节都会影响到CD30染色质量和结果判读的准确性,甚至会影响到病理学诊断的准确性。
2017年CD30评估报告显示[26],在参与评估的病理实验室中,有17%的实验室存在CD30染色不充分的问题。免疫组织化学染色反应“不充分”的常见特征是着色弱、假阳性或定位不清,针对这些问题,该研究机构提供了一些改善措施和建议:例如,使用优质CD30抗体,Ber-H2、CON6D/5和JCM182这3种CD30抗体均可获得满意的染色效果,其中Ber-H2抗体更是多数病理学检测CD30最常用的抗体;抗原修复需在碱性缓冲液或改良的低pH值缓冲液中进行,配合使用灵敏度、特异性较好的免疫组织化学检测系统;扁桃体组织被推荐为阳性外对照:必须在滤泡间区活化的B细胞和T细胞以及生发中心边缘的活化B细胞上观察到中度强度以上的阳性染色,才能判断染色成功。浆细胞、巨噬细胞和内皮细胞有时也会出现阳性着色,这取决于实验室使用何种一抗。
4.2 CD30染色结果的判读
既往研究显示,即使面对同一张切片,病理学家评估CD30阳性肿瘤细胞的百分比和染色强度都很难达成共识。关于CD30 的染色结果判读,目前尚无统一标准,常用方法包括基于肿瘤细胞膜和(或)细胞质的染色强度与染色区域的百分比设定评分标准、或者按照染色强度分为0~3+共4个等级,即H-score[27]。上述评分方法曾用于一些特定的临床试验。当前,更普遍被接受的方法是评估中等强度以上阳性着色的肿瘤细胞所占的百分比,这就要求免疫组织化学染色具有较高的灵敏度和稳定性。染色流程的全程质控(包括组织固定、抗原修复、抗体、染色平台以及外对照的选择等)尤为重要。对于肿瘤细胞易于识别(如CHL)或者肿瘤成分相对单一、反应性细胞较少的病例(如绝大多数DLBCL和ALCL),应当判读所有肿瘤细胞中CD30阳性细胞所占的比例,而对于细胞构成较为复杂、难以精确辨识肿瘤细胞和反应性淋巴细胞的肿瘤(如相当多的PTCL),CD30阳性的淋巴样细胞总数占所有淋巴样细胞的比例亦可作为判读CD30表达水平的指标[28]。
此外,对CD30的免疫组织化学染色结果判读,还取决于组织处理和染色方法的优劣,影响因素包括但不局限于:细胞自溶会出现非特异性染色;坏死和凋亡细胞在内源性过氧化物酶的作用下,也常会出现假阳性;不同的组织,其免疫组织化学染色结果存在差异,即使同一张切片,也会因操作者或染色平台的不同而出现染色结果的差异。此外,不同的病理学家对CD30染色结果的判读也有差异,我们的实践经验表明,可以通过制订判读规范来减少观察者之间的差异,提高结果判读的可重复性。此外,应用计算机图像分析技术能兼顾阳性细胞的数量和染色强度变异,或许有助于更加精确地定量评估CD30的表达水平。
4.3 CD30阳性阈值的设定
靶向CD30的免疫治疗已在CHL和ALCL中取得显著疗效,但其能否为其他类型CD30阳性淋巴瘤患者带来临床获益,也是人们关注的热点之一,客观评估CD30的表达特征有助于临床医师作出治疗决策并评判疗效。CHL和ALCL几乎所有肿瘤细胞均高水平表达CD30[5],因此,对于CHL或ALCL病例,将CD30检测结果定性报告为阳性就已足够。随后的多项T细胞淋巴瘤临床研究将肿瘤细胞CD30阳性阈值界定于1%~20%[22]。最近,在联合使用靶向CD30的维布妥昔单抗和CHP方案(环磷酰胺、多柔比星、泼尼松)治疗CD 30阳性的PTCL的Ⅲ期大样本临床研究中,使用10%细胞阳性作为CD30的阳性阈值[29](表2)。
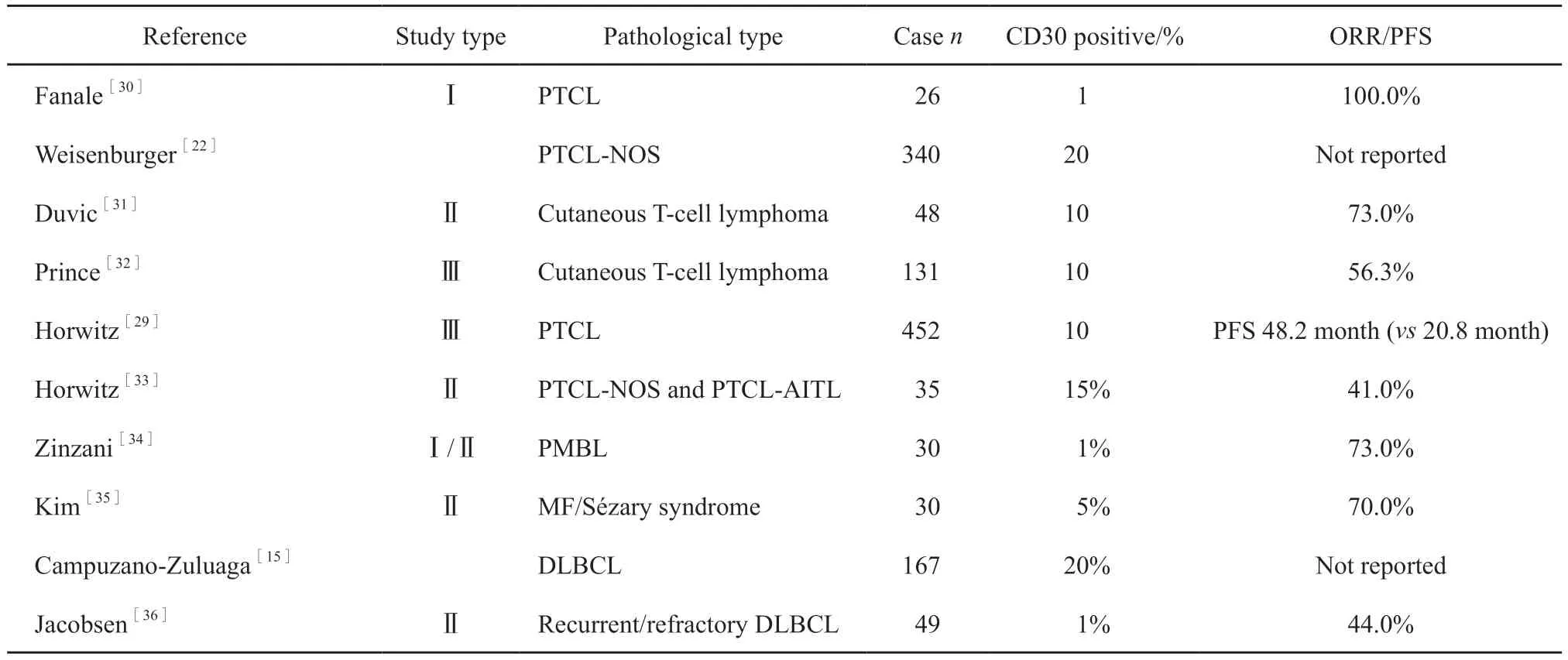
表2 淋巴瘤维布妥昔治疗临床研究中设定的CD30阳性细胞阈值Tab.2 CD30 positive cell thresholds set in the clinical study of lymphoma treated with vibtuxib
在DLBCL的临床研究中,有研究[15]回顾并分析了167例DLBCL样本,使用20%细胞CD30阳性作为阳性阈值,则有21%的病例为阳性病例,其中半数病例阳性细胞比例大于80%,为靶向CD30治疗提供了可能。Jacobsen等[36]使用1%细胞作为阳性阈值,发现DLBCL对维布妥昔单抗反应率为44%,其中,完全性缓解率17%,中位缓解时间为16.6个月,且维布妥昔单抗治疗反应与CD30表达水平之间并无关联。一项评估PBML使用纳武利尤单抗联合维布妥昔单抗治疗的研究[34]也用1%以上的肿瘤细胞或反应性淋巴细胞表达CD 30来界定阳性病例。
不难发现,不同的研究界定CD30阳性阈值具有较大的差异,研究结果也不尽相同,导致这一结果的原因可能是多方面的,但不排除部分是由于CD30检测方法和判读标准不一致所导致的差异。有鉴于此,病理实验室有必要加强CD30染色质控并统一阳性结果判读标准,提供精确的阳性细胞比例(而非仅仅是“阳性”或“阴性”的定性诊断)供临床医师参考来进行治疗决策。
靶向CD30的药物为CHL和ALCL患者带来了疗效获益,除了维布妥昔单抗联合化疗,还有多项临床研究探索该药联合免疫检查点抑制剂或其他靶向治疗药物的疗效。此外,以CD30为靶点的双特异性抗体类药物和嵌合抗原受体T细胞/NK细胞免疫疗法(CAR-T/CAR-NK)疗法也相继开展研究,这也使得CD30靶标检测适应证不断扩大。需要强调的是,通过免疫组织化学法对淋巴瘤CD30表达水平进行标准化和可重复性的评估,是筛选适合靶向治疗患者的重要前提条件,我们有必要进一步加强这方面的工作。
利益冲突声明:所有作者均声明不存在利益冲突。
