人参皂苷衍生化及生物活性研究进展
2022-07-22张浩然叶安琪张跃伟成乐琴
张浩然,叶安琪,张跃伟,成乐琴
吉林化工学院化学与制药工程学院,吉林 吉林 132022
人参皂苷衍生化及生物活性研究进展
张浩然,叶安琪,张跃伟,成乐琴*
吉林化工学院化学与制药工程学院,吉林 吉林 132022
人参皂苷是人参Panax ginseng的主要生物活性成分,特别是其降解产物次级稀有人参皂苷具有广泛的抗癌、改善记忆、提高免疫力、神经保护等作用,但由于水溶性低,生物利用度小,应用受到一定的限制。通过对人参皂苷分子的结构进行修饰,可以有效提高人参皂苷的水溶性、靶向性,从而提高生物利用率,显著提高人参皂苷的药物活性和减少毒副作用。对人参皂苷结构修饰策略及活性研究进行了综述,为人参皂苷及其衍生物在食品、药品等领域的深层次应用研究提供理论依据。
人参皂苷;次级人参皂苷;化学修饰;衍生化;生物活性
人参又称亚洲人参或高丽参,是伞形目五加科人参属植物人参Panax ginsengC. A. Mey的根,作为一种名贵中草药在东亚国家有数千年使用历史,被用作滋补药品或用于抗炎[1]、护肝[2]、神经保护[3]、美白[4]、抗肿瘤[5]等。人参皂苷是人参的重要活性成分,属于三萜类糖苷化合物,可分为原人参二醇组皂苷(PPD型皂苷)、原人参三醇组皂苷(PPT型皂苷)和齐墩果烷型,文献研究表明,已从人参根中分离出40多种人参皂苷[6]。
人参皂苷具有抗氧化、抗炎、血管舒张、抗过敏、抗糖尿病等多种治疗作用[7]。一些人参皂苷通过减少DNA损伤、减少宿主对突变的易感性、增加免疫监测和细胞凋亡等显示其抗癌特性[8]。此外,人参皂苷还能有效改善传统化疗药物的疗效,防止对正常组织的损伤[9-10]。
人参皂苷水溶性较差[11]、血药浓度低、口服吸收慢、生物利用度低[12],在一定程度上限制了人参皂苷的临床应用。研究表明,通过对人参皂苷的分子结构进行修饰,可以大幅度提高其水溶性[13]、稳定性[14]、靶向性[15-16],从而有效提高其药理活性[17]。近年来,对人参皂苷(特别是次级人参皂苷)的物理和化学修饰研究取得了一定进展,本文对人参皂苷的结构修饰方法及其药理活性进行综述。
1 人参皂苷的酰基化修饰
人参皂苷药动学研究表明,90%的口服人参皂苷经过体内肠道中结肠菌逐步裂解末端糖,得到20-O-β-D-吡喃葡萄糖基-达玛-24-烯-3β,12β,20S-三醇(M1)、20-O-α-L-呋喃阿拉伯糖基-(1→6)-β-D-吡喃葡萄糖基达玛-24-烯-3β,12β,20S-三醇(Mc)、20-O-β-D-吡喃葡萄糖基达玛-24-烯-3β,6α,12β,20S-四醇(F1)、3-O-β-D-吡喃葡萄糖基-20-O-β-D-吡喃葡萄糖基达玛-24-烯-3β,12β,20S-三醇(F2)、达玛-24-烯-3β,12β,20S-三醇(PPD)、达玛-24-烯-3β,6α,12β,20S-四醇(PPT)等稀有人参皂苷[18]。这些代谢产物经消化道吸收,通过血液循环进入肝脏,进一步酯化为人参皂苷脂肪酸酯,可在体内维持更长时间。现代药理学研究表明,人参皂苷脂肪酸酯在体内不良反应小、药物活性高,可能是体内真正的抗肿瘤活性物质,因此,脂肪酸酯化人参皂苷是一种极具潜力的候选药物。
Wei等[19]将人参皂苷Rh2溶解在氯仿中,缓慢加入辛酰氯和三乙胺,室温搅拌反应15 min合成了12,6′-二辛酰基人参皂苷Rh2即D-Rh2(2),见图1。体外人肝细胞QSG7701细胞MTT实验表明,D-Rh2对人肝细胞的细胞毒性作用明显低于人参皂苷Rh2;而对H22肝癌小鼠的体内抗肿瘤实验表明,D-Rh2的抗肿瘤活性与人参皂苷Rh2相当。与人参皂苷Rh2相比,D-Rh2在体外能显著降低对人肝细胞株QSG-7701的毒性,但不减弱体内抗肿瘤活性。D-Rh2对胸腺指数的增强作用表明,D-Rh2可能通过刺激淋巴细胞对肿瘤细胞产生细胞毒性作用而间接影响肿瘤的生长。
很多抗癌药物(如第3代铂类药物奥沙利铂)对癌细胞有很好的杀伤作用,但同时杀伤正常细胞,产生神经毒性、血液和胃肠道毒性、恶心和呕吐等不良反应[20]。人参皂苷Rh2经过羟基选择性酯化,在不降低抗癌活性条件下,可以显著降低QSG-7701细胞的毒性,减少对正常细胞的损伤,说明酯化可能是减少药物不良反应的一种良好的方法。
Zhang等[21]以人参二醇为原料,选择乙酸酐、棕榈酰氯和硬脂酰氯为主要试剂,合成了3种脂肪酸酯衍生物3β-乙酰氧基人参二醇(4)、3β-棕榈酸乙酰氧基人参二醇(5)和3β-硬脂酸乙酰氧基人参二醇(6)(图2)。
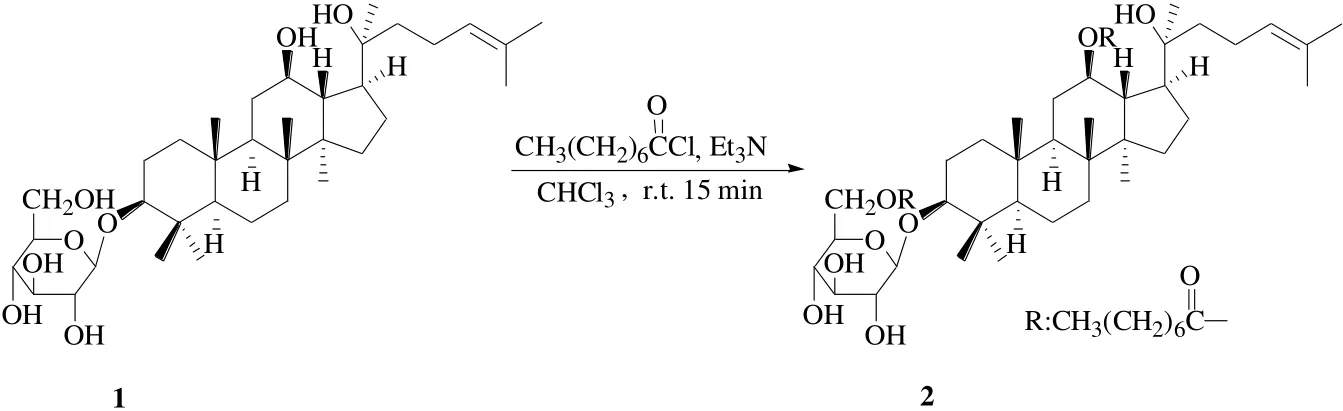
图1 人参皂苷Rh2的12,6′-二辛酰基脂肪酸酯衍生化Fig. 1 Derivatization of ginsenoside Rh2 with 12,6′-dioctanoyl fatty acid ester
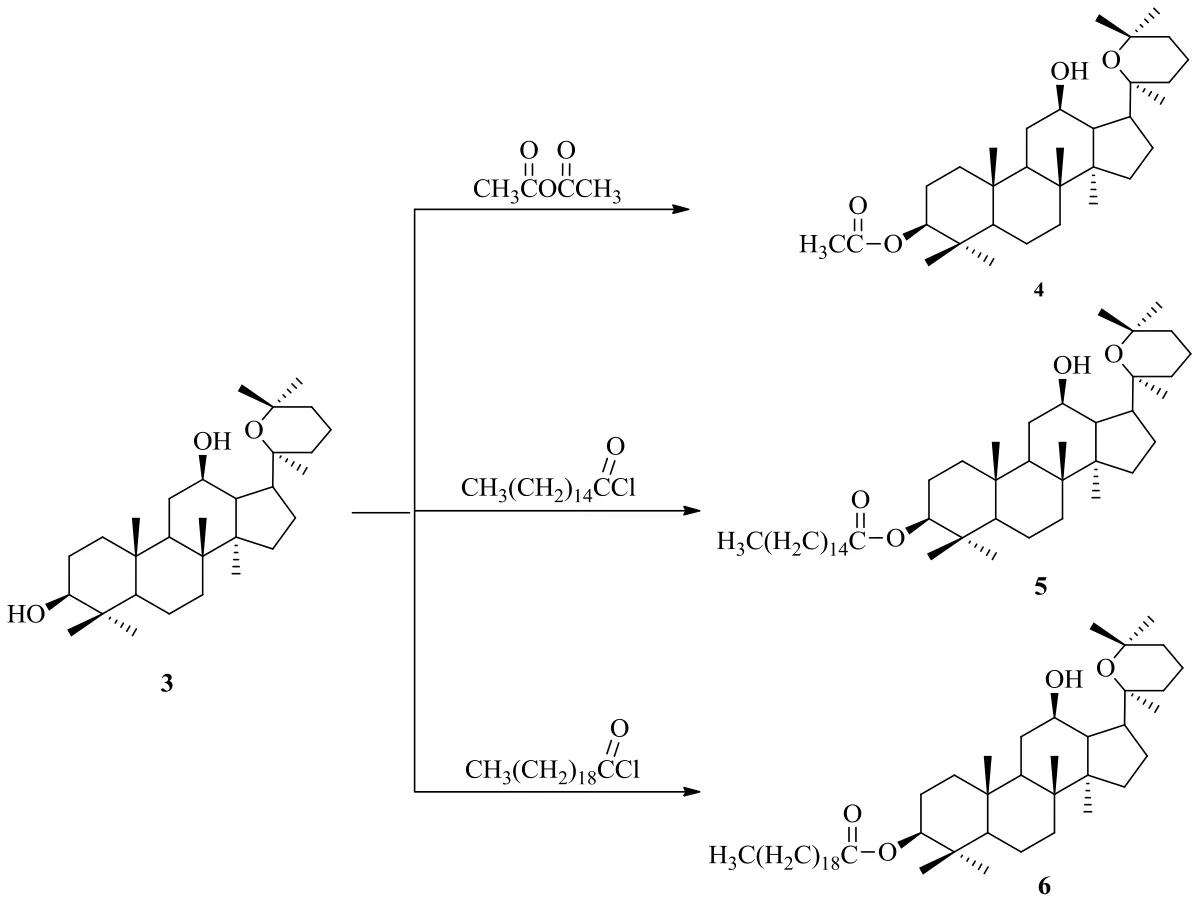
图2 人参二醇的脂肪酸酯衍生化Fig. 2 Derivatization of ginsengdiol with fatty acid ester
Zhang课题组[21]以5-氟尿嘧啶(5-FU)为阳性对照,用Vero细胞系检测了人参二醇脂肪酸酯的抗肿瘤增殖活性。MTT法检测结果显示,人参二醇的衍生物4具有较强的抗肿瘤作用,效果高于阳性对照5-FU,而化合物5和6的抑瘤作用均低于阳性对照组。这说明脂肪酸酯中脂肪链的长短对抗肿瘤效果影响显著,脂肪链短,抗肿瘤效果好,脂肪链长,抗肿瘤效果下降。
乙酰水杨酸是世界上最常用的药物之一。近年来有研究表明,乙酰水杨酸以及水杨酸均具有抗肿瘤活性[22-23]。Xu等[24]为提高人参皂苷和乙酰水杨酸的抗肿瘤活性,以三七皂苷的酸水解产物为原料,用水杨酸合成了人参皂苷水杨酸衍生物,在此基础上,进一步与乙酸酐进行反应合成了人参皂苷乙酰水杨酸衍生物(图3)。
对三七皂苷酸水解产物的水杨酸衍生化及乙酰水杨酸衍生化产物的细胞毒性测试以及衍生物对人类结肠癌HT-29细胞、胃癌bgc-823细胞、宫颈癌HeLa细胞、人类乳腺癌MCF-7细胞、人类肺癌A549细胞和2个普通癌症细胞系的抗癌活性评价结果表明,所有化合物均显示低毒性或无毒性(IC50>100µmol/L),进一步说明羟基的酯化是减少药物不良反应的良好途径。另外,人参皂苷乙酰水杨酸衍生物的抗癌活性明显强于人参皂苷水杨酸衍生物,其中,当化合物3中R2为X2,R3为H时对MCF-7细胞的抑制活性最强,IC50=(2.56±0.09)µmol/L,同样说明了乙酰化可以有效提高药物抗肿瘤活性。
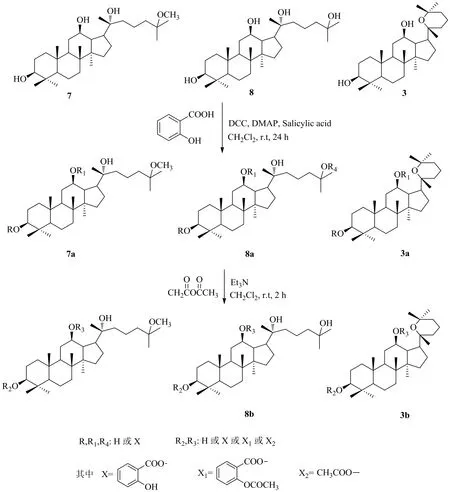
图3 三七皂苷酸水解产物的水杨酸衍生化及乙酰水杨酸衍生化Fig. 3 Derivatization of the product of notoginsenoside by acid hydrolysis with salicylic acid and acetylsalicylic acid
人参皂苷的酰基化研究表明,羟基经酰基化可以显著降低毒性,而且对不同酰基化产物的抗癌活性研究表明,人参皂苷乙酰化衍生物以及人参皂苷乙酰水杨酸衍生物的抗癌活性明显比其他酰基化产品好,而酰基的碳链增大时,抗癌活性明显降低。
2 人参皂苷的硫酸化修饰
人参皂苷Rh2是一种原人参二醇型甾体皂苷,C-3位连有1个吡喃型葡萄糖,C-12和C-20位连有与仲碳和叔碳相连的羟基。Fu等[25]采用常见的氯磺酸-吡啶法对20(S)-人参皂苷Rh2的吡喃型葡萄糖的6位羟基和C-12位羟基进行了选择性硫酸化反应,再通过碱中和得到了2种新型硫酸化衍生1a和1b(图4)。1a和1b对LPS诱导小鼠RAW264.7巨噬细胞的抗炎作用结果显示,经过硫酸化处理后的1a和1b水溶性大幅度增强,而且以剂量相关方式显著抑制炎症细胞因子和介质,上调抗炎细胞因子,显示出比人参皂苷Rh2更强的抗炎作用。
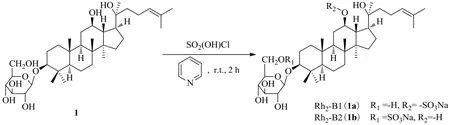
图4 20(S)-人参皂苷Rh2的硫酸化Fig. 4 Sulfation of 20(S)-ginsenoside Rh2
人参皂苷的硫酸化研究表明,将人参皂苷转变成硫酸氢酯,再将其转变成盐是提高其水溶性的良好的方法,水溶性的提高不仅提高了生物利用度,而且还增强了人参皂苷的抗炎活性。
随着新世纪各大高校校区建设热潮的掀起,国内各高校普遍具备校区集中、设备先进、场所多样、服务功能齐全的方形活动教室、圆形讨论室、生活中心、体育馆、多功能厅等,在这些便利条件的助推下,提高了学生之间的交往主动意愿,为实施朋辈导师制计划提供了充分的硬件保障。
3 人参皂苷的PEG修饰
人参皂苷通常在胃肠道内被水解酶降解[26-27]后吸收,因此其本身的口服生物利用率较低。随着对人参皂苷药动学的深入研究,人参皂苷的靶向给药制剂成为了研究热点。聚乙二醇(polyethylene glycol,PEG)是一种水溶性、非离子型、无毒的高分子材料,广泛应用于高分子药物的载体领域[28]。通过PEG对药物进行表面改性,可以提高药物的水溶性,保护药物不被蛋白水解,延长药物在血液中的循环时间,降低药物的毒性[29],同时PEG改性药物因存在酸敏感基团酯基,在肿瘤组织(通常显示弱pH环境)中可以发生酯降解释放出药物,从而提高药物的靶向性[30]。
Mathiyalagan等[31]为了提高CK(9)的溶解度,通过酯键在人参皂苷表面进行了PEG修饰(图5)。采用MTT法分析,用HT-29细胞检查了PEG-CK(10)和PEG的体外细胞毒性,发现与游离CK相比PEG-CK毒性较低,表明了亲水性聚合物的生物相容性。在弱酸性条件下(病理生理条件pH 5.0~6.5),PEG-CK偶联物释放CK的量大于正常条件(生理条件pH 7.4),这种非常高的药物溶解度、pH选择性、以及PEG-CK偶联物在病理生理位点的增强积累,可能会提高药物的整体疗效。
刘梅等[32]首先用PEG2000与丁二酸酐在吡啶存在下70 ℃反应24 h合成了单甲氧基聚乙二醇2000-琥珀酸单酯(mPEG2000-A),再利用人参皂苷Rg1(11)糖苷键上的羟基与单酯的酯交换反应合成了PEG-Rg1(图6)。通过人参皂苷Rg1和PEG-Rg1(12)在大鼠离体胃中的稳定性实验,发现人参皂苷Rg1经过PEG修饰后可以改善游离状态时在胃中容易分解的问题,稳定性大幅度提高。
与此同时,刘梅等[33]随机取2组SD小鼠,分别尾静脉注射人参皂苷Rg1和PEG-Rg1。通过2组小鼠在不同时间点各脏器及血浆中的药物分布,计算人参皂苷Rg1和PEG-Rg1的靶向系数。结果表明,PEG-Rg1对肾、肝、肺、心、脾、肝都有靶向选择性,肝、肾、肺组织的靶向系数分别为9.21、26.31、3.31,而未修饰人参皂苷Rg1只有肝的靶向系数大于1。由此可见,PEG-Rg1对各脏器的靶向选择性明显加强,其中肾组织的靶向选择性最高。
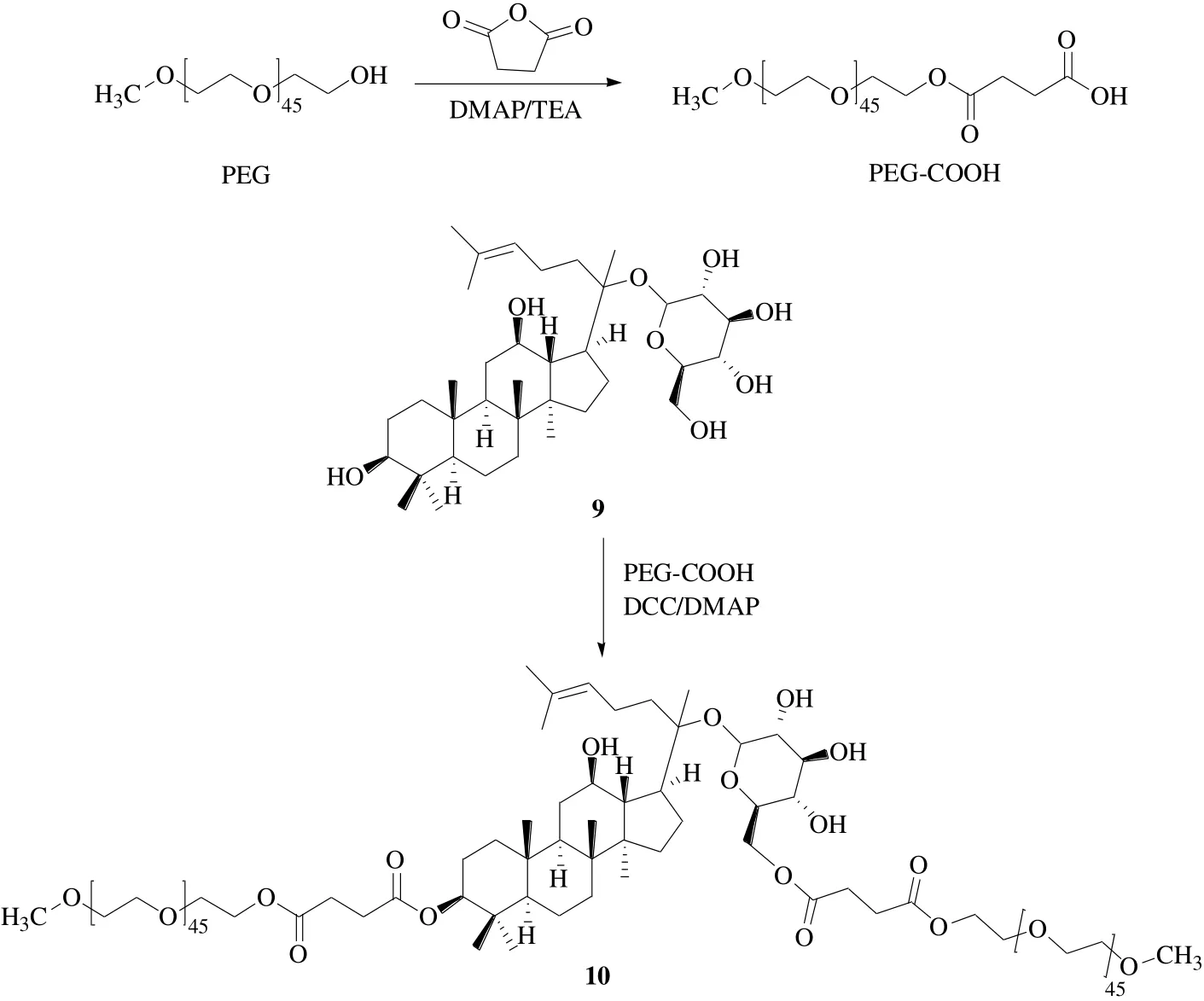
图5 人参皂苷CK的PEG衍生化Fig. 5 Derivatization of ginsenoside CK with PEG
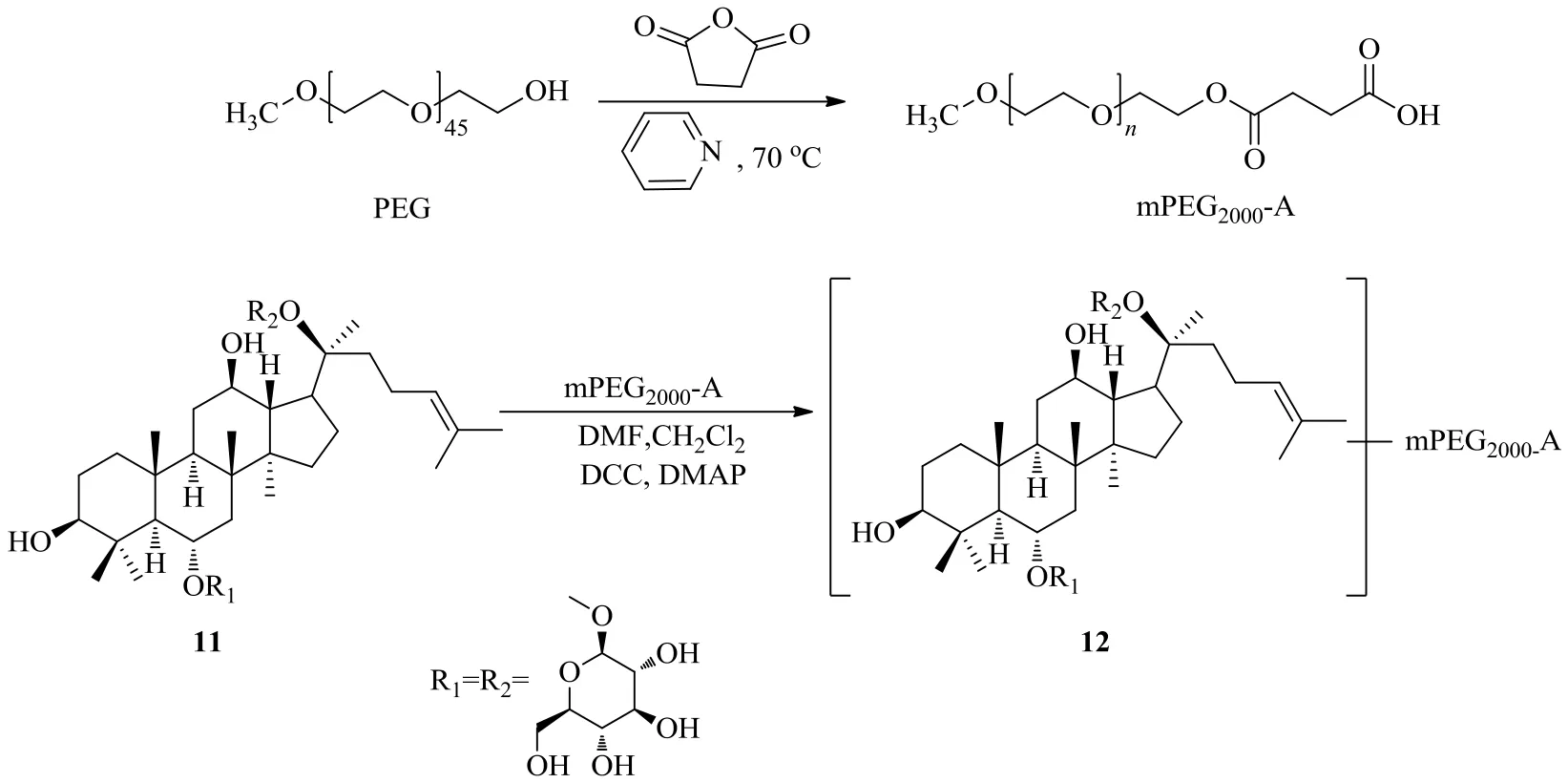
图6 人参皂苷Rg1的PEG衍生化Fig. 6 Derivatization of ginsenoside Rg1 with PEG
赵海军等[34]以对硝基苯氧酰化PEG为框架,利用硝基苯氧基易于离去的特性,在无水条件下将抗肿瘤特效药依托泊苷(vp16)结构中的酚羟基、人参皂苷Rh2(G-Rh2)糖结构片段上的6-OH以及PEG链两端的羟基共价连接,形成如图7所示的“疏水-亲水-疏水”的两亲性共聚物G-Rh2-PEG-vp16(13)。实验结果发现,化合物13体内外稳定性较好,且在pH 6.5的肿瘤组织环境下仍能释放足量的药物。化合物13共聚物采用中西药物结合,能够达到协同抗肿瘤的作用,是一种很有前景的新型抗肿瘤药物。
PEG结构中有重复的-OCH2CH2-结构单元,据报道[35],在-OCH2CH2-结构单元中的氧原子通过吸电子诱导效应使其周围具有较高的电子云密度,从而加强与水分子的氢键能力,提高水溶性。人参皂苷通过酯基连接PEG,借助PEG的强亲水性可有效提高水中溶解度和生物利用度,同时人参皂苷经PEG修饰后毒性减弱,稳定性增大,靶向性提高,特别是在肿瘤组织适宜存在的微酸性环境中容易分解释放药物,是癌症靶向治疗的良好途径。
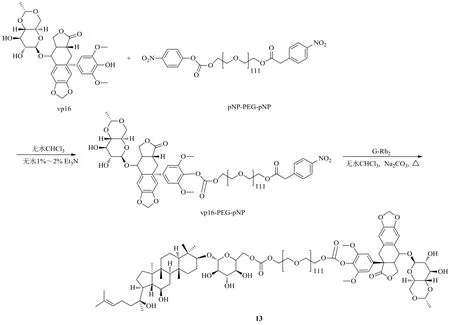
图7 人参皂苷Rh2的G-Rh2-PEG-vp16衍生化Fig. 7 Derivatization of ginsenoside Rh2 with G-Rh2-PEG-vp16
4 人参皂苷的氨基酸化修饰
氨基酸是指分子中同时拥有氨基和羧基官能团的化合物,氨基酸的羧基可与人参皂苷中的羟基以酯基形式结合。刘继华[36]以人参皂苷Rg3、人参皂苷Rh2、原人参二醇为原料,分别与叔丁氧羰基(Boc)或乙酰基保护的多种氨基酸进行反应,首次合成了原人参二醇型皂苷的氨基酸衍生物(图8)。研究表明,氨基酸分子的结构越大,与皂苷反应越困难;氨基酸化可以发生在1个羟基上生成单酯,也可以同时发生在多个羟基上生成多酯;与乙酰基保护相比,Boc保护的氨基酸反应后的产物相对少,后期分离纯化更简单。另外发现,氨基酸更容易与葡萄糖侧链的羟基发生反应,而且最容易发生反应的部位是Glc-6′位羟基。对氨基酸衍生物油水分配系数的测定表明,人参皂苷经氨基酸衍生化后水溶性明显提高,且蛋白结合率测定表明,衍生物抗癌活性作用可能提高。
25-OH-PPD是从人参果实中分离得到的一种有前途的抗肿瘤天然化合物。在研究中发现25-OH-PPD在体内可以抑制胃癌细胞生长,引起细胞周期阻滞,诱导癌细胞凋亡,但没有明显的宿主毒性,因此25-OH-PPD有望成为治疗癌症的理想药物[38]。为提高25-OH-PPD的抗肿瘤活性,Wang等[37]在25-OH-PPD的C-3和C-12处引入了可增加极性的氨基和可增加亲脂性的受Boc保护的氨基(图9),并研究了对MCF-7细胞、A549细胞和3种人类结直肠癌细胞增殖的抑制作用。在合成的20种25-OH-PPD的氨基酸化衍生物中,去保护氨基酸衍生物表现出更高的对癌细胞的毒性活性,此外衍生化所使用氨基酸侧链的类型及其生物活性之间显示出很强的相关性。
5 人参皂苷的氧化修饰
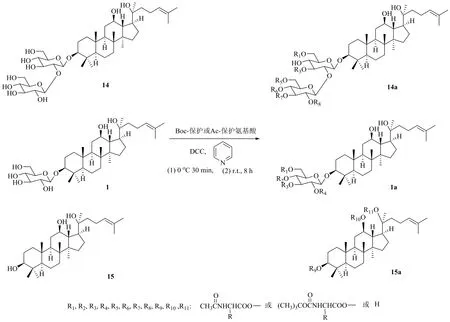
图8 20S-Rg3、20S-Rh2、20S-PPD的氨基酸衍生化Fig. 8 Derivatization of 20S-Rg3, 20S-Rh2, 20S-PPD with amino acid
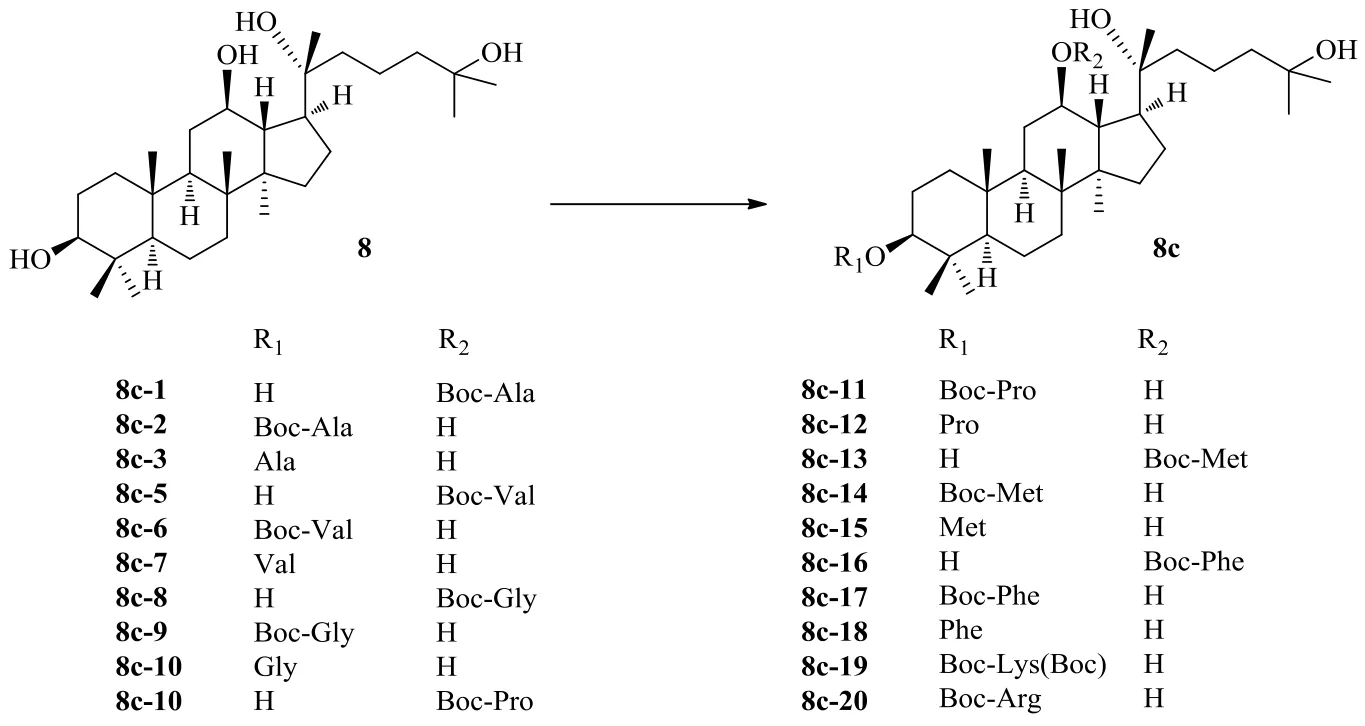
图9 25-OH-PPD的氨基酸衍生化Fig. 9 Derivatization of 25-OH-PPD with amino acid
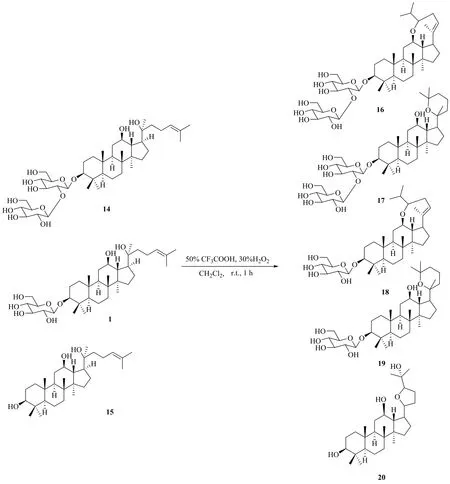
图10 20(S)-Rg3、20(S)-Rh2、20(S)-PPD的过氧酸氧化Fig. 10 Peroxyacid oxidation of 20(S)-Rg3, 20(S)-Rh2, 20(S)-PPD
人参皂苷不仅可以在支链发生氧化,在环上也可以发生氧化。有报道显示,PD环上的氧化产物和A环的开环产物对人类免疫缺陷病毒HIV和丙型肝炎病毒HCV蛋白酶有抑制作用[38]。受此启发,Zhang等[39]对PD进行了一系列有益的氧化合成反应(图11),以提高其抗肿瘤活性,并采用MTT法检测人参皂苷氧化产物对A549细胞、MCF-7细胞、人脑胶质瘤U87细胞、HeLa细胞、人卵巢癌8901细胞和正常人卵巢细胞株IOSE144的增殖抑制作用。对U87细胞的细胞毒性筛选结果表明,化合物1a、3和3d比阳性对照有更强的细胞毒性作用,其中化合物3的IC50值为(19.51±1.00)μmol/L,显示较强的抗肿瘤细胞增殖活性。对MCF-7细胞株的研究结果显示,1a和2的IC50值为17.73~23.58 μmol/L,其抗肿瘤活性优于IC50值为(29.4±0.7)μmol/L的5-氟尿嘧啶和IC50值为(52.62±2.39)μmol/L母体化合物PD。此外,3b对HeLa细胞的IC50值为11.65~19.60 μmol/L,表现出较好的抗增殖活性。
PD及其衍生化产品经PCC、O2、H2O2进行3个不同阶段氧化得到的产物的抗癌活性研究对比可知,第2阶段用O2氧化得到的产品24、27和30的抗癌活性分别比与之对应的第3阶段PCC氧化产物26和29以及第3阶段H2O2氧化产物25、28和31更高,说明A环的3-位羰基的α-位引入烯醇结构的活性优于其他氧化产物。
6 人参皂苷的氮杂化修饰
在天然产物中,主要分布于海蠕虫体内的氮杂环化合物具有明显的细胞毒性[40]。在齐墩果酸的结构修饰过程中,嘧啶类化合物对乳腺癌细胞具有普遍的抑制活性,其活性优于阳性药物依托泊苷[41]。
Zhang等[39]设计合成了环A稠合氮杂环衍生物,并对其抗肿瘤活性进行了评价。首先用氯铬酸吡啶(PCC)氧化PD,再用邻苯二胺、乙二胺、硫、吗啉、盐酸联氨等试剂进行反应得到氮杂环衍生物(图12、13)。在所合成的人参二醇氮杂环衍生物中,20(R)-20,25-环氧-[5,4-b]-吡唑-12β-达玛烷(41)与阳性对照5-Fu和母体化合物PD相比,显示出优越的抗肿瘤活性及抗增殖活性,而且活性明显高于其他衍生物。根据SAR分析,对于A549细胞和8901细胞而言,20(R)-[2,3-b]-吡嗪-达玛烷-12β,20,25-三醇(44)具有良好的抗癌细胞增殖活性,是阳性对照5-Fu的2.6倍。另外,细胞毒性研究结果表明,所有衍生物对正常细胞表现出较低的细胞毒活性。
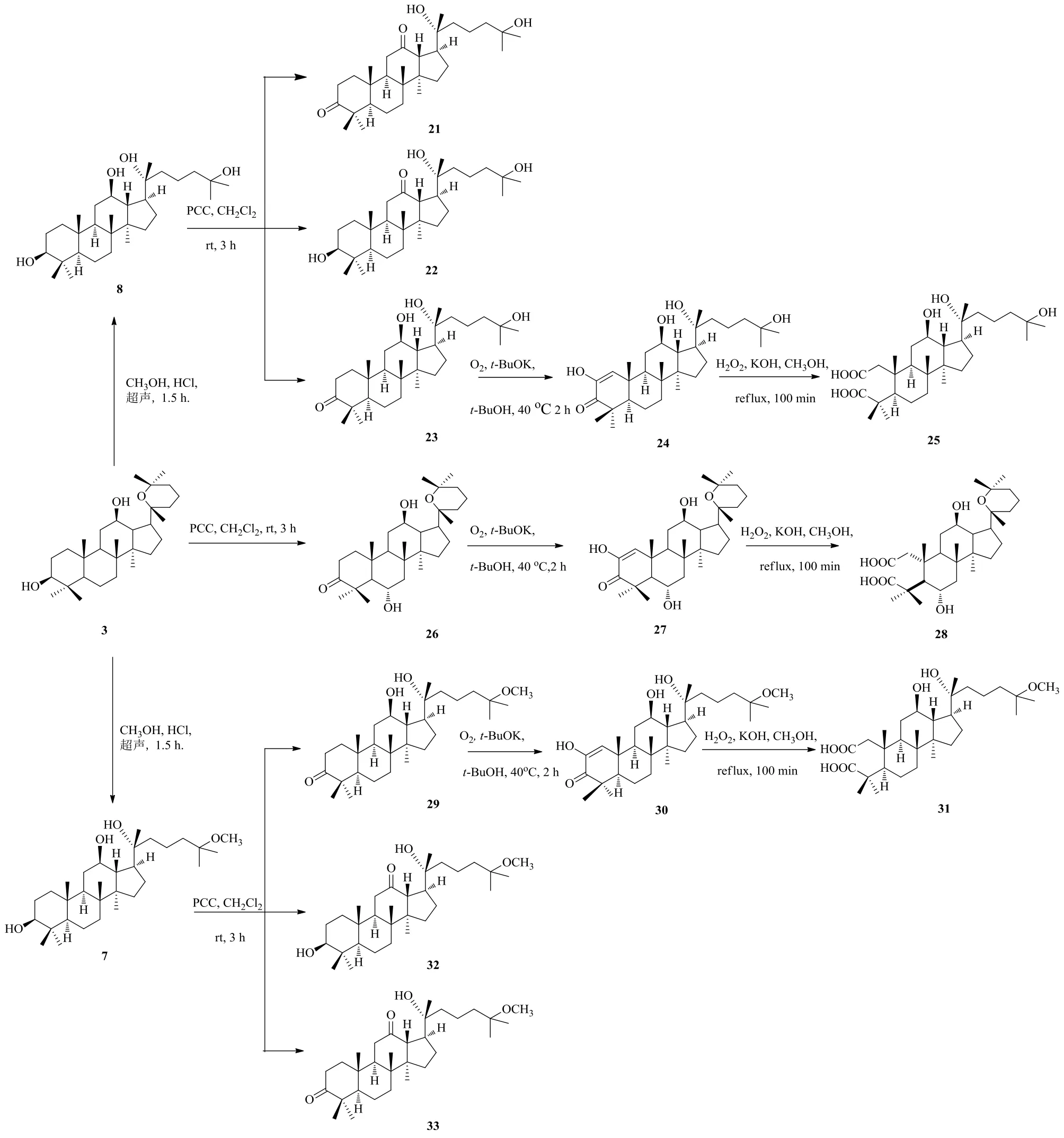
图11 人参二醇的氧化路线图Fig. 11 Oxidation route map of ginsengdiol
在所合成的化合物中,吡唑啉化合物41的活性比其他衍生物高得多,推测这与其特殊的A环稠合吡唑啉结构有关;C-17连有链状结构片段的吡嗪化合物44比C-17连有环状结构片段的吡嗪化合物21d具有更出色的抗癌增殖活性;化合物44与43相比,除了HeLa细胞以外,对其它癌细胞的抗癌效果显著提高,这可能是由于其C-12位所连基团是羟基而非羰基有关[39]。
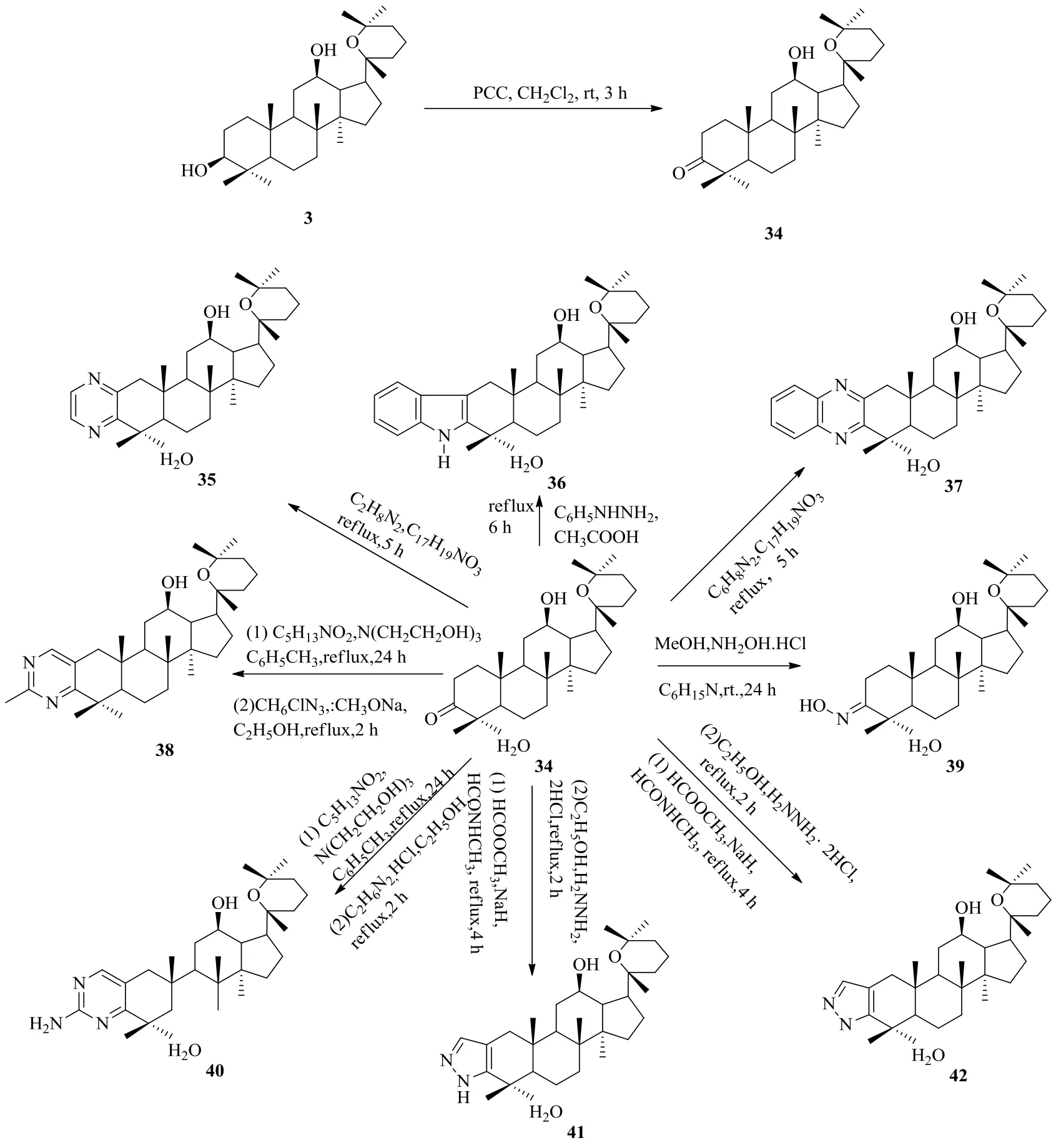
图12 人参二醇氮杂环衍生化路线1Fig. 12 Route 1: Derivatization of ginsengdiol saponins via nitrogen heterocycle
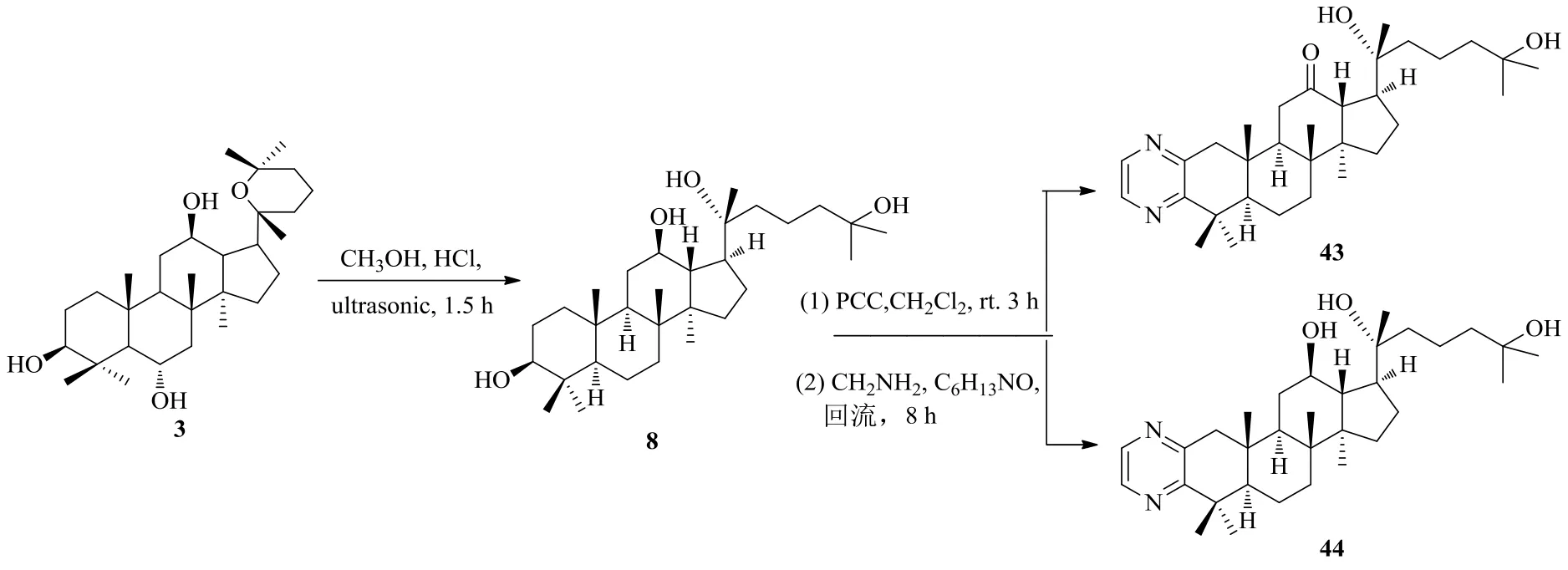
图13 人参二醇氮杂环衍生化路线2Fig. 13 Route 2: Derivatization of ginsengdiol saponins via nitrogen heterocycle
咪唑具有2个sp2杂化氮原子的五元芳杂环化合物,具有独特的药理活性,如抗惊厥、抗菌、抗癌、抗炎、抗肿瘤、抗病毒、抗溃疡、镇痛等药理活性。将咪唑基团引入药物中,还会引发一些特殊的生物活性[42]。因此备受研究者关注。
甾体咪唑类化合物具有很高的医用价值。张严磊[43]将具有达玛烷甾体结构的人参二醇、人参三醇与咪唑基团连接,设计了系列甾体咪唑衍生物。人参二醇未能合成咪唑衍生物,但人参三醇成功合成多个人参三醇氧化产物的咪唑衍生物及人参三醇氧化产物的咪唑盐衍生物(图14)。
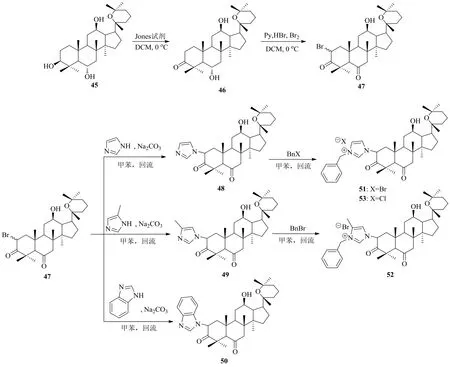
图14 人参三醇酮的咪唑及取代咪唑衍生化Fig. 14 Derivatization of ginsengtriolone via imidazole and substituted imidazole
张严磊[43]首先用琼斯试剂将人参三醇(45)的C-2位和C-6位的羟基氧化生成人参三醇酮(化合物46),再用溴代试剂对化合物46的C-2位进行溴代得化合物47,在甲苯中与咪唑及咪唑衍生物加热回流,分别得到人参三醇-2-溴-3,6-二酮与咪唑、甲基咪唑和苯并咪唑的反应产物48、49和50。最后将生成的化合物48与卤化苄反应合成了人参三醇酮溴代物咪唑盐51和52;化合物24与氯化苄生成人参三醇酮氯代物咪唑盐31。对HL60人急性髓系白血病细胞的抗癌活性研究表明,化合物48、51、52显示较好的抗癌活性,其中化合物51的活性最强,其效果好于顺铂。
7 其他
人参皂苷的修饰方法还有烷基化、氚化还原等方法。例如姜竹韵[44]分别采用Purdie法、Haworth法、Hakomori法和Cicanu法对人参皂苷Rg2分子中的C-12位羟基进行了甲基化结构修饰研究,以改变人参皂苷Rg2的极性,改善其功能。而吴久伟等[45]将原人参二醇溶解在氯仿中,用重铬酸钾氧化得到原人参二醇氧化物,再利用新制的硼氚化钠对原人参二醇进行氚化还原,得到 [3,12-3H] 原人参二醇。所得还原产物经过分析发现,其各项指标均能满足药学和医学相关研究要求,有助于提高人参皂苷在癌症治疗和诊断上的应用。
8 结语与展望
人参皂苷是人参的主要生物活性成分,特别是通过人参皂苷的降解得到的次级稀有人参皂苷显示良好的抗癌[46-47]、改善记忆[48]、神经保护[48]等药理作用,受到广泛关注。同时,因次级稀有人参皂苷水溶性低、生物利用度小的问题,应用受到一定限制,因此化学方法修饰人参皂苷逐渐成为国内外研究的热点。
通过人参皂苷的酰基化法、硫酸化法、PEG修饰法、氨基酸法、氧化法、氮杂化法、烷基化法、氚化还原法等对人参皂苷进行结构修饰,可以有效提高人参皂苷的水溶性、稳定性、靶向性、从而提高生物利用率,显著提高人参皂苷的药物活性。
人参皂苷的结构修饰中,酰基化法、硫酸化法、PEG修饰法、氨基酸法均是通过人参皂苷中特定羟基与衍生化试剂通过酯化和酯交换反应引入酯基从而改变其物理和生物活性,不同的衍生化试剂根据其结构的不同有不同的改性效果。人参皂苷通过酰基化法、硫酸化法、PEG修饰法、氨基酸法引入酯基,可以有效降低人参皂苷对正常细胞的毒副作用,提高抗癌、抗炎等药物活性;酰基化衍生物中,短脂肪链酰基(如乙酰基)或乙酰水杨酰基的引入可以有效提高人参皂苷的抗癌活性,长脂肪链酰基的引入降低抗癌活性;人参皂苷通过PEG修饰、硫酸化和氨基酸修饰均能显著提高人参皂苷水溶性和生物利用度,其中,PEG法还可以使人参皂苷稳定性增大、在癌细胞适宜生存的微酸环境中可以有效释放药物,从而提高药物的靶向性,是人参皂苷对癌细胞靶向治疗的一种可行方法。
人参皂苷的氮杂化产品毒性较小,对人参皂苷的氮杂化研究表明,不同杂环结构的引入可以影响人参皂苷抗癌活性的高低,即有些杂环的引入使抗癌活性显著提高,有些杂环反而降低抗癌活性。另外,杂环的影响也与人参皂苷本身结构有密切关系,说明人参皂苷的抗癌活性并不是分子结构中单一结构片段起作用,而是多官能团的共同协同作用。
综上所述,良好的水溶性及靶向性可以提高药效,改善药物在人体内的药代动力学特性。人参皂苷的理化性质与其羟基数量、母核结构、所连基团大小和数量及连接位置等因素有关。使用化学方法对人参皂苷分子的结构进行修饰,为提高人参皂苷生物利用率提供了重要方向。随着近年来药物领域的迅速发展,新的技术、新的方法层出不穷,人参皂苷的修饰技术也将不断创新,更多的人参皂苷衍生化产品有望应用于临床。
利益冲突 所有作者均声明不存在利益冲突
[1] Kim J H, Yi Y S, Kim M Y,et al. Role of ginsenosides,the main active components ofPanax ginseng, in inflammatory responses and diseases [J].J Ginseng Res,2017, 41(4): 435-443.
[2] Gao Y, Chu S F, Zhang Z,et al. Hepataprotective effects of ginsenoside Rg1-A review [J].J Ethnopharmacol,2017, 206: 178-183.
[3] Shao J J, Zheng X Y, Qu L L,et al. Ginsenoside Rg5/Rk1ameliorated sleep via regulating the GABAergic/serotoninergic signaling pathway in a rodent model [J].Food Funct, 2020, 11(2): 1245-1257.
[4] Jin Y, Kim J H, Hong H D,et al. Ginsenosides Rg5and Rk1, the skin-whitening agents in black ginseng [J].J Funct Foods, 2018, 45: 67-74.
[5] Liang L D, He T, Du T W,et al. Ginsenoside‑Rg5induces apoptosis and DNA damage in human cervical cancer cells [J].Mol Med Rep, 2015, 11(2): 940-946.
[6] Tam D N H, Truong D H, Nguyen T T H,et al.Ginsenoside Rh1: A systematic review of its pharmacological properties [J].Planta Med, 2018, 84(3):139-152.
[7] Kim J H. Pharmacological and medical applications ofPanax ginsengand ginsenosides: A review for use in cardiovascular diseases [J].J Ginseng Res, 2018, 42(3):264-269.
[8] Xie J T, Wang C Z, Wang A B,et al. Antihyperglycemic effects of total ginsenosides from leaves and stem ofPanax ginseng[J].Acta Pharmacol Sin, 2005, 26(9):1104-1110.
[9] Wang X D, Su G Y, Zhao C,et al. Anticancer activity and potential mechanisms of 1C, a ginseng saponin derivative, on prostate cancer cells [J].J Ginseng Res,2018, 42(2): 133-143.
[10] 王浩, 邹茜. 人参皂苷Rg1调节沉默信息调节因子1对抗晶状体上皮细胞衰老的影响 [J]. 世界中医药, 2021,16(7): 1095-1098.
[11] 刘海宇, 张庆贺, 刘金平, 等. 达玛烷型三萜皂苷结构修饰研究进展 [J]. 中国实验方剂学杂志, 2011, 17(22):269-273.
[12] 杨萍, 崔云秋, 于婷, 等. 人参皂苷Rg3剂型的研究进展 [J]. 国际药学研究杂志, 2017, 44(6): 514-517.
[13] 周武喜, 杨宁, 赵余庆. 人参皂苷类化合物水溶性提升方法的研究进展 [J]. 药物评价研究, 2016, 39(2): 322-327.
[14] Tao C, Zhang J J, Wang J X,et al. Ginsenoside drug nanocomposites prepared by the aerosol solvent extraction system for enhancing drug solubility and stability [J].Pharmaceutics, 2018, 10(3): 95.
[15] Yang L, Zhang Z H, Hou J,et al. Targeted delivery of ginsenoside compound K using TPGS/PEG-PCL mixed micelles for effective treatment of lung cancer [J].Int J Nanomedicine, 2017, 12: 7653-7667.
[16] Wang L F, Cao T T, Chen H T. Treatment of glaucomatous optic nerve damage using ginsenoside Rg1mediated by ultrasound targeted microbubble destruction[J].Exp Ther Med, 2018, 15(1): 300-304.
[17] Chen F, Deng Z Y, Zhang B,et al. Esterification of ginsenoside Rh2enhanced its cellular uptake and antitumor activity in human HepG2 cells [J].J Agric Food Chem, 2016, 64(1): 253-261.
[18] 刘发贵. 人参稀有皂苷脂肪酸修饰及其生物活性研究[D]. 长春: 吉林农业大学, 2011.
[19] Wei G Q, Zheng Y N, Li W,et al. Structural modification of ginsenoside Rh(2) by fatty acid esterification and its detoxification property in antitumor [J].Bioorg Med Chem Lett, 2012, 22(2): 1082-1085.
[20] Bruno P M, Liu Y P, Park G Y,et al. A subset of platinum-containing chemotherapeutic agents kills cells by inducing ribosome biogenesis stress [J].Nat Med,2017, 23(4): 461-471.
[21] Zhang C H, Li X G, Gao Y G,et al. Synthesis and primary research on antitumor activity of three new panaxadiol fatty acid esters [J].Chem Res Chin Univ,2007, 23(2): 176-182.
[22] Spitz G A, Furtado C M, Sola-Penna M,et al.Acetylsalicylic acid and salicylic acid decrease tumor cell viability and glucose metabolism modulating 6-phosphofructo-1-kinase structure and activity [J].Biochem Pharmacol, 2009, 77(1): 46-53.
[23] Dachineni R, Ai G Q, Kumar D R,et al. Cyclin A2 and CDK2 as novel targets of aspirin and salicylic acid: A potential role in cancer prevention [J].Mol Cancer Res,2016, 14(3): 241-252.
[24] Xu L, Xiao S N, Yuan W H,et al. Synthesis and anticancer activity evaluation of hydrolyzed derivatives of panaxnotoginseng saponins [J].Molecules, 2018, 23(11):3021.
[25] Fu B D, Bi W Y, He C L,et al. Sulfated derivatives of 20(S)-ginsenoside Rh2and their inhibitory effects on LPS-induced inflammatory cytokines and mediators [J].Fitoterapia, 2013, 84: 303-307.
[26] Li L, Chen X Y, Li D,et al. Identification of 20(S)-protopanaxadiol metabolites in human liver microsomes and human hepatocytes [J].Drug Metab Dispos, 2011, 39(3): 472-483.
[27] Xiong J, Sun M J, Guo J X,et al. Active absorption of ginsenoside Rg1in vitroandin vivo: The role of sodium-dependent glucose co-transporter 1 [J].J Pharm Pharmacol, 2009, 61(3): 381-386.
[28] Knop K, Hoogenboom R, Fischer D,et al. Poly(ethylene glycol) in drug delivery: Pros and cons as well as potential alternatives [J].Angew Chem Int Ed Engl, 2010,49(36): 6288-6308.
[29] Sun Y, Yan X L, Yuan T M,et al. Disassemblable micelles based on reduction-degradable amphiphilic graft copolymers for intracellular delivery of doxorubicin [J].Biomaterials, 2010, 31(27): 7124-7131.
[30] Thambi T, Deepagan V G, Yoo C K,et al. Synthesis and physicochemical characterization of amphiphilic block copolymers bearing acid-sensitive orthoester linkage as the drug carrier [J].Polymer, 2011, 52(21): 4753-4759.
[31] Mathiyalagan R, Subramaniyam S, Kim Y J,et al.Synthesis and pharmacokinetic characterization of a pH-sensitive polyethylene glycol ginsenoside CK(PEG-CK) conjugate [J].Biosci Biotechnol Biochem,2014, 78(3): 466-468.
[32] 刘梅, 王莉, 胡凯莉, 等. 人参皂苷Rg1PEG修饰及其稳定性实验研究 [J]. 中国中药杂志, 2012, 37(10):1378-1382.
[33] 刘梅, 王莉, 胡凯莉, 等. 人参皂苷Rg1经PEG修饰前后的组织分布研究 [J]. 中国中药杂志, 2012, 37(12):1747-1750.
[34] 赵海军, 赵维英, 洪泽辉. 聚乙二醇两端修饰依托泊苷及人参皂苷Rh2的自组装胶束构建及其理化性质表征[J]. 中国新药杂志, 2016, 25(17): 2027-2035.
[35] Ensing B, Tiwari A, Tros M,et al. On the origin of the extremely different solubilities of polyethers in water [J].Nat Commun, 2019, 10(1): 2893.
[36] 刘继华. 具有抗癌活性人参皂苷的结构修饰研究 [D].长春: 吉林大学, 2008.
[37] Wang P, Bi X L, Xu J,et al. Synthesis and anti-tumor evaluation of novel 25-hydroxyprotopanaxadiol analogs incorporating natural amino acids [J].Steroids, 2013,78(2): 203-209.
[38] Urban M, Sarek J, Klinot J,et al. Synthesis of A-seco derivatives of betulinic acid with cytotoxic activity [J].J Nat Prod, 2004, 67(7): 1100-1105.
[39] Zhang Y M, Yuan W H, Wang X D,et al. Synthesis,characterization and cytotoxic activity evaluation of ginsengdiol oxidation and nitrogen hybrid derivatives [J].MedChemComm, 2018, 9(11): 1910-1919.
[40] Pettit G R, Inoue M, Kamano Y,et al. Antineoplastic agents. 147. Isolation and structure of the powerful cell growth inhibitor cephalostatin 1 [J].J Am Chem Soc,1988, 110(6): 2006-2007.
[41] Mallavadhani U V, Vanga N R, Jeengar M K,et al.Synthesis of novel ring-A fused hybrids of oleanolic acid with capabilities to arrest cell cycle and induce apoptosis in breast cancer cells [J].Eur J Med Chem,2014, 74: 398-404.
[42] Soni J, Sethiya A, Sahiba N,et al. Contemporary progress in the synthetic strategies of imidazole and its biological activities [J].Curr Org Synth, 2019, 16(8): 1078-1104.
[43] 张严磊. 小桐子化学成分研究及人参二醇、人参三醇结构修饰研究 [D]. 昆明: 云南大学, 2010.
[44] 姜竹韵. 人参皂苷Rg2的甲基化修饰研究 [D]. 长春:东北师范大学, 2018.
[45] 吴久伟, 廖莎, 沈德存. [3,12-3H]原人参二醇的合成[J]. 核化学与放射化学, 2005, 27(3): 190-192.
[46] Zhang D M, Wang A F, Feng J P,et al. Ginsenoside Rg5induces apoptosis in human esophageal cancer cells through the phosphoinositide‑3 kinase/protein kinase B signaling pathway [J].Mol Med Report, 2019, doi:10.3892/mmr.2019.10093.
[47] An K S, Choi Y O, Lee S M,et al. Ginsenosides Rg5and Rk1enriched cultured wild ginseng root extract bioconversion ofPediococcus pentosaceusHLJG0702:Effect on scopolamine-induced memory dysfunction in mice [J].Nutrients, 2019, 11(5): 1120.
[48] Shao J J, Zheng X Y, Qu L L,et al. Ginsenoside Rg5/Rk1ameliorated sleep via regulating the GABAergic/serotoninergic signaling pathway in a rodent model [J].Food Funct, 2020, 11(2): 1245-1257.
Research progress on ginsenoside derivatization and its biological activities
ZHANG Hao-ran, YE An-qi, ZHANG Yue-wei, CHENG Le-qin
Department of Pharmacy and Applied Chemistry, Jilin Institute of Chemical Technology, Jilin 132022, China
Ginsenosides are the main biologically active components of ginseng, especially the secondary rare ginsenosides which are degradation products, have extensive biological activities. However, due to the characteristics of their structures, the low water solubility and the low bioavailability largely limit their applications. Modification of the molecular structure of ginsenosides by chemical methods can effectively improve the water solubility and targeting properties of ginsenosides, thereby increasing the bioavailability and significantly improving the drug activity of ginsenosides. This article reviews and compares the latest research advances in the modification methods and biological activity research of ginsenosides, which provides references for further studies on the chemical modification and potential utilization value of ginsenosides and their applications in food, medicine and other fields.
ginsenosides; secondary rare ginsenosides; chemical modification; derivatization; biological activity
R284
A
0253-2670(2022)14-4554-14
10.7501/j.issn.0253-2670.2022.14.033
2021-11-08
吉林省科技厅重点科技研发项目(20180201073YY);吉林化工学院重大研发项目(吉化院合字[2015]第005号)
张浩然(1998—),女,内蒙古通辽人,硕士研究生,主要从事人参皂苷结构修饰研究。E-mail: 1656248294@qq.com
*通信作者:成乐琴(1969—),女(朝鲜族),黑龙江林口人,教授,主要从事天然产物结构修饰及药物合成。E-mail: chengleqin@126.com
[责任编辑 王文倩]
