内生真菌生物转化提高滇重楼皂苷含量及抗肿瘤作用研究
2022-07-21刘德柱陈艺杨李早慧都晓伟
刘德柱,陈艺杨,张 蒙,田 雨,李早慧,于 丹,都晓伟
内生真菌生物转化提高滇重楼皂苷含量及抗肿瘤作用研究
刘德柱,陈艺杨,张 蒙,田 雨,李早慧,于 丹*,都晓伟*
黑龙江中医药大学,黑龙江 哈尔滨 150040
研究内生真菌-C39生物转化提高滇重楼药材皂苷类化学成分的含量,并增强重楼对癌细胞增殖的抑制作用,初步探讨主要甾体皂苷的生物转化机制。将内生真菌-C39分别与滇重楼药材固体发酵和与重楼总皂苷提取物液体发酵,比较发酵前后重楼总皂苷和重楼皂苷I、II、VII的含量变化及对肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞增殖抑制作用的差异;采用UPLC/Q-TOF-MS技术研究发酵前后重楼皂苷类化学成分的变化,并结合甾体皂苷生物合成途径推测内生真菌-C39生物转化提高重楼皂苷含量的机制。与滇重楼药材相比较,发酵物中的重楼总皂苷、重楼皂苷I、II和VII的含量显著提高,对3种癌细胞增殖的抑制作用显著增强;人参皂苷Th、pseudoproto-Pb和parisyunnanoside B为-C39菌株生物转化提高重楼皂苷I、II和VII含量的主要前体物质,它们在-C39菌株的作用下发生了C26糖基水解和环化反应,分别生成了重楼皂苷I、II和VII。内生真菌-C39可生物转化提高重楼皂苷含量,并增强重楼的抗肿瘤作用,转化机制可能与-C39真菌促使重楼皂苷前体物质发生糖基水解和环化反应相关。
内生真菌;滇重楼;微生物转化;重楼皂苷I;重楼皂苷II;重楼皂苷VII;抗肿瘤活性
百合科植物滇重楼Smith var.(Franch.) Hand. -Mazz.是常用中药材重楼的基原植物[1],其主要活性成分为甾体皂苷类化合物[2]。重楼皂苷按化学结构可分为2大类:一类以薯蓣皂苷元为母核,如重楼皂苷I、重楼皂苷II等;另一类以偏诺皂苷元为母核,如重楼皂苷VI、重楼皂苷VII等[3]。现代药理学研究证明,重楼皂苷具有较强的抗肿瘤、止血、镇痛、镇静和免疫调节等作用[4],例如重楼总皂苷能抑制肺癌细胞[5]、鼻咽癌细胞[6]、胃癌细胞的增殖[7];重楼皂苷I对肺癌细胞[8]和结肠癌细胞[9]具有抑制作用;重楼皂苷VI、VII对肝癌细胞有抑制作用[10]。除了作为药材单独使用外,重楼还是云南白药、宫血宁胶囊等上百种中成药的主要原料[11],市场需求量大,药材价格已由20世纪七八十年代的20~30元/kg暴涨至现今1500元/kg左右。大量的采挖使得野生重楼资源日益减少,而人工驯化栽培重楼又存在着生长缓慢,繁殖率低等困难。因此,如何利用现代技术和手段提升其有效成分含量,增强其药理活性,对保护重楼野生资源,提高有限资源的利用率,研制和开发以重楼药效成分为原料的药物具有重要的意义。
微生物转化技术是获得低成本、高活性药物的重要途径。课题组前期从穿龙薯蓣Makino中分离筛选出一株可生物转化提高薯蓣皂苷含量的内生真菌-C39,本研究将其与滇重楼药材共同发酵培养,通过对发酵前后重楼主要皂苷成分的分析以及抑制癌细胞增殖作用的考察,明确内生真菌-C39生物转化提高滇重楼皂苷含量及抗肿瘤的作用,并初步探讨主要甾体皂苷成分的生物转化机制。
1 仪器与材料
1.1 仪器
2965-2996型HPLC仪、ACQUITY UPLC (Waters,美国);Triple-TOF TM 5600+质谱仪、数据采集软件Analyst TF 1.6 software、数据处理软件系统PeakView 2.0/masterview 1.0 software、MarkerView 1.2.1(AB SCEIX公司,美国);Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)(Waters公司,美国);Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm)(北京迪马科技有限公司);CO2培养箱(香港力康公司);Multiskan FC型酶标仪(Thermo公司,美国);AB204-N型电子分析天平(梅特勒-托利多上海有限公司);BXM-30R型全自动高压灭菌锅、BJ-CD型洁净工作台、SPX-150C型恒温恒湿箱、DSD-150型振荡培养箱(上海博迅实业有限公司医疗设备厂)。
1.2 材料
滇重楼药材购自云南麻栗坡药材公司(批号1801031SK1),经黑龙江中医药大学中药鉴定学教研室都晓伟教授鉴定为滇重楼Smith var.(Franch.) Hand. -Mazz.的干燥根茎;-C39菌株由本实验室分离,于4 ℃冰箱保存,通过形态与分子鉴定确定该菌株为;对照品重楼皂苷I(批号111590-201604)、重楼皂苷II(批号111591-201604)、重楼皂苷VI(批号111592-201604)、重楼皂苷VII(批号111593-201604)、伪原薯蓣皂苷(批号 111855-201402)、薯蓣皂苷元(批号1539-200001)和偏诺皂苷元(批号16091802)均购自中国药品生物制品检定所;肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞购于中山大学实验动物中心;胎牛血清购于浙江天杭生物科技股份有限公司;RPMI 1640细胞培养基购于美国Gibco公司;MTT和二甲基亚砜购于Sigma公司;乙腈(色谱纯)购于德国Merck公司;甲酸(色谱纯)购自美国Fisher公司;蒸馏水购自广州屈臣氏食品饮料有限公司;其余试剂均为分析纯。
2 方法
2.1 Fusarium-C39菌株与滇重楼的发酵培养
2.1.1 固体发酵 精确称取滇重楼药材粗粉2 g,置100 mL锥形瓶中,用4 mL蒸馏水润湿12 h,聚丙烯膜封口,121 ℃湿热灭菌30 min,待冷却后于无菌条件下接种-C39菌种子液2.3 mL,置于恒温恒湿箱28 ℃静止培养20 d。
2.1.2 液体发酵 称取2 g滇重楼药材粗粉,加70%乙醇50 mL回流2次,每次提取2 h,合并醇溶液,减压回收至干得药材提取物。用PD液体培养基150 mL转移药材提取物至250 mL锥形瓶中,聚丙烯膜封口,121 ℃湿热灭菌30 min。待冷却后于无菌操作台接种-C39菌种子液1.2 mL,置于恒温振荡培养箱中,120 r/min,28 ℃培养7 d。平行培养-C39菌株做空白对照。
2.2 滇重楼发酵前后总皂苷和重楼皂苷I、II、VII的含量测定
2.2.1 固体发酵前后总皂苷和重楼皂苷I、II、VII的含量测定 取2 g重楼药材的固体发酵物,加70%乙醇140 mL超声提取2次,每次40 min,抽滤,合并滤液,回收至干后再加水溶解。水溶液分别用石油醚和水饱和正丁醇萃取,取正丁醇部位,回收至干。以未发酵的滇重楼药材做随行对照。残渣加甲醇定容至10 mL,采用紫外-可见分光光度法测定重楼总皂苷含量[12];采用HPLC法测定重楼皂苷I、II和VII的含量,色谱条件为:Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm),乙腈(A)-水(B)为流动相梯度洗脱:0~25 min,40%~60% A;25~35 min,60%~40% A,体积流量1.0 mL/min,检测波长203 nm,柱温30 ℃,进样量20 μL。
2.2.2 液体发酵前后总皂苷和重楼皂苷I、II、VII的含量测定 取150 mL液体发酵物,将菌丝和菌液抽滤分离,菌丝加入50 mL水饱和正丁醇超声3次,每次30 min;菌液减压回收至20 mL,加入等体积水饱和正丁醇萃取3次,合并菌丝和菌液萃取液,减压回收至干。以未发酵的滇重楼药材提取物做随行对照。样品处理方法和含量测定方法同“2.2.1”项下。
2.3 重楼固体发酵前后对癌细胞增殖的抑制作用实验
按照“2.2.1”项下制备实验样品,取正丁醇部位冻干。以DMSO溶解冻干粉,配制成10 mg/mL的母液4 ℃保存,使用时用无血清培养基稀释母液到所需浓度,除菌滤过,备用。采用MTT法[13]测定各实验样品对肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞增殖的抑制作用。
2.4 重楼皂苷I、II和VII的液相-质谱分析
2.4.1 对照品溶液的制备 分别精密称取适量重楼皂苷I、II、VI、VII,伪原薯蓣皂苷,薯蓣皂苷元以及偏诺皂苷元对照品,配制成各对照品浓度均为0.1 mg/mL的混合对照品溶液。
2.4.2 供试品溶液的制备 精确量取150 mL发酵液浓缩至20 mL,加乙醇至80%,沉淀12 h,抽滤,旋干,80%乙醇定容,获得供试品溶液。
2.4.3 色谱条件 Waters Acquity UPLC BEH C18色谱柱(5 mm×2.1 mm,1.7 μm);柱温40 ℃;流动相为0.1%甲酸水(A)-0.1%甲酸乙腈(B);梯度洗脱:0~2 min,95%~60% A;2~22 min,60%~0 A;22~22.1 min,0~95% A;22.1~25 min,95% A;体积流量0.3 mL/min;进样量2 μL。
2.4.4 质谱条件 电喷雾离子源(ESI);正负离子交替扫描;离子源温度550 ℃;碰撞电压500 V;裂解电压80 V;碰撞能量40 eV;碰撞能量扩展15 eV;氮气为雾化气体;辅助气Gas1和Gas2均为55 psi(1 psi=6.895 kPa);气帘气Cur Gas为35 psi。一级质谱母离子扫描范围为80~1500,相关信息扫描(IDA)设置响应值超过100 cps的最高峰进行二级质谱扫描,子离子扫描范围为/50~1500,开启动态背景扣除(DBS)。
2.4.5 数据分析 (1)通过质谱处理工作站(Markerview)对数据进行筛查,获取发酵前后样品数据的分型信息,选择发酵前后有显著性差异(<0.05)且离子强度差异倍数(Fold Change)>1.5倍的离子作为发酵前后的差异化合物。(2)依据精确质量数及同位素丰度比确定差异化合物的分子式,通过与对照品和数据库的二级谱图比对以及裂解规律分析,并结合现有文献报道[14-20],最终确定结构式。(3)结合甾体皂苷的生物合成途径从差异化合物中挖掘生物转化生成重楼皂苷I、II和VII的前体物质,解析发酵后重楼皂苷I、II和VII含量提升的机制。
2.5 统计学处理
采用SPSS 18.0统计软件对数据分析和处理,计量资料以表示,采用检验,以值小于0.05为有统计学意义。
3 结果与分析
3.1 Fusarium-C39菌发酵提高滇重楼皂苷类成分的含量
重楼皂苷对照品、-C39空白菌液、滇重楼原药材、滇重楼原药材乙醇提取物、滇重楼固体发酵物、滇重楼液体发酵物的HPLC图见图1,滇重楼固体发酵物和液体发酵物中重楼皂苷的增长率见图2。与滇重楼原药材比较,固体发酵物和液体发酵物中总皂苷、重楼皂苷I、重楼皂苷II以及重楼皂苷VII的含量均有显著提高。如图2所示,采用固体发酵方法,-C39菌使重楼总皂苷、重楼皂苷I、重楼皂苷II和重楼皂苷VII的含量分别提高了60.01%、86.36%、75.60%和52.07%;液体发酵物中重楼总皂苷、重楼皂苷I、重楼皂苷II和重楼皂苷VII的含量分别提高了28.89%、61.89%、48.81%和27.63%。可见,-C39菌通过发酵能够生物转化提高滇重楼中重楼皂苷成分的含量。

A-Fusarium-C39发酵液 B-重楼皂苷对照品 C-重楼药材 D-重楼固体发酵物 E-重楼皂苷提取物 F-重楼液体发酵物 1-重楼皂苷VII 2-重楼皂苷II 3-重楼皂苷I

图2 Fusarium-C39菌与滇重楼固体发酵(A)和液体发酵(B)对重楼皂苷的增长率
3.2 滇重楼固体发酵物抑制癌细胞增殖实验结果
MTT实验结果见图3,在0~500 μg/mL浓度范围内,滇重楼固体发酵前后的总皂苷提取物均具有抑制肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞增殖的作用。滇重楼原药材的总皂苷提取物对肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞的IC50值分别为43.37、276.18、66.75 μg/mL,而固体发酵物的总皂苷提取物对3种癌细胞的IC50值分别下降为24.07、87.43、17.42 μg/mL。可见与原药材相比较,滇重楼固体发酵后对癌细胞增殖的抑制作用显著增强。

与原药材比较:*P<0.05 **P<0.01
3.3 发酵过程中重楼皂苷I、II和VII的生物转化分析
滇重楼发酵物的UPLC-MS总离子流图见图4,相关化合物的MS/MS图见图5,与重楼皂苷I、II和VII生物转化相关的化合物列于表1。采用“2.4.5”项下的方法对UPLC-MS数据进行筛查,与原药材比较,发酵后重楼皂苷I、II和VII的含量明显升高,而化合物Th、pseudoproto-Pb和parisyunnanoside B的含量显著下降。后3种化合物均为呋甾类皂苷,在C26位上连有糖基,经过水解脱去糖基后,开链不稳定而产生环合,可形成螺甾结构的薯蓣皂苷。根据已有报道的甾体皂苷生物合成途径分析[21],推测发酵过程中,滇重楼中的Th、pseudoproto-Pb和parisyunnanoside B等成分在-C39真菌高表达水解酶的作用下,其C26上连接的糖基首先发生水解,然后脱去糖基的部位再环合,分别转化成重楼皂苷VII、重楼皂苷II和重楼皂苷I,从而使发酵物中的3种重楼皂苷含量显著提升。课题组对不同发酵时间-C39菌株转录组学分析中也发现,-C39菌株在与滇重楼发酵过程中,羟基化、羰基化、糖基化和水解等酶的相关基因表达均上调,发挥了结构修饰作用,从代谢酶角度佐证了对生物转化途径的推测。化合物生物转化途径见图6。

1-Th 2-pseudoproto-Pb 3-parisyunnanoside B 4-重楼皂苷VII 5-重楼皂苷II 6-重楼皂苷I
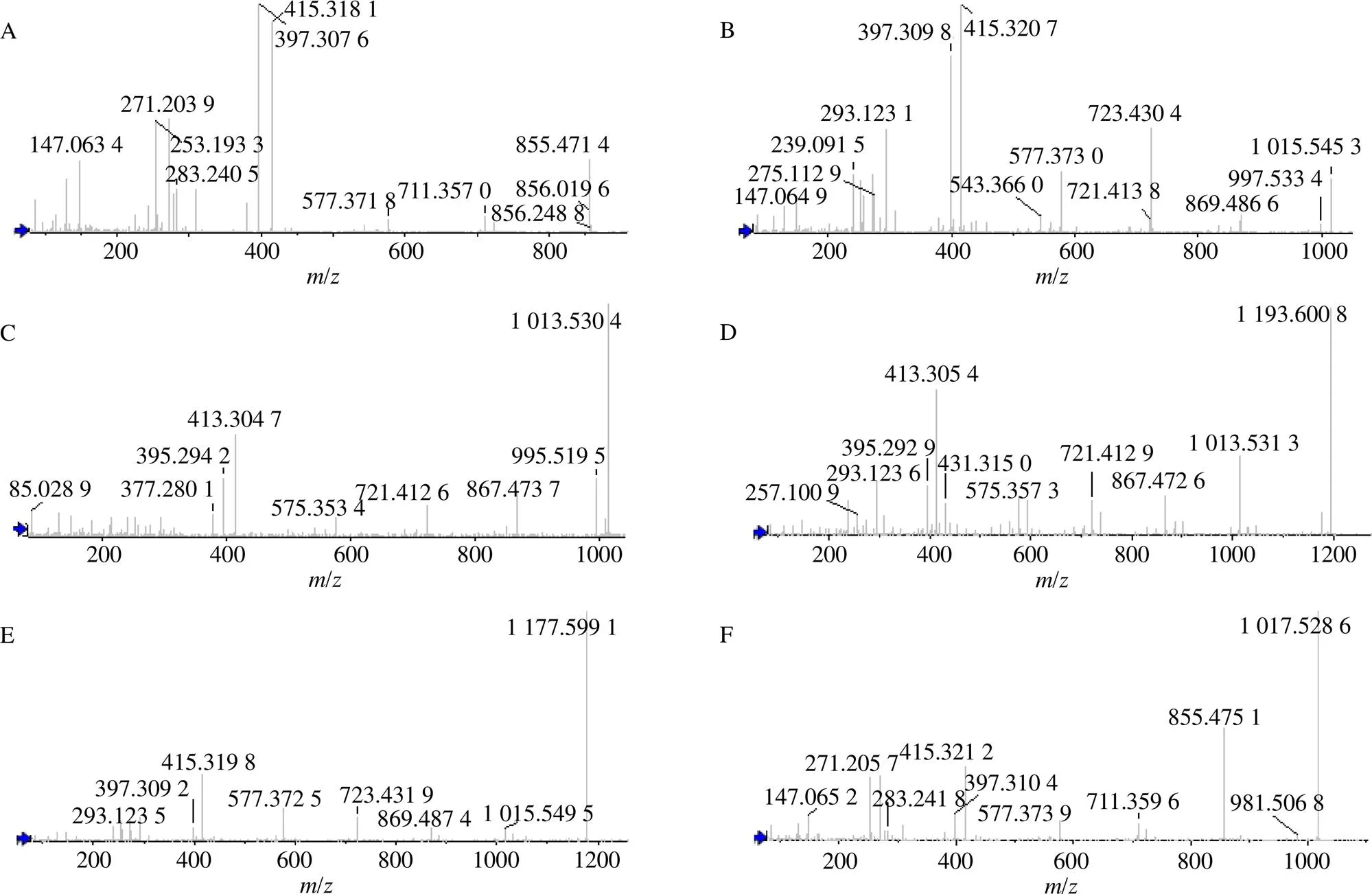
A-重楼皂苷I B-重楼皂苷II C-重楼皂苷VII D-Th E-pseudoproto-Pb F-parisyunnanoside B
表1 发酵过程中与重楼皂苷I、II和VII生物转化相关的化合物
Table 1 Compounds related to biotransformation of polyphyllin I, II and VII during fermentation
峰号tR/min选择离子测定值(m/z)误差×10−6分子式主要二级碎片离子(MS/MS)及来源鉴定结果变化趋势 1 4.63[M+H−H2O]+1 193.599 02.93C57H94O271 193.596 9, 1013.533 8, 927, 6557, 721.413 4, 593.3686, 431.313 1, 413.305 1Th下降 2 6.56[M+H]+1 177.606 55.01C57H92O251 177.599 1, 1015.549 5, 869.487 4, 723.431 9, 577.372 5, 415.319 8, 397.309 2pseudoproto-Pb下降 3 6.73[M+H]+1 017.529 42.26C50H82O221 017.524 4, 855.468 3, 723.430 3, 577.370 1, 415.325 8, 271.207 1, 253.197 4parisyunnanoside B下降 412.15[M+H−H2O]+1 013.536 64.34C51H82O211 013.532 3, 867.472 9, 721.413 8, 575.358 4, 413.305 4, 395.294 7, 269.189 9, 251.179 1重楼皂苷 VII提升 515.88[M+H]+1 015.551 43.64C51H82O201 015.545 3, 869.486 6, 723.430 4, 577.372 9, 415.320 7, 397.309 7, 271.206 1, 253.195 4重楼皂苷 II提升 616.23[M+H]+ 855.476 12.22C45H72O17885.470 3, 723.426 2, 577.370 1, 433.256 3, 415.317 9, 397.307 4, 271.203 7, 253.193 0重楼皂苷 I提升
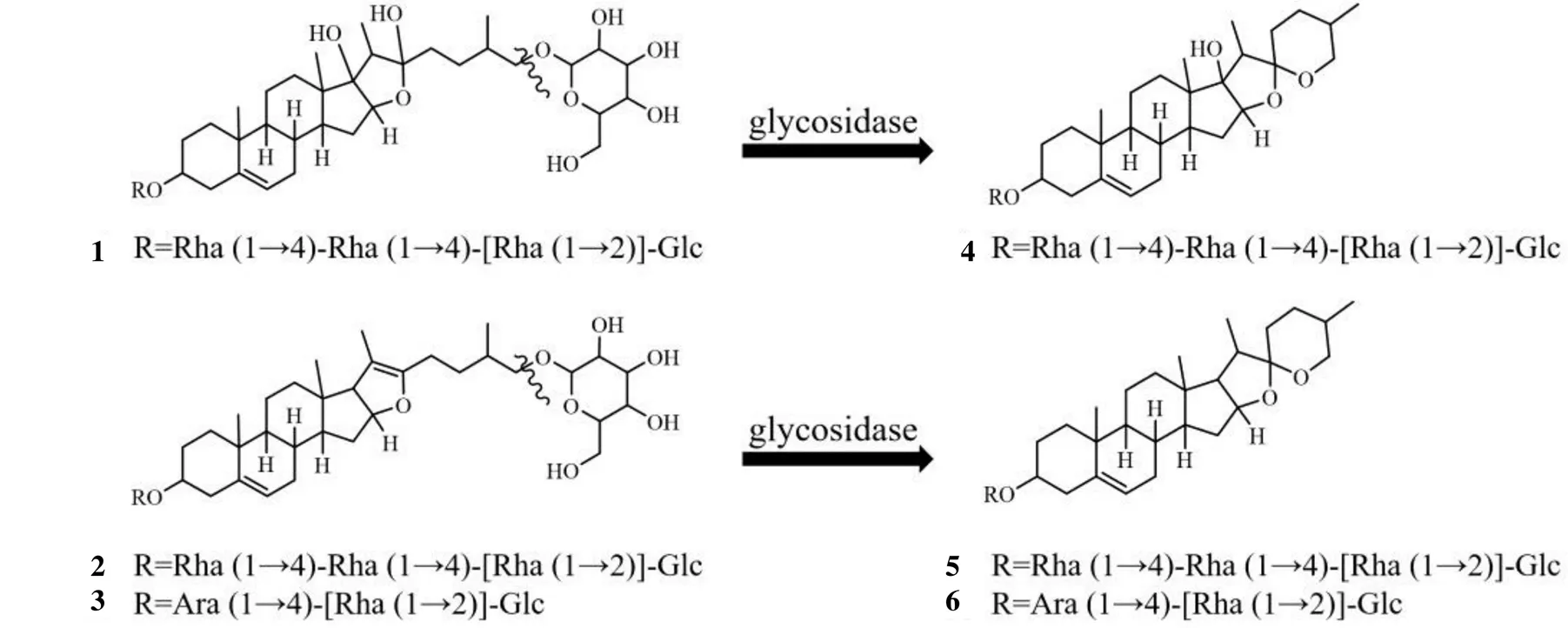
图6 Fusarium-C39菌株促进重楼皂苷I、II和VII生物转化的可能途径
4 讨论
本研究采用微生物转化技术,将-C39菌与滇重楼药材共同发酵培养,使重楼总皂苷、重楼皂苷I、II和VII的含量均大幅度提高。同时发酵后的总皂苷提取物对肝癌HepG2细胞、肺癌A549细胞和结肠癌HT-29细胞增殖的抑制作用也显著提升,这与重楼皂苷I、II和VII具有抑制上述3种癌细胞增殖作用的文献报道相一致[13, 22-24],证明滇重楼发酵后抗癌活性的增强与重楼皂苷I、II和VII的含量升高有关。
-C39菌发酵促使滇重楼中甾体皂苷类成分含量提高的机制,推测是由于滇重楼药材中存在着与这些甾体皂苷类成分生物合成相关的前体物质,当-C39菌与滇重楼药材共培养时,二者之间发生了交互作用。一方面,滇重楼存在下的培养环境影响诱导-C39菌产生了某些特殊的酶,这些生物酶反过来又催化药材中的化学物质发生了结构改变,促使原药材中的前体物质向甾体皂苷类成分的转化,从而实现了发酵后甾体皂苷类成分大幅升高的结果,同时显著提高了滇重楼的抗肿瘤作用。本实验对比了滇重楼发酵前后化学成分的变化,对重楼皂苷I、II和VII的生物转化过程进行了分析与探讨,发现在发生不同程度的升高或降低的多种化学成分中,化合物Th、pseudoproto-Pb和parisyunnanoside B的变化最为显著,参照-C39菌株的转录组学研究结果,结合代谢酶的分析,推测上述3种化合物为-C39菌株生物转化提高重楼皂苷I、II和VII含量的前体物质,它们在-C39菌株代谢酶的作用下发生了糖基水解和环化反应,分别生成了重楼皂苷I、II和VII。
本研究工作证实,-C39菌株具有生物转化提高重楼皂苷I、II和VII含量的作用与能力,将-C39菌株与滇重楼共同发酵为获取重楼皂苷I、II和VII的有效途径。甾体皂苷的生物合成过程极为复杂,迄今为止相关的生物合成途径尚未得到全面阐释,本实验的研究结果对进一步了解和揭示重楼皂苷的生物合成过程,以及重楼药材资源的深入开发和利用具有实际意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部: 2020. 78.
[2] 杨远贵, 张霁, 张金渝, 等. 重楼属植物化学成分及药理活性研究进展 [J]. 中草药, 2016, 47(18): 3301-3323.
[3] Yang Y G, Zhang J, Zhao Y L,. Quantitative determination and evaluation ofvar.with different harvesting times using UPLC-UV-MS and FT-IR spectroscopy in combination with partial least squares discriminant analysis [J]., 2017, 31(7): e3913.
[4] 管鑫, 李若诗, 段宝忠, 等. 重楼属植物化学成分、药理作用研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4838-4852.
[5] Man S L, Gao W Y, Zhang Y J,. Paridis saponins inhibiting carcinoma growth and metastasisand[J]., 2011, 34(1): 43-50.
[6] 陈志红, 龚先玲, 刘义. 重楼总皂苷对人鼻咽癌细胞CNE-2Z周期及凋亡的影响 [J]. 中成药, 2011, 33(1): 25-29.
[7] 保永亮, 龚晓燕, 方海雁, 等. 重楼总皂苷对人胃癌MNK-45和MGC80-3细胞增殖的影响 [J]. 安徽中医学院学报, 2012, 31(6): 51-55.
[8] Li L M, Wu J J, Zheng F,. Inhibition of EZH2 via activation of SAPK/JNK and reduction of p65 and DNMT1 as a novel mechanism in inhibition of human lung cancer cells by polyphyllin I [J]., 2016, 35(1): 112.
[9] 于思, 曹治兴, 杨雨婷, 等. 重楼皂苷I诱导G2/M期阻滞及干扰微管结构抗结肠癌HCT116细胞作用机制 [J]. 中国实验方剂学杂志, 2017, 23(6): 149-154.
[10] Zhang C, Jia X J, Bao J L,. Polyphyllin VII induces apoptosis in HepG2 cells through ROS-mediated mitochondrial dysfunction and MAPK pathways [J]., 2016, 16: 58.
[11] 成莉, 甄艳, 陈敏, 等. 扩大重楼药用资源研究进展 [J]. 中国中药杂志, 2015, 40(16): 3121-3124.
[12] 叶方, 程镇, 杨光义, 等. 紫外-可见分光光度法测定武当山区重楼属植物总皂苷的含量 [J]. 中国药师, 2015, 18(11): 1983-1985.
[13] 颜璐璐, 张艳军, 高文远, 等. 滇重楼皂苷对10种肿瘤细胞株的细胞毒谱及构效关系研究 [J]. 中国中药杂志, 2008, 33(16): 2057-2060.
[14] Zhao Y, Kang L P, Liu Y X,. Steroidal saponins from the rhizome ofand their cytotoxic activities [J]., 2009, 75(4): 356-363.
[15] Negi J S, Bisht V K, Bhandari A K,. Paris: Chemical and biological prospectives [J]., 2014, 14(6): 833-839.
[16] Wu X, Wang L, Wang G C,. New steroidal saponins and sterol glycosides fromvar.[J]., 2012, 78(15): 1667-1675.
[17] Wu X, Wang L, Wang G C,. Triterpenoid saponins from rhizomes ofvar.[J]., 2013, 368: 1-7.
[18] Wu X, Wang L, Wang H,. Steroidal saponins fromvar.[J]., 2012, 81: 133-143.
[19] Kang L P, Liu Y X, Eichhorn T,. Polyhydroxylated steroidal glycosides from[J]., 2012, 75(6): 1201-1205.
[20] Wu X, Chen N H, Zhang Y B,. A new steroid saponin from the rhizomes ofvar.[J]., 2017, 53(1): 93-98.
[21] Nakayasu M, Kawasaki T, Lee H J,. Identification of furostanol glycoside 26--β-glucosidase involved in steroidal saponin biosynthesis from[J]., 2015, 32(4): 299-308.
[22] Zhang C, Jia X J, Bao J L,. Polyphyllin VII induces apoptosis in HepG2 cells through ROS-mediated mitochondrial dysfunction and MAPK pathways [J]., 2016, 16: 58.
[23] Feng F F, Cheng P, Wang C C,. Polyphyllin I and VII potentiate the chemosensitivity of A549/DDP cells to cisplatin by enhancing apoptosis, reversing EMT and suppressing the CIP2A/AKT/mTOR signaling axis [J]., 2019, 18(5): 5428-5436.
[24] You L, Geng H, Yang X,. The comparison analysis of polyphyllin I and its analogues induced apoptosis of colon and lung cancer cells via mitochondrial dysfunction [J]., 2021, 129(1): 15-25.
Study on biotransformation of endophytic fungus to enhance saponins content and antitumour activity of
LIU De-zhu, CHEN Yi-yang, ZHANG Meng, TIAN Yu, LI Zao-hui, YU Dan, DU Xiao-wei
Heilongjiang University of Chinese Medicine, Harbin 150040, China
To study the fermenting effect of endophytic fungus-C39 with Dian chong lou () on enhancing the saponins content and antitumour activity, and preliminarily investigate the biotransformation mechanism of main steroid saponins.The endophytic fungus-C39 was fermented withand total saponins extract, respectively. The contents of total saponins and polyphyllin I, II and VII fromand its fermentation, and the inhibitory effects on the proliferation of HepG2, A549 and HT-29 of them were compared. UPLC/Q-TOF-MS was used to study the changes of saponins before and after fermentation, and the mechanism of biotransformation was deduced by referring with the biosynthesis pathway of steroidal saponins.Compared with, the contents of total saponins, polyphyllin I, II and VII in the fermentation were significantly increased, and the inhibitory effect on the proliferation of tumour cells was significantly enhanced. Th, pseudoproto-Pb and parisyunnanoside B were determined as main precursor substances. They were biotransformed into polyphyllin I, IIand VII by the deglycosylation of C26and cyclization under the catalysis of-C39.Endophytic fungus-C39 could increase the saponins content and enhance the anti-tumor effect ofby fermentation. The transformation mechanism was probably related to the deglycosylation and cyclization of the precursor substances catalyzed by-C39.
endophytic fungus;Smith var.(Franch.) Hand. -Mazz.; microbial transformation; polyphyllin I; polyphyllin II; polyphyllin VII; antitumor activity
R286.2
A
0253 - 2670(2022)14 - 4486 - 07
10.7501/j.issn.0253-2670.2022.14.027
2021-11-13
国家自然科学基金面上项目(81872967)
刘德柱(1986—),男,研究实习员,研究方向为中医药基础研究。E-mail: 253720985@qq.com
于 丹(1980—),女,副教授,研究方向为天然药物质量评价。E-mail: yd10011@163.com
都晓伟(1962—),女,教授,研究方向为天然药物质量评价。E-mail: xiaoweidu@hotmail.com
[责任编辑 时圣明]
